1.4: Carbono
- Page ID
- 85084
Debido a la importancia del CO 2 como gas de efecto invernadero, el ciclo del carbono es una parte crucial del sistema climático. Dado que los intercambios de carbono con la biosfera, los procesos biológicos necesitan ser considerados en la ciencia del clima. El ciclo del carbono forma parte de los ciclos biogeoquímicos más amplios, que incluyen otros elementos químicos biológicamente importantes como el nitrógeno y el oxígeno.
El ciclo del carbono natural
Intercambios de carbono relativamente rápidos entre tres grandes embalses: el océano, la atmósfera y la tierra (Figura 1). De esos el océano contiene más carbono: casi 40,000 Pg. La mayor parte del carbono en el océano está en forma de Carbono Inorgánico Disuelto (DIC), y la mayor parte del DIC reside en las capas intermedias y profundas principalmente porque esas profundidades constituyen la mayor parte de su volumen. La biota marina es importante en la transferencia de carbono de la superficie al océano profundo, pero su biomasa es muy pequeña porque consisten principalmente en algas microscópicas llamadas fitoplancton. El fitoplancton construye la base de la red alimentaria del océano a través de la fotosíntesis. Se han adaptado para ser diminutas y ligeras, para no hundirse hasta el fondo del mar. Necesitan permanecer cerca de la superficie iluminada por el sol para fotosintetizar. Por debajo de unos 100 m de profundidad los niveles de luz son demasiado bajos debido a la absorción por el agua de mar Por lo tanto, el océano profundo es oscuro pero la materia orgánica se hunde allí desde la superficie en diversas formas, por ejemplo, como pellets fecales de zooplancton. Debajo de la superficie, la materia orgánica muerta que se hunde es respirada por bacterias y devuelta al charco de carbono inorgánico. A esto se le llama la bomba biológica porque elimina el carbono de la superficie y la atmósfera y lo secuestra en las profundidades del océano, donde puede permanecer de cientos a miles de años. El gas CO 2 disuelto en el agua de mar forma parte de la piscina DIC. Se intercambia con la atmósfera alrededor de 80 Pg de carbono al año. El intercambio de gases océano-atmósfera depende de la diferencia entre las presiones parciales oceánicas superficiales y atmosféricas (PCo 2; en este libro usamos concentración de PCo 2 y CO 2 como sinónimos en unidades de partes por millón o ppm) y por lo tanto conduce a una concentración fuerte y relativamente rápida acoplamiento de la concentración atmosférica de CO 2 a la superficie del océano.
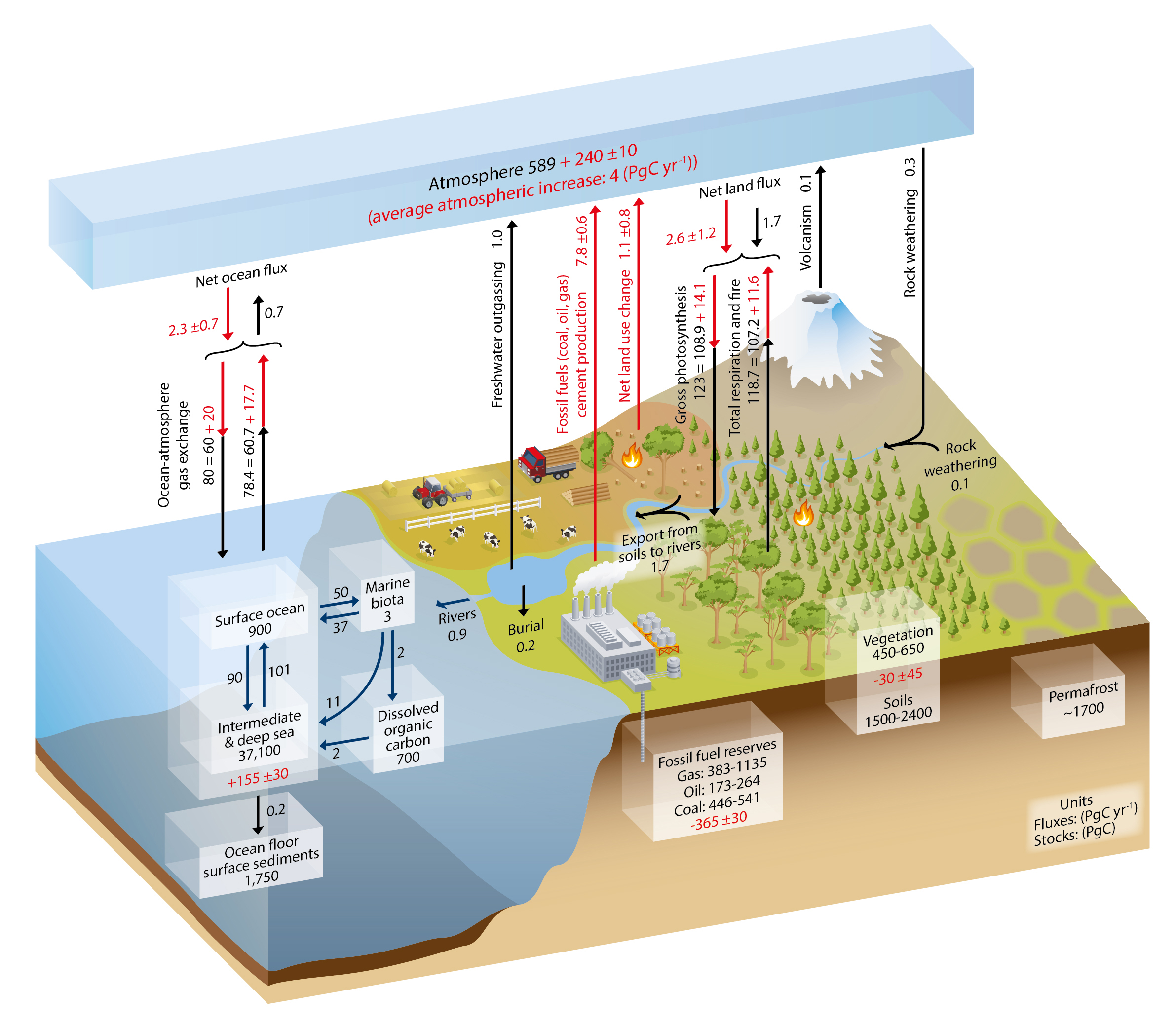
El segundo más grande de los tres reservorios de carbono que intercambian rápidamente es la tierra, que contiene alrededor de 4,000 Pg de carbono. En la tierra el carbono se almacena en la vegetación viva, en los suelos y en el permafrost. Dado que las plantas terrestres no tienen el problema de hundirse de la luz, pueden crecer a lo grande y contener grandes cantidades de carbono, como los árboles. Por lo tanto, se almacena mucho más carbono en la biomasa viva en la tierra (~500 Pg) que en el océano (~3 Pg). Sin embargo, aún más carbono se almacena en suelos y permafrost.
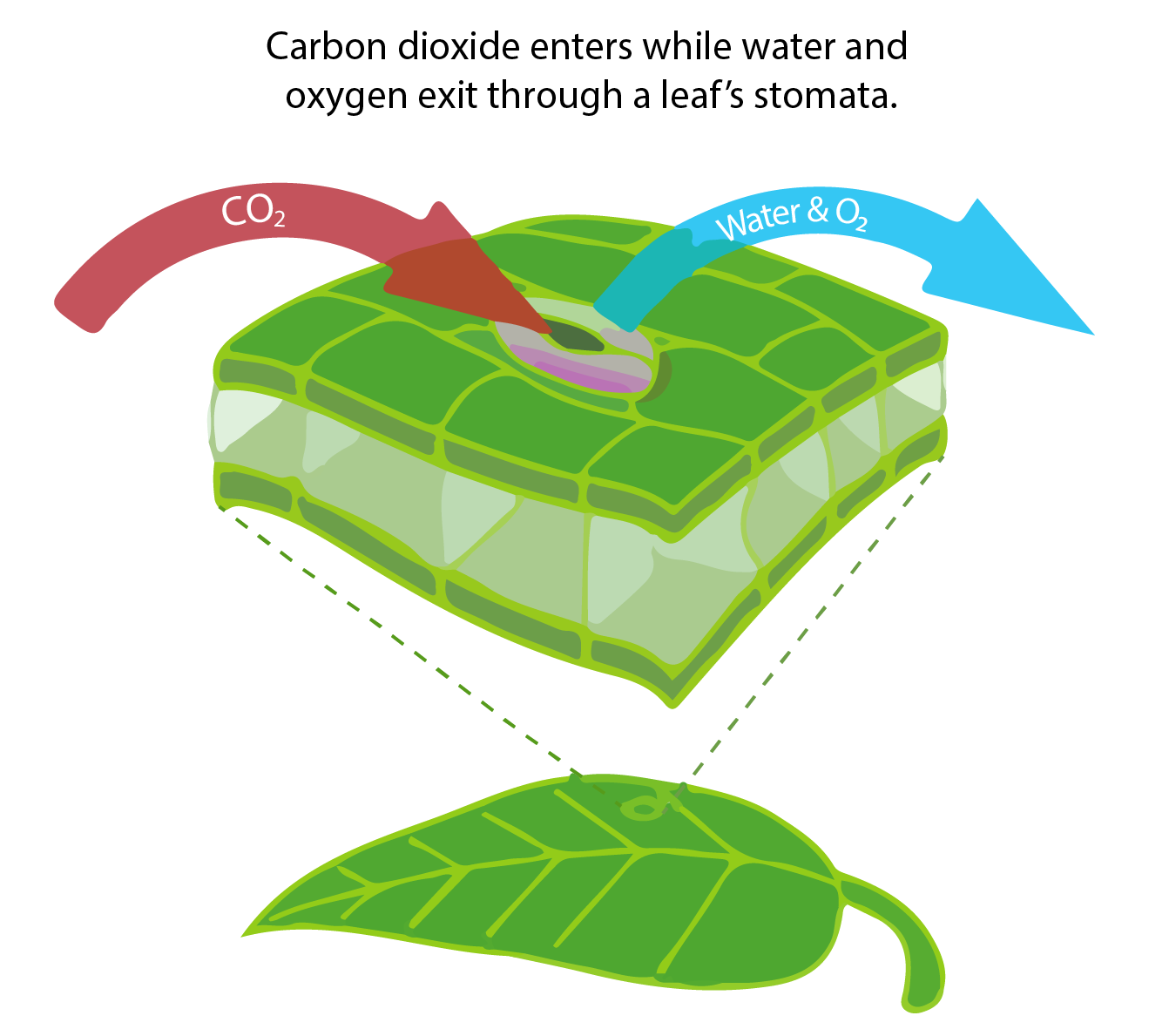
Más de 100 Pg de carbono son retirados de la atmósfera cada año por la fotosíntesis de plantas terrestres y convertidos en materia orgánica. La materia orgánica circula a través de la red alimentaria terrestre y finalmente ingresa al charco de carbono del suelo donde se descompone. Al igual que en el océano, las bacterias y los organismos heterótrofos en la tierra respiran carbono orgánico y lo convierten de nuevo en CO 2 inorgánico. La absorción y liberación de carbono en la tierra no depende fuertemente de las concentraciones atmosféricas de CO 2. Dependen más de la disponibilidad del agua y de la temperatura, respectivamente. El crecimiento de las plantas en tierra está fuertemente limitado por el agua y las tasas de respiración dependen fuertemente de la temperatura. Sin embargo, el CO 2 aumenta la eficiencia en el uso del agua de las plantas terrestres porque a concentraciones más altas de CO 2 no necesitan abrir los estomas tanto como a concentraciones más bajas de CO 2. Los estomas son pequeñas aberturas en las células que permiten la entrada de CO 2, pero también permiten que el agua salga en un proceso llamado transpiración (ver figura en el cuadro a continuación). Así, a niveles más altos de CO 2 las plantas pueden crecer más por la misma cantidad de uso de agua.
El reservorio de carbono atmosférico es relativamente pequeño en comparación con el océano, que es ~40 veces más grande, y la tierra, que es ~10 veces más grande. Sin embargo, la atmósfera es crucial para vincular la tierra y el océano a través de intercambios rápidos.
Recuadro 1: Fotosíntesis y Respiración
La fotosíntesis (Figura B1.1) es el proceso por el cual los organismos autótrofos (plantas, algas y muchas bacterias) producen materia orgánica y oxígeno a partir de CO 2 y agua utilizando la luz como fuente de energía.

Figura B1.1: Reacción Química para Fotosíntesis. El dióxido de carbono y el agua se convierten en carbohidratos y oxígeno. Este proceso utiliza energía.
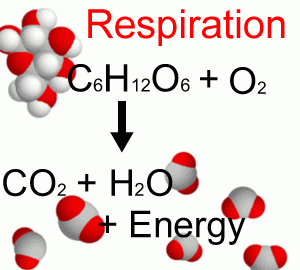
La respiración (Figura B1.2) es el proceso inverso por el cual los organismos heterótrofos (bacterias, hongos, animales y humanos) oxidan los carbohidratos orgánicos para obtener su energía dando como resultado CO 2 y agua.
Para poder fotosintetizar, las plantas terrestres tienen que tomar CO 2 del aire. Esto lo hacen abriendo pequeños poros llamados estomas, a través de los cuales no sólo puede entrar el CO 2, sino que también el agua y el oxígeno pueden salir de la célula (Figura B1.3).
Carbono Antropogénico
Los efectos humanos en el ciclo global del carbono han sido relativamente limitados antes de la revolución industrial, aunque algunas emisiones del cambio de uso de la tierra como la deforestación pueden haber estado ocurriendo durante cientos o miles de años. Sin embargo, durante los últimos 100 años más o menos, la rápida quema de combustibles fósiles como el carbón, el gas y el petróleo han causado una perturbación masiva (Figura 2). Esta perturbación es quizás más evidente en la atmósfera donde las concentraciones de CO 2 han aumentado en más de 40%. En el capítulo 3 hemos visto que los niveles actuales de CO 2 atmosférico no tienen precedentes durante los últimos 800 mil años, pero las reconstrucciones que se remontan más atrás en el tiempo indican que la última vez que la atmósfera de la Tierra tuvo alrededor de 400 ppm de CO 2 es hace unos 3 millones de años.
Actualmente los humanos emiten alrededor de 10 mil millones de toneladas de carbono a la atmósfera por año, principalmente a partir de la quema de combustibles fósiles (~90%). Sin embargo, la deforestación sigue siendo un aporte significativo (~10%). Las emisiones antropogénicas de carbono de la quema de combustibles fósiles han aumentado rápidamente después de la segunda guerra mundial. El océano ha absorbido alrededor del 40% (155/395) de todas las emisiones antropogénicas de carbono hasta ahora. El 60% (240/395) se han mantenido en la atmósfera, mientras que la tierra sale en un lavado por pérdida por deforestación y ganancia por rebrote reciente.
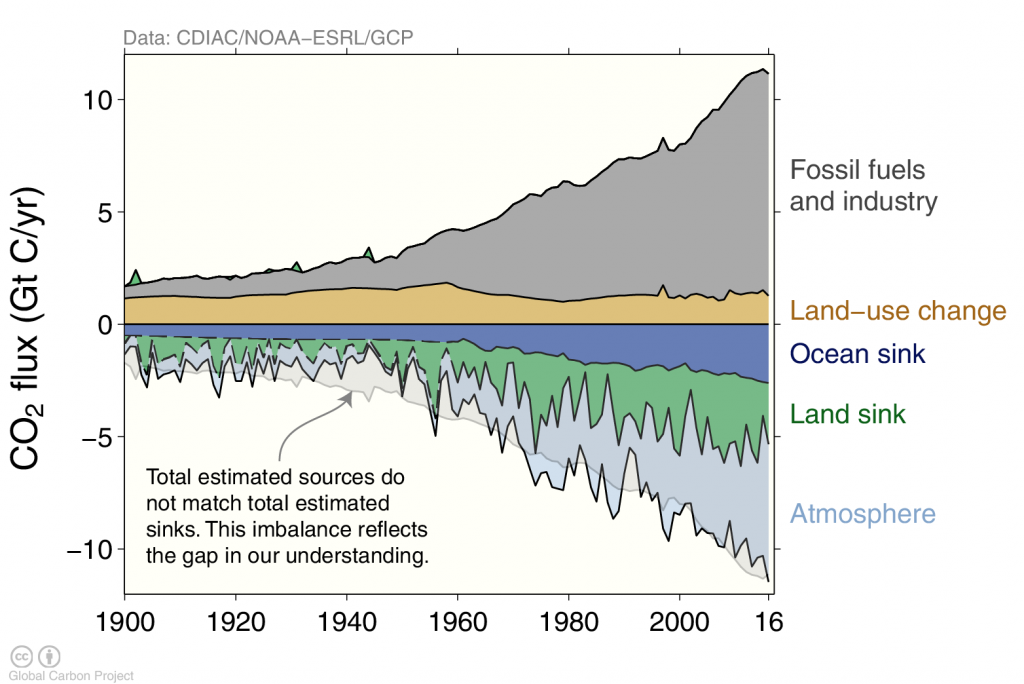
Las emisiones antropogénicas de carbono han aumentado rápidamente a principios de los años 2000 pero en los últimos años se han aplanado (Figura 3) principalmente debido a que las emisiones procedentes de China mostraron un comportamiento similar (Figura 4).
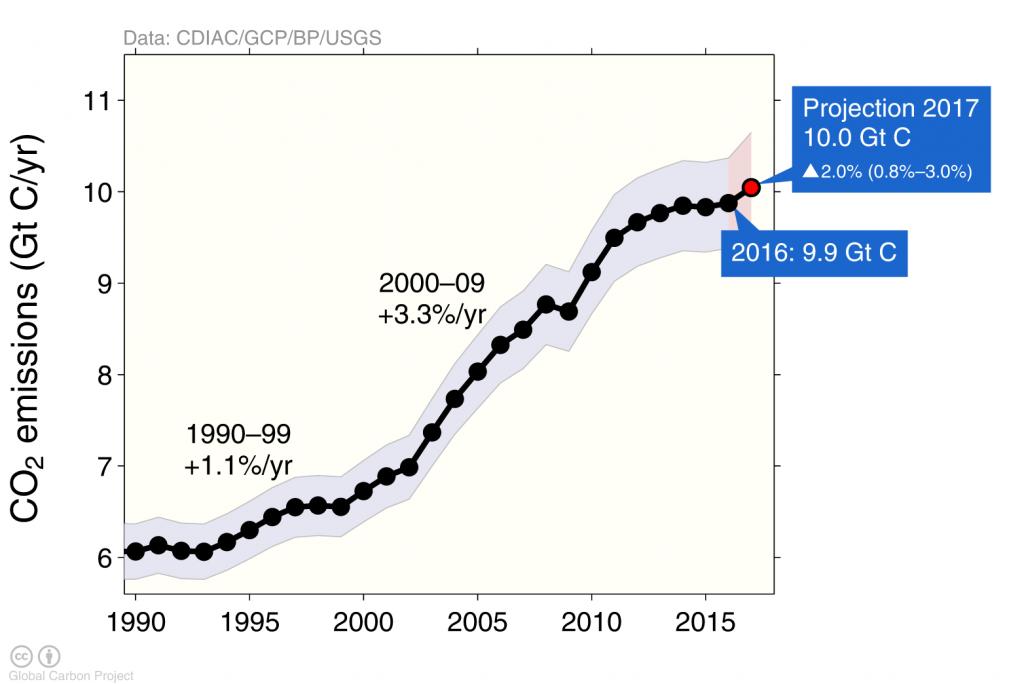
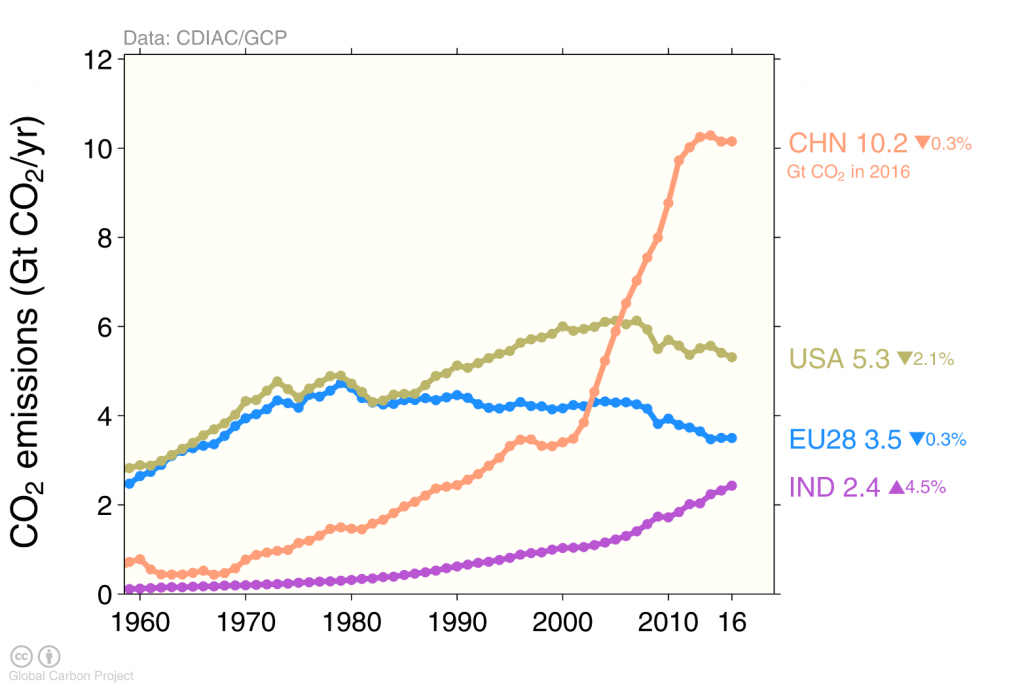
Los efectos de la crisis financiera y económica se ven en la caída de las emisiones globales de carbono en 2009 causada por las reducciones de emisiones en Estados Unidos y Europa (Figura 4), mientras que las emisiones continuaron aumentando en China hasta 2013 después de lo cual se mantuvieron constantes.
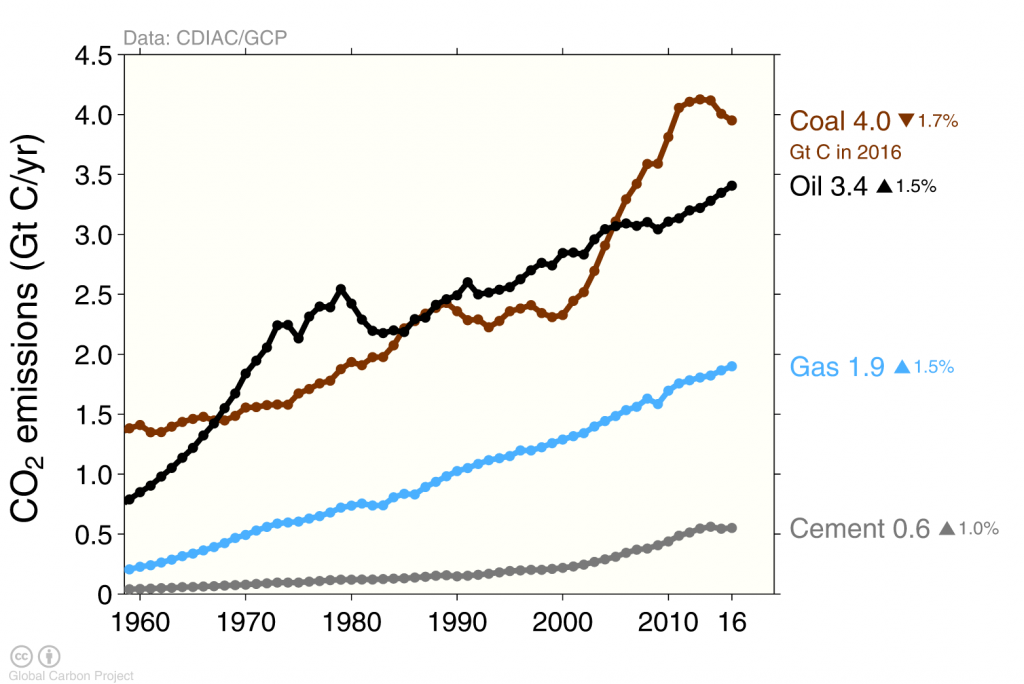
Las emisiones de carbono causadas por el ser humano provienen principalmente de la quema de combustibles fósiles, mientras que la producción de cemento aporta solo alrededor del 6% (Figura 5). La quema de carbón, petróleo y gas ha aumentado sustancialmente durante los últimos 50 años. El incremento de las emisiones procedentes de China durante la primera década del siglo XXI fue alimentado principalmente por la quema de carbón.
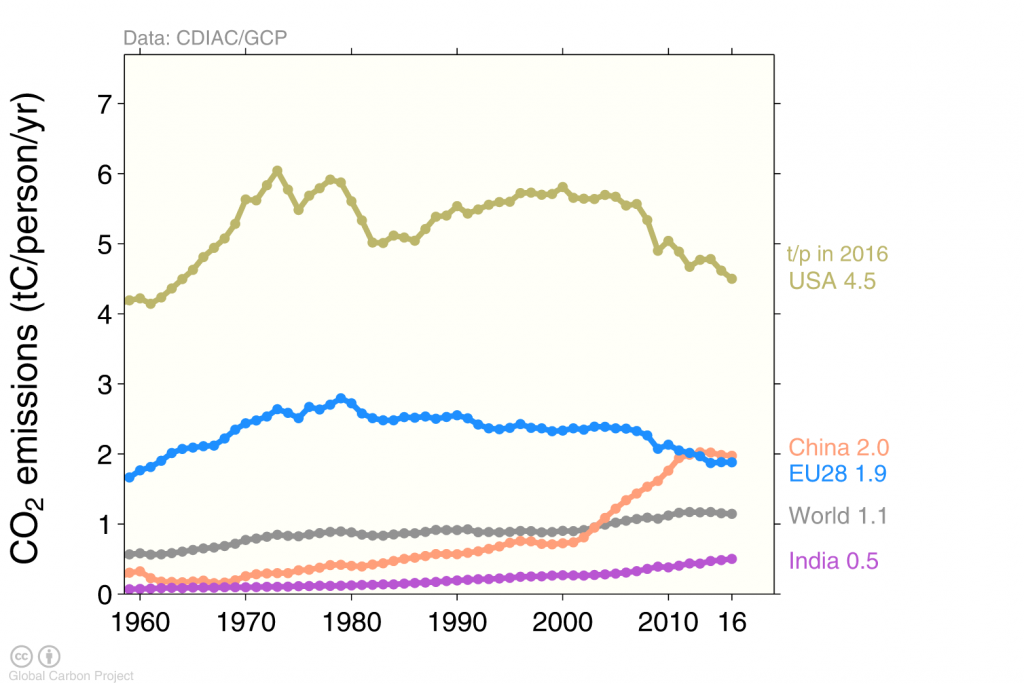
Entre los cuatro principales emisores el EU es el que tiene mayores emisiones por persona (Figura 6). El estadounidense promedio emite alrededor de 5 toneladas métricas de carbono al aire cada año. Esto es más del doble de las emisiones por persona en Europa o China, más del triple de las emisiones promedio a nivel mundial, y aproximadamente diez veces las emisiones de una persona en la India.
¿Cómo sabemos que las concentraciones crecientes de CO 2 en la atmósfera provienen de actividades humanas? Existen varias líneas de evidencia independientes. El primero proviene de datos económicos. Dado que los combustibles fósiles se comercializan a nivel internacional, sabemos cuánto petróleo, carbón y gas importa y utiliza un país. Los datos mostrados en las figuras (2) a (6) se basan en estas estimaciones. El área sombreada en la Figura (3) indica las barras de error de esas estimaciones. No todos los países publican y ponen a disposición sus datos, lo que lleva a estas incertidumbres. Sin embargo, son relativamente pequeñas de tal manera que se sabe que las emisiones están dentro de un margen de error de aproximadamente 5%.
Caja 2: Isótopos de Carbono
El carbono existe como tres isótopos. El carbono-12 (12 C) más común con 6 protones y 6 neutrones, el carbono-13 (13 C) más raro con un neutrón adicional, y el carbono-14 (14 C) o radiocarbono con dos neutrones adicionales. El 14 C es radiactivo y se descompone con una vida media de 5,730 años.

Figura B2.1: Ilustración de la Estructura Atómica de Isótopos de Carbono. El núcleo consta de protones (rojo) y neutrones (verde). Está rodeado de electrones (azul).
Las plantas y las algas fraccionan los isótopos de carbono en aproximadamente 20 ‰ durante la fotosíntesis de tal manera que captan preferentemente la luz 12 C. Los valores preindustriales de δ 13 C del CO 2 atmosférico fueron de aproximadamente -6.5 ‰. Así, el carbono de plantas y suelos tiene δ 13 valores de C de alrededor de -27 ‰.
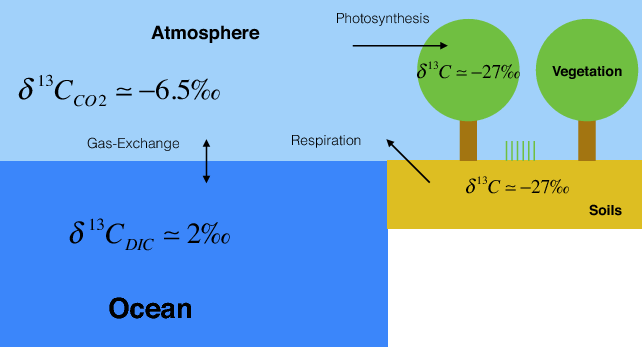
La notación delta es análoga a la de los isótopos de oxígeno discutidos en el capítulo 3. δ 13 C = R/R std — 1, donde R = 13 C/ 12 C es la relación del isótopo pesado sobre el ligero y R std es la de un estándar.
La segunda línea de evidencia se basa en mediciones de isótopos de carbono. El fraccionamiento durante la fotosíntesis conduce a que las plantas y algas tengan valores de δ 13 C muy agotados (ver recuadro Isótopos de Carbono). Dado que los combustibles fósiles se derivan de plantas antiguas, también se agotan en 13 isótopos C. Así, la adición de carbono con una firma de 13 C muy empobrecida a la atmósfera conduce a una disminución en los valores de δ 13 C del CO 2 atmosférico. Esto se observa en mediciones tanto del aire ambiente como del aire extraído de núcleos de hielo (Figura 7).
 |
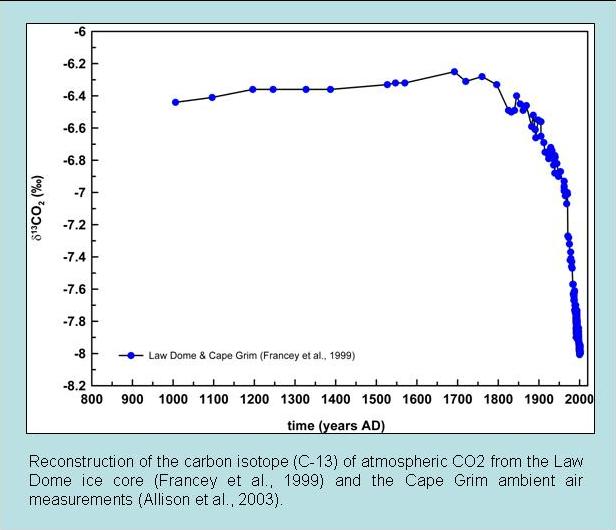
Figura 7: Mediciones de isótopos de carbono del CO2 atmosférico. Arriba: Datos de aire ambiente de Mauna Loa (negro) y del Polo Sur (rojo). Abajo: mediciones del núcleo de hielo. |
La tercera línea de evidencia se basa en mediciones de oxígeno en el aire. La quema de combustibles fósiles tiene una ecuación de reacción química similar a la de la respiración. Los carbohidratos reaccionan con el oxígeno para formar CO 2 y agua. La energía se libera durante esta reacción. Así, la quema de carbohidratos consume oxígeno. Al medir la relación oxígeno a nitrógeno en el aire se pueden detectar los cambios en la concentración de oxígeno atmosférico aunque sean pequeños en comparación con las concentraciones absolutas de oxígeno (Figura 8). Estas mediciones son evidencia de un proceso de combustión masiva que está ocurriendo en la Tierra en este momento.
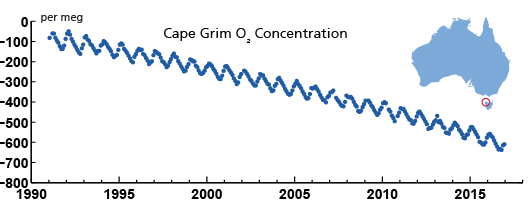
Concluimos que los humanos han causado una gran perturbación en el ciclo natural del carbono principalmente por la quema de combustibles fósiles, lo que ha incrementado las concentraciones atmosféricas de CO 2 de 280 ppm a más de 400 ppm, a niveles sin precedentes en la historia de la Tierra durante aproximadamente 3 millones de años. Alrededor del 40% del carbono antropogénico emitido hasta el momento ha sido absorbido por el océano, reduciendo así la acumulación de CO 2 en la atmósfera.
Casilla 3: Tiempo de Residencia
El tiempo de residencia τ de una sustancia en un reservorio es el tiempo requerido para reemplazar completamente el reservorio con su entrada: τ = X/I = X/O (en equilibrio I = O), donde X es el tamaño del yacimiento (también conocido como stock, cantidad o inventario) e I (O) es el flujo de entrada (salida). Ver Cuadro de Ecuación Presupuestaria en el Capítulo 4.
Ejercicio: Usa la Figura 1 para calcular
- para el periodo preindustrial los tiempos de residencia del carbono (tip: sumar todas las entradas o salidas para calcular I u O) en el
- ambiente,
- océano,
- terrenos,
- sistema combinado océano-atmósfera-tierra, y
- el tiempo de residencia del carbono antropogénico en el sistema combinado océano-atmósfera-tierra.
Química de Carbonatos y Acidificación de
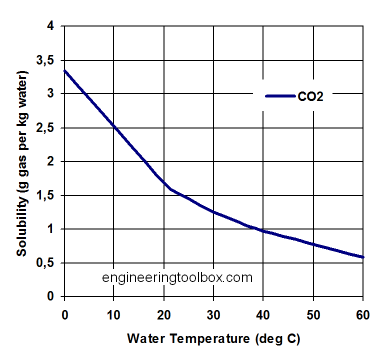
El CO 2 ingresa al océano desde la atmósfera a través del intercambio de gases si la presión parcial en la atmósfera es mayor que la presión parcial en el océano. Se disuelve como gas CO 2 en agua al igual que se disuelve en tu refresco. Si miras una botella de refresco sin abrir, no ves burbujas. Las moléculas de CO 2 emergen dentro de una gran cantidad de moléculas de agua. La bebida se embotelló bajo presión o bajo temperaturas frías. La solubilidad del CO 2 como la de otros gases como el oxígeno depende de la temperatura. Se puede disolver más gas en agua más fría (Figura 9). Esta es la razón por la que a medida que calientas un refresco perderá CO 2. Debido a que no es líquido, el CO 2 no se 'evapora' en el aire, sino que desprende gases. La evaporación implica un cambio de fase, que no ocurre en este caso.
En el océano el CO 2 reacciona con el agua de mar para formar ácido carbónico (H 2 CO 3), que se disocia en iones bicarbonato (HCO 3 —) y carbonato (CO 3 2-):
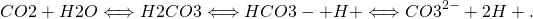
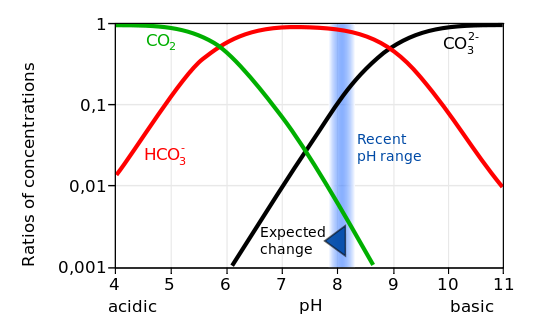
La disociación del ácido carbónico en bicarbonato (bicarbonato de sodio) produce un ion hidrógeno H +, lo que aumenta el pH del agua. La mayoría de los iones hidrógeno, sin embargo, se vuelven a combinar con iones carbonato para formar iones bicarbonato adicionales. Sin embargo, agregar CO 2 al agua de mar aumenta su concentración de iones hidrógeno (disminuye su pH) y disminuye la concentración de iones carbonato. Este proceso se llama acidificación oceánica.
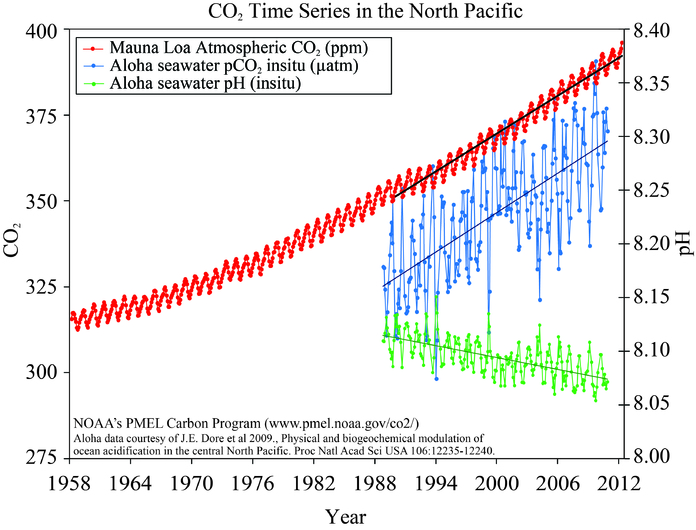
Las observaciones muestran que la presión parcial de las aguas superficiales del océano sigue de cerca la tendencia del CO 2 atmosférico (Figura 11) indicando la captación de carbono antropogénico. Las mediciones también demuestran que el pH del océano disminuye. Datos de cerca de Hawái muestran que el pH ha disminuido en aproximadamente 0.05 unidades de 1988 a 2011. Las estimaciones globales sugieren una disminución de 0.2 unidades respecto a los tiempos preindustriales. Esto corresponde a un incremento de ~30% en los iones de hidrógeno.
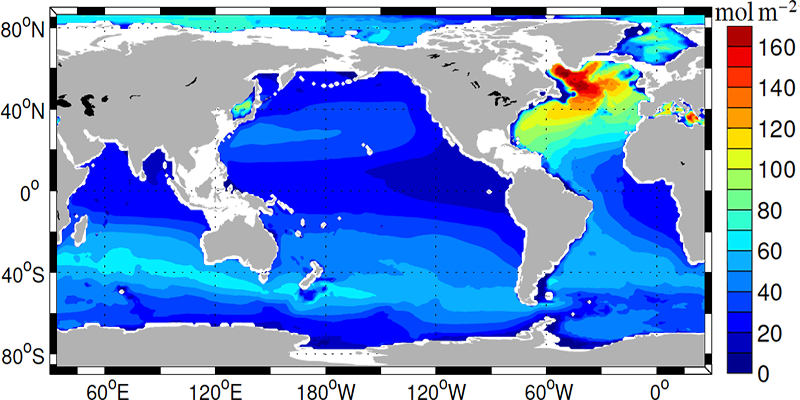
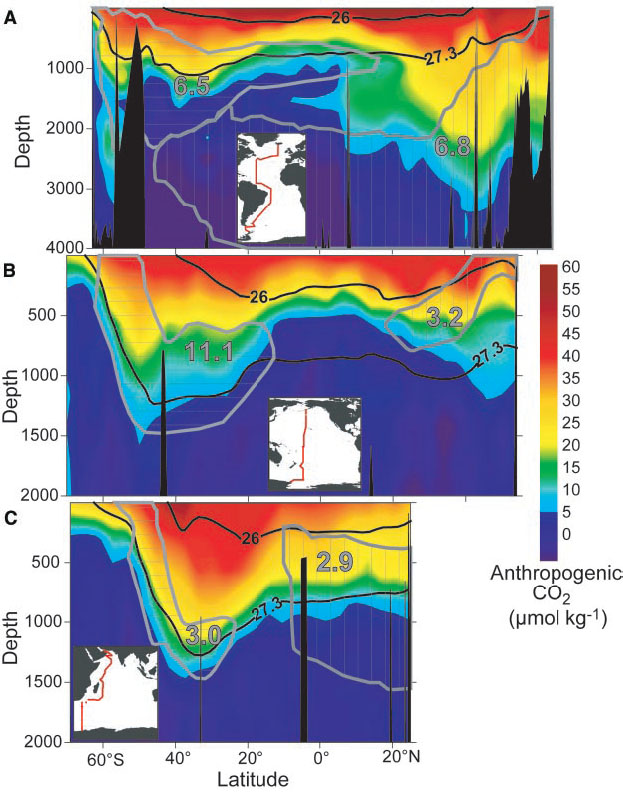
La penetración de carbono antropogénico en el océano es mayor en el Atlántico Norte, en latitudes medias en el Océano Austral y en el Pacífico Norte subtropical (Figura 12). Como veremos a continuación se trata de regiones de convergencia, subducción o formación de aguas profundas.
El CO 2 antropogénico ingresa al océano en la superficie. Por lo tanto, la mayor parte del carbono antropogénico se encuentra en las capas superficiales (Figura 13). Sin embargo, cantidades mensurables han penetrado la mayor parte del kilómetro superior del océano. En algunas regiones como el Atlántico Norte y en el Océano Austral el carbono antropogénico ha entrado en niveles por debajo de los 2 km de profundidad. Se trata de regiones del océano donde las aguas superficiales se hunden a grandes profundidades llevando consigo carbono antropogénico.
Los organismos calcificantes como los corales, los coccolítoforos, los foraminíferos y los pterópodos construyen conchas y otras partes del cuerpo a partir de carbonato de calcio (CaCo 3) mediante el uso de iones calcio Ca 2+ y carbonato CO 3 2- (Figura 14).
 |
 |
 |
 |
La disminución de las concentraciones de iones carbonato y el pH disminuirá el estado de saturación del carbonato de calcio, lo que dificultará que los organismos construyan conchas de carbonato de calcio. También disolverá más fácilmente el carbonato de calcio existente. A muchos científicos les preocupa que los cambios actualmente en curso en la química de los carbonatos del océano y los esperados para el futuro, en caso de que continúen las emisiones antropogénicas de carbono, puedan tener consecuencias adversas para el ecosistema oceánico. Es probable que las tasas de cambio sean mucho mayores que cualquier otra experiencia en los últimos millones de años, con riesgos desconocidos.
Los experimentos muestran que el aumento de CO 2 o la disminución del pH pueden conducir a coccolitos o conchas de pterópodos malformados o parcialmente disueltos. Sin embargo, la investigación sobre la acidificación de los océanos aún está en su infancia y actualmente no se conocen las consecuencias para muchas especies y ecosistemas.
Referencias
Ciais, P., C. Sabine, G. Bala, L. Bopp, V. Brovkin, J. Canadell, A. Chhabra, R. DeFries, J. Galloway, M. Heimann, C. Jones, C. Le Quéré, R.B. Myneni, S. Piao y P. Thornton, 2013: Carbono y Otros Ciclos Biogeoquímicos. En: Cambio climático 2013: La base de la ciencia física. Contribución del Grupo de Trabajo I al Quinto Informe de Evaluación del Grupo Intergubernamental de Expertos sobre Cambio Climático [Stocker, T.F., D. Qin, G.-K. Plattner, M. Tignor, S.K. Allen, J. Boschung, A. Nauels, Y. Xia, V. Bex y P.M. Midgley (eds.)]. Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU.
Khatiwala, S., et al. (2013), Almacenamiento oceánico global de carbono antropogénico, Biogeosciences, 10 (4), 2169-2191, doi:10.5194/bg-10-2169-2013.
Le Quéré, C., et al. (2018), Presupuesto Global de Carbono 2018, Earth Syst. Sci. Data, 10, 2141—2194, 2018, doi:10.5194/essd-10-2141-2018.
Zeebe, R. E., y D. A. Wolf-Gladrow (2001), CO 2 en Agua de mar: Equilibrio, Cinética, Isótopos, Elsevier, Amsterdam.
Material Adicional



