4.2: Biomasa
- Page ID
- 84187
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)4.2 Biomasa
Existen cuatro tipos de recursos de biomasa que pueden ser utilizados: 1) residuos agrícolas, 2) cultivos energéticos, 3) residuos forestales y 4) procesamiento de desechos. A continuación se enumeran ejemplos de diferentes fuentes:
Residuos Agrícolas:
- Rastrojo de maíz
- Paja de trigo
- Paja de arroz
- Acecho de soja
Cultivos Energéticos:
- Cambiar pasto
- Sorgo dulce
- Cañas de azúcar
- Algas
- Espadaña
- Lenteja de agua
Residuos Forestales:
- Sierra de polvo
- Fichas amaderadas
Procesamiento de residuos:
- Residuos de procesamiento de alimentos
- Residuos animales
- Residuos sólidos municipales
Como ya se mencionó, la mayor parte de la biomasa está compuesta al menos parcialmente por tres componentes: celulosa, hemicelulosa y lignina. La Figura 4.2a muestra un diagrama de lignocelulosa, y la Figura 4.2b muestra la biomasa desglosada en las tres partes. Habrá significativamente más discusión sobre la composición de la biomasa en futuras lecciones. La celulosa es un polímero cristalino de moléculas de anillo (6 carbonos) con grupos OH y COOH (en la Figura 4.2a, la celulosa es las líneas verdes rectas; en la Figura 4.2b, la molécula verde). La hemicelulosa es similar, pero tiene moléculas de anillo con 5 y 6 carbonos, y es amorfa en las estructuras, como se representa en la Figura 4.2a por la línea negra de vibración; la Figura 4.2b muestra cómo está alrededor de la celulosa y más detalle de la estructura molecular. La lignina es el material que lo mantiene todo unido y es la línea azul claro en la Figura 4.2a; está en rojo en 4.2b.

Crédito: Lignocellulose.jpg: de MicrobeWiki

Cómo Determinar las Propiedades de la Biomasa
Hay cuatro formas comunes de medir las propiedades de cualquier producto de carbono, que también se utilizará para la biomasa: 1) análisis próximo, 2) análisis final, 3) calor de combustión y 4) análisis de cenizas.
Análisis proximo
El análisis próximo es una medición amplia para determinar el contenido de humedad (M), el contenido de materia volátil (VM), el contenido de carbono fijo (FC) y el contenido de cenizas. Todos estos se hacen sobre una base de masa, típicamente, y se hacen en lo que se llama un analizador próximo: el analizador solo mide la pérdida de masa a ciertas temperaturas. La humedad se expulsa a ~105-110°C (justo por encima del punto de ebullición del agua); representa solo agua físicamente unida. La materia volátil se expulsa en una atmósfera inerte a 950°C, usando una velocidad de calentamiento lenta. El contenido de cenizas se determina tomando el material restante (después de la pérdida de VM) y quemándolo a más de 700°C en oxígeno. El carbono fijo se determina entonces por diferencia: FC = 1 — M — Ceniza — VM.
El siguiente es un ejemplo de análisis próximo de lignina, que forma parte de la madera y/o gramíneas, principalmente:
- Humedad (% en peso): 5.34
- Ceniza (% en peso): 14.05
- Materia Volátil (% en peso): 60.86
- FC=100−M (%) −A (%) −VM (%) FC=100−M%−A%−VM%
- FC=100−5.34−14.05−60.86=19.75FC=100−5.34−14.05−60.86=19.75
A veces, el contenido de humedad se eliminará de la VM y el contenido de cenizas, sobre una base seca:
- FC=100−M (%) −A (%dry) −VM (%dry) FC=100−M%−A%seco−VM%seco
- FC=100−14.05−60.86=25.09FC=100−14.05−60.86=25.09
Análisis definitivo
El análisis final es más específico ya que analiza la composición elemental de la porción orgánica de los materiales. Las composiciones de carbono (C), hidrógeno (H), nitrógeno (N), azufre (S) y oxígeno (O) se determinan sobre una base de porcentaje de masa, y se pueden convertir a una base atómica. En algunos casos, también se analizará el cloro (Cl). Hay instrumentos que están diseñados para medir solo el porcentaje de masa de C H N y luego otro para medir S por ciento; el instrumento quema el material y mide los productos de la combustión. El siguiente es un ejemplo de problema para determinar la composición molecular atómica de la biomasa cuando se le proporciona un análisis final. El oxígeno suele estar determinado por la diferencia. El agua puede sesgar los resultados del hidrógeno y debe ser contabilizado.
Tu Turno
Problema 1:
El análisis final muestra que los contenidos de C, H, O, N y S de un material de biomasa son 51.9%, 5.5%, 41.5%, 0.8% y 0.3% en base seca. ¿Cuál es la fórmula química de esta biomasa? ¿Cuántos kilogramos de aire se requieren para quemar completamente 1 kg de esta biomasa? A continuación se muestran los resultados.
Los siguientes ejemplos son del cálculo del Problema 1, la fórmula química de la biomasa, cuando se le da porcentaje de masa en base seca. Si conoces el porcentaje de masa elemental de la muestra, puedes dividir por el peso molecular para determinar el valor atómico de cada elemento. Los valores de la tabla se dividen luego por el número atómico de carbono para normalizar la molécula. Entonces, por cada carbono, tienes 1.26 átomos de hidrógeno, 0.6 átomos de oxígeno, etc.
Tabla 4.1: Cálculos del Problema 1
| % en masa (1/MW) =x | Valores |
|---|---|
| C=51.9 (\(\frac{1}{12.011}\)) | (\(\frac{4.32}{4.32}\)) =1 |
| H=5.5 (\(\frac{1}{1.0079}\)) | (\(\frac{5.46}{4.32}\)) =1.260 |
| O=41.05 (\(\frac{1}{15.9994}\)) | (\(\frac{2.59}{4.32}\)) =0.600 |
| N=0.8 (\(\frac{1}{14.0067}\)) | (\(\frac{0.06}{4.32}\)) =0.013 |
| S=0.3 (\(\frac{1}{32.06}\)) | (\(\frac{0.01}{4.32}\)) =0.002 |
Calor de combustión
El calor de combustión se puede medir directamente usando un calorímetro de bomba. Este instrumento se utiliza para medir el valor calorífico por masa (calorías/gramo o BTU/lb). También se puede estimar usando diferentes fórmulas que lo calculan con base en análisis final o próximo. Un tipo común de calorímetro es el calorímetro isoperibol, que contendrá el calor dentro de la camisa pero acomodará el cambio de temperatura del agua en la cubeta; ver Figura 4.3 para un esquema. Se coloca una muestra en un crisol que se pone dentro de un reactor con oxígeno de alta presión. La muestra está conectada a un fusible y cables eléctricos que encenderán la muestra, todo contenido dentro del reactor (a veces llamado calorímetro de bomba). La temperatura del agua en el cubo se mide antes y después del encendido, y con todas las demás partes calibradas, se utiliza el calor específico del agua y el cambio de temperatura para determinar el calor de combustión.
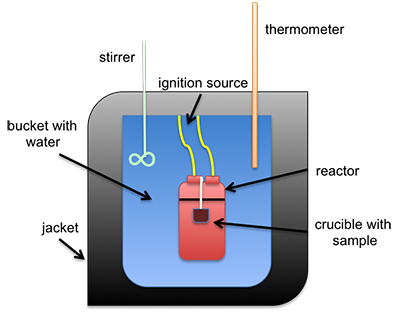
Figura 4.3: Esquema del calorímetro de isoperibol.
- Haga clic aquí para ver una alternativa de texto a la imagen de arriba
-
Esto es esquemático de un calorímetro de isoperibol. Hay un crisol que contiene una muestra. Ambos se sientan dentro de un reactor. El reactor en sí está en una cubeta con agua que tiene una camisa aislante en el exterior, incluyendo la parte superior. Se pegan al agua un agitador y un termómetro. La reacción es iniciada por una fuente de ignición conectada al reactor.
Crédito: © Penn State University, está licenciado bajo CC BY-NC-SA 4.0
El valor calorífico se determina en un calorímetro de bomba. Los valores de calentamiento se reportan tanto en bases de combustible húmedo como seco. Para el alto valor calorífico (HHV), el valor se puede determinar normalizando la humedad en forma líquida. Para el bajo valor calorífico (LHV), una porción del calor de combustión se usa para evaporar la humedad.
Análisis de cenizas
Los minerales en el material, una vez quemados, se convierten en cenizas. La ceniza puede analizarse para compuestos específicos que contendrán oxígeno, como CaO, K 2 O, Na 2 O, MgO, SiO 2, Fe 2 O 3, P 2 O 5, SO 3 y Cl. También se pueden medir los minerales originales. Una vez aislado el mineral o ceniza, a menudo debe disolverse en diversos ácidos y luego analizarse. Hay otra instrumentación disponible, pero el análisis es bastante complicado y no suele hacerse.
La densidad aparente también se determina para la biomasa como propiedad. Normalmente se determina midiendo el peso de material por unidad de volumen. Por lo general, se determina sobre una base de peso seco (libre de humedad) o en una base según lo recibido con contenido de humedad disponible. Para la biomasa, los valores bajos (pajitas de grano y virutas) son 150-200 kg/m3 (0.15-0.20 g/cm3), y los valores altos (madera maciza) son 600-900 kg/m3 (0.60-0.90 g/cm3). El valor calorífico y la densidad aparente se utilizan para determinar la densidad de energía. La Figura 4.4 muestra una comparación de diversas fuentes de biomasa con fuentes de combustibles fósiles sobre una base de masa de densidad energética.
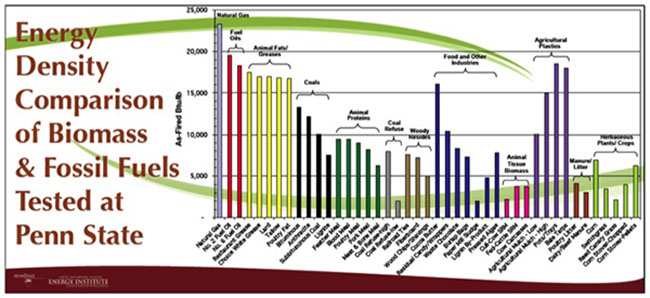
Crédito: Bruce Miller, Investigador Asociado, EMS Energy Institute, PSU
Muchas de las características del combustible que hemos estado discutiendo necesitan ser conocidas para el uso adecuado de la biomasa en la combustión, gasificación y otras químicas de reacción.


