2.3: Fundamentos del procesamiento neuronal
- Page ID
- 85634
2.3 Fundamentos del procesamiento neuronal
Esta sección revisa temas neuronales básicos que prevalecen en los sistemas sensoriales biológicos como el sistema de visión, el sistema auditivo y el sistema olfativo. Aunque las neuronas biológicas son mucho más lentas que la electrónica moderna de transistores, los principios fundamentales del procesamiento neuronal explotan el comportamiento logarítmico natural de las distribuciones de carga y transporte. La unión pn exhibe esta relación natural, pero tendemos a tomar pares de uniones pn (transistores) y crear un conmutador binario (bit digital). Si la relación v-i exponencial de una unión pn pudiera usarse a las velocidades actuales del reloj de la computadora, podría haber muchos órdenes de mejora en el rendimiento computacional y el consumo de energía. Además, aún queda mucho por aprender sobre las estrategias de interconexión que se encuentran en las redes neuronales naturales.
2.3.1 Adaptación y Desarrollo
Si bien los sistemas biológicos pueden estudiarse como sistemas existentes que resuelven problemas de procesamiento, cabe señalar que estos sistemas se desarrollan y adaptan constantemente. Desde la concepción hasta la muerte cada sistema biológico conocido está madurando continuamente, nunca alcanzando un estado físico inmutable. El sistema neuronal de un adulto maduro es relativamente estable, lo que representa cierto nivel de optimización neuronal debido a la adaptación ambiental.
La adaptación puede ser inmediata o a largo plazo. Un ejemplo de adaptación inmediata es la respuesta del iris del ojo a los niveles de luz, controlando la cantidad de flujo fotónico que ingresa a la pupila. Una adaptación a corto plazo, llamada habitualización y sensibilización, se demuestra en el caracol marino, Aplysia. La branquial se retira bajo un manto en defensa cuando se estimula el sifón, unido al manto. La magnitud refleja disminuye a medida que el sifón es estimulado artificialmente, resultando en la habitualización, o desensibilización, de la respuesta al ambiente experimental. La respuesta puede ser posteriormente sensibilizada estimulando otras partes del cuerpo. A través del entrenamiento se puede hacer que estas condiciones reflejas duren días, lo que indica una forma primitiva de memoria y aprendizaje [Dowl87].
En formas de vida superiores estas simples adaptaciones neuronales se combinan con interconexiones masivas para proporcionar conceptos de adaptación más complejos. Por ejemplo, se ha demostrado que la detección de armónicos espaciales y la identificación de patrones de rejilla sinusoidales complicados depende de la adaptación a los armónicos y patrones armónicos. El umbral de detección aumenta después de la adaptación al armónico, y el umbral de identificación del patrón aumenta después de la adaptación a los patrones [Vass95].
El entrenamiento a lo largo de la vida es un ejemplo de adaptación a largo plazo. El entrenamiento da como resultado que las neuronas estén conectadas o fortalecidas, lo que se denomina aprendizaje por coincidencia o aprendizaje Hebb [Hech90]. Una adaptación a más largo plazo es la codificación genética, pasando la información de adaptación de una generación a la siguiente.
2.3.2 Órganos de los sentidos y adaptación
El siguiente texto en cursiva relativo a los órganos de los sentidos en cangrejos se cita de [Warner77] (el texto no cursiva es comentario adicional):
“Los órganos de los sentidos funcionan a nivel celular al convertir el estímulo en un cambio en el potencial eléctrico a través de la membrana celular receptora. Este potencial receptor, si es suficientemente grande, da como resultado la iniciación de impulsos nerviosos (potenciales de acción) que se transmiten a lo largo del nervio al SNC” (Sistema Nervioso Central).”
En algunos casos, sin embargo, como la visión de primates, hay capas adicionales de células entre los receptores y los axones de transmisión de potencial de acción. En estos casos, las funciones de preprocesamiento graduadas ocurren antes de que la información se codifica en potenciales de acción. Pero para los diseños de sistemas sensoriales más simples, el potencial de acción...
“... frecuencia es una medida de la fuerza del estímulo... Cada célula receptora está especializada para convertir un tipo particular de estímulo (luz, deformación mecánica, etc.) y cada una tiene un umbral particular por debajo del cual el estímulo es insuficiente para desencadenar impulsos nerviosos. La estimulación mantenida generalmente da como resultado que se eleve el umbral de un receptor (es decir, el receptor se vuelve menos sensible). Así, muchas células receptoras, descritas como que se adaptan rápidamente, responden con un breve estallido de impulsos solo al inicio de la estimulación. Otros que responden durante períodos más largos de estimulación mantenida se denominan adaptación lenta o, en casos extremos, no adaptación. Los órganos de sentido único pueden estar compuestos por varias células receptoras cada una con una tasa de adaptación diferente”.
Para ilustrar la adaptación lenta y rápida, considere dos neuronas cuyo umbral para la generación de potencial de acción es —55mV. A medida que los iones ingresaron a la neurona desde las dendritas de entrada, el potencial de membrana aumentaría de un potencial de reposo (aproximadamente —70 mV) al umbral de —55 mV. Un pico de potencial de acción provocaría que los iones positivos se descargaran durante el pico, lo que daría como resultado que el potencial de la membrana volviera al potencial de reposo Entonces el proceso comenzaría de nuevo, donde los iones entrantes acumularían el potencial de membrana hasta el umbral para la iniciación de un potencial de acción. Para una rápida adaptación, el umbral podría aumentar significativamente después de cada generación de pico y degradarse rápidamente de nuevo a —55 mV cuando se elimina el estímulo de entrada. Para una adaptación lenta, el umbral podría subir nominalmente después de cada generación de pico y degradarse más lentamente de nuevo a —55 mV una vez que se elimina el estímulo.
La Figura 2.3.2-1 muestra los resultados de un modelo de adaptación neuronal que da cuenta de aumentos en el umbral de potencial de acción con actividad de disparo así como un retorno a un umbral nominal de reposo en ausencia de estímulo de entrada. La forma de onda rectangular de entrada se amplifica para mostrar cuándo el estímulo está encendido y cuándo está apagado. A medida que el potencial de la membrana neuronal aumenta con el estímulo de entrada, hay una fuga constante que tiende a devolver el potencial a su estado de reposo (aproximadamente —70mV). De igual manera, hay una fuga constante en el umbral que tiende a devolverlo a su estado de reposo (alrededor de —55 mV). A medida que la neurona se adapta al estímulo, se eleva el nivel umbral, lo que posteriormente reduce la frecuencia del potencial de acción (pico).
Figura 2.3.2-1. Adaptación Neuronal Lenta y Rápida.
En este modelo, la velocidad del modelo se implementa mediante el salto en el nivel umbral después de un potencial de acción y la tasa el umbral vuelve al estado de reposo cuando el estímulo se detiene. La curva de entrada se amplifica para mostrar mejor cuándo la entrada está presente y cuándo está ausente. THR_ADAPT = 0.002 (lento) y 0.01 (rápido) representa aumento en el umbral después del potencial de acción, y THR_Leak = .003 (lento) y 0.006 (rápido) representa la tasa de retorno umbral a —55 mV.
Inicialmente, la frecuencia de pico es alta; a medida que la neurona se adapta, se reduce, como se ve en la figura. Durante la adaptación lenta, el umbral no se incrementa mucho después de cada pico por lo que tarda más tiempo para que la frecuencia alcance una baja frecuencia en estado estacionario. Durante la adaptación rápida, el umbral se incrementa significativamente después de cada pico para que la neurona alcance rápidamente una baja frecuencia en estado estacionario. Un mecanismo alternativo para la adaptación rápida es que la neurona regrese a un potencial mayor que el potencial de reposo normal después de un potencial de acción. En lugar de regresar a —70 mV, sólo puede volver a, digamos, —60 mV. Entonces la neurona tiene un aumento de potencial mucho menor para obtener antes de alcanzar el siguiente nivel umbral para el disparo de potencial de acción.
2.3.3 Equilibrio iónico de deriva y difusión
Un principio fundamental de la física de semiconductores es el equilibrio de la deriva del portador de carga y las corrientes de difusión en la región de agotamiento de una unión pn. Ambos materiales se caracterizan por una alta concentración de portadores móviles (agujeros para tipo p, electrones para tipo n) dentro de un volumen electrostáticamente neutro. Cuando se juntan, los electrones en el material tipo n se difunden desde un área de mayor concentración, dejando iones de red cargados positivamente con carga agotada y se combinan en el material tipo p para formar allí un ion reticular cargado negativamente. A medida que este proceso continúa, un campo eléctrico de la red positiva (tipo n) a la retícula negativa (tipo p) está creciendo en fuerza. Este campo hace que los portadores retrocedan, desarrollando así una corriente de deriva opuesta a la corriente de difusión. El equilibrio se alcanza cuando la corriente de difusión es igual a la corriente de deriva [Horen96].
Las células biológicas también se mantienen en equilibrio en parte por un equilibrio de corrientes de deriva y difusión. Sin embargo, los portadores de carga son principalmente iones de potasio, K +, sodio, Na + y cloro Cl -, que no son tan móviles como los huecos y los electrones. Las corrientes electrónicas se definen en términos de constantes de dispositivo de difusión y movilidad, funciones principalmente de dopaje y geometría [Horen96]. Las corrientes biológicas son funciones de las permeabilidades de la membrana celular, que son funciones del tiempo, el potencial de membrana y las concentraciones iónicas [MacG91].
En el caso del potasio y el sodio, existe un mecanismo orgánico separado llamado Bomba Na-K que mantiene estables las concentraciones iónicas dentro de la neurona. La Bomba Na-K utiliza energía metabólica suministrada por la energía biológica almacenada en el organismo. Para el cloro, sin embargo, las concentraciones interior y exterior se mantienen juntas, equilibradas por deriva y difusión.
2.3.4 Ecuaciones de Nernst y Goldman
Un potencial eléctrico, o voltaje, se establece a través de una membrana cuando hay una concentración desigual de iones en las dos regiones. La ecuación de Nernst (1908) que muestra esta relación viene dada por
\(E=\frac{R T}{n F} \ln \frac{[C]_{o}}{[C]_{i}}=\frac{k T}{z q} \ln \frac{[C]_{o}}{[C]_{i}}\)
Ecuación de Nernst
\( \cong(26 m V) \ln \frac{[C]_{o}}{[C]_{i}}, \text { for } K^{+}, N a^{+} \)
\( \cong-(26 m V) \ln \frac{[C]_{o}}{[C]_{i}} \cong(26 m V) \ln \frac{[C]_{i}}{[C]_{o}}, \text { for } C l^{-} \)
donde R es la constante de gas universal, T es la temperatura absoluta, F es la constante de Faraday (carga eléctrica por gramo de ión equivalente), n es la carga sobre el ión y [C] o y [C] i son las concentraciones de iones fuera y dentro de la célula. Tenga en cuenta que\(\frac{R T}{F}=\frac{k T}{q} \approx 26 mV\) a temperatura ambiente. Este último término se usa frecuentemente en circuitos electrónicos.
Bernstein (1912) presentó la significación para la señalización neuroeléctrica de los flujos iónicos sobre las membranas neuronales. Sobre la base de este concepto, la ecuación de Nernst y la física fundamental de los medios iónicos aportados por Planck y Einstein, Goldman (1958) aportó el modelo primario para el potencial de reposo en las neuronas como
\( E=\frac{k T}{q} \ln \left(\frac{P_{K+}\left[K^{+}\right]_{o}+P_{N a+}\left[N a^{+}\right]_{o}+P_{C l-}\left[C l^{-}\right]_{i}}{P_{K+}\left[K^{+}\right]_{i}+P_{N a+}\left[N a^{+}\right]_{i}+P_{C l-}\left[C l^{-}\right]_{o}}\right) \)
Ecuación de Goldman
donde T es temperatura absoluta, k es la constante de Boltzmann, q es carga eléctrica unitaria, P son permeabilidades, [] o son concentraciones fuera de la célula e [] i son concentraciones dentro de la célula. Si las permeabilidades son constantes, la ecuación de Goldman da buenos resultados en estado estacionario [MACG91].
Ejemplo 2.3.4-1
Encontrar el potencial Nernst entre el interior y el exterior de una neurona debido a cada ion si sus concentraciones son las siguientes:
| En el interior | Afuera | |
| K + | 360 mM | 20 mM |
| Na + | 45 mM | 450 mM |
| Cl - | 50 mM | 600 mM |
(M significa mol, una unidad de concentración)
Solución:
El potencial debido a las diferencias de concentración solo se resuelve mediante la Ecuación de Nernst, teniendo en cuenta que la relación de concentración de iones externos a internos se invierten para iones cargados negativamente:
\(E_{K+}=(26 m V) \ln \frac{[C]_{o}}{[C]_{i}}=0.026 \ln \frac{20}{360}=-75.1 \mathrm{mV} \)
\(E_{\mathrm{Na}+}=(26 \mathrm{mV}) \ln \frac{[C]_{o}}{[C]_{i}}=0.026 \ln \frac{450}{45}=59.9 \mathrm{mV} \)
\(E_{C l-}=(26 m V) \ln \frac{[C]_{i}}{[C]_{0}}=0.026 \ln \frac{50}{600}=-64.6 \mathrm{mV} \)
■
Ejemplo 2.3.4-2
Para la concentración de iones dada determinar el potencial de membrana asumiendo la siguiente relación de permeabilidades de iones: P K+: P Na+: P Cl- = 1.0:0.5:0.2
| En el interior | Afuera | |
| K + | 320 mM | 25 mM |
| Na + | 40 mM | 420 mM |
| Cl - | 60 mM | 540 mM |
Solución:
Las permeabilidades relativas dadas significan que P Na+ = 0.5 P K+ y P Cl- = 0.2 P K+; usando la Ecuación de Goldman
\(E_{m}=(0.026) \ln \left(\frac{P_{K+}\left[K^{+}\right]_{o}+P_{N a+}\left[N a^{+}\right]_{o}+P_{C l-}\left[C l^{-}\right]_{i}}{P_{K+}\left[K^{+}\right]_{i}+P_{N a+}\left[N a^{+}\right]_{i}+P_{C l-}\left[C l^{-}\right]_{o}}\right)\)
\( E_{m}=(0.026) \ln \left(\frac{P_{K+}\left[K^{+}\right]_{o}+0.5 P_{K+}\left[N a^{+}\right]_{o}+0.2 P_{K+}\left[C l^{-}\right]_{i}}{P_{K+}\left[K^{+}\right]_{i}+0.5 P_{K+}\left[N a^{+}\right]_{i}+0.2 P_{K+}\left[C l^{-}\right]_{o}}\right) \)
\(E_{m}=(0.026) \ln \left(\frac{\left[K^{+}\right]_{o}+0.5\left[N a^{+}\right]_{o}+0.2\left[C l^{-}\right]_{i}}{\left[K^{+}\right]_{i}+0.5\left[N a^{+}\right]_{i}+0.2\left[C l^{-}\right]_{o}}\right) \)
\( E_{m}=(0.026) \ln \left(\frac{25+0.5(420)+0.2(60)}{320+0.5(40)+0.2(540)}\right)=(0.026) \ln \frac{247}{448}=-15.48 m V\)
\( E_{m}=(0.026) \)
Ejemplo 2.3.4-3
Dada la relación de permeabilidad P K+: P Cl- = 1.0:0.5 y las concentraciones de iones
| En el interior | Afuera | |
| K + | 400 mM | 20 mM |
| Na + | 50 mM | 440 mM |
| Cl - | 52 mM | 560 mM |
determinar la permeabilidad relativa k de P Na+ de tal manera que P K+: P Na+: P Cl- = 1.0: k: 0.5 y el potencial de membrana en reposo es de +50 mV.
Solución:
Las permeabilidades relativas dadas significan que P Na+ = kP K+ y P Cl- = 0.5 P K+; usando la Ecuación de Goldman
\(0.05=(0.026) \ln \left(\frac{P_{K+}\left[K^{+}\right]_{o}+P_{N a+}\left[N a^{+}\right]_{o}+P_{C l-}\left[C l^{-}\right]_{i}}{P_{K+}\left[K^{+}\right]_{i}+P_{N a+}\left[N a^{+}\right]_{i}+P_{C l-}\left[C l^{-}\right]_{o}}\right)\)
\(0.05=(0.026) \ln \left(\frac{P_{K+}\left[K^{+}\right]_{o}+k P_{K+}\left[N a^{+}\right]_{o}+0.5 P_{K+}\left[C l^{-}\right]_{i}}{P_{K+}\left[K^{+}\right]_{i}+k P_{K+}\left[N a^{+}\right]_{i}+0.5 P_{K+}\left[C l^{-}\right]_{o}}\right)\)
\(0.05=(0.026) \ln \left(\frac{\left[K^{+}\right]_{o}+k\left[N a^{+}\right]_{o}+0.5\left[C l^{-}\right]_{i}}{\left[K^{+}\right]_{i}+k\left[N a^{+}\right]_{i}+0.5\left[C l^{-}\right]_{o}}\right) \)
\(0.05=(0.026) \ln \left(\frac{20+k(440)+0.5(52)}{400+k(50)+0.5(560)}\right)\)
\(1.923=\ln \left(\frac{440 k+46}{50 k+680}\right) \)
\(e^{1.923}=6.84=\frac{440 k+46}{50 k+680}\)
\(6.84(50 k+680)=440 k+46==>\quad k=47\)
Ejercicio 2.3.4-1
Encontrar el potencial Nernst para cada ion usando las concentraciones dadas en los Ejemplos 2.3-2 y 2.3-3
Respuestas:
Ejemplo 2.3-2: E K = -66.3 mV, E Na = 61.1 mV, E Cl = -57.1 mV
Ejemplo 2.3-3: E K = -77.9 mV, E Na = 56,5 mV, E Cl = -61.8 mV
■
Ejercicio 2.3.4-2
- Repetir Ejemplo 2.3-2 con relación de permeabilidad P K+: P Na+: P Cl- = 1.0:5.0:0.2
- Repetir Ejemplo 2.3-2 con relación de permeabilidad P K+: P Na+: P Cl- = 1.0:0.05:0.2
Respuestas:
- 31.8 mV
- -52.1 mV
■
Ejercicio 2.3.4-3
Repetir el Ejemplo 2.3-3 para que el potencial de membrana en reposo sea de -50 mV.
Respuesta:
- k = 0.123
■
2.3.5 El potencial de acción
En general, el procesamiento neuronal dentro de áreas localizadas ocurre como procesamiento gradual, mientras que la transmisión de información en longitudes razonables ocurre como una frecuencia de pulsos asíncronos, llamados picos. En el procesamiento gradual, el potencial de la celda y su salida aumentan lentamente a medida que los niveles de señal de entrada se fortalecen. Cuando las señales de entrada cesan, entonces la célula y su salida vuelven lentamente al potencial de la membrana en reposo. En el procesamiento de tren de picos, las entradas a la celda hacen que el interior aumente de potencial hasta que se alcance un cierto umbral. Por lo general, el potencial de reposo es de aproximadamente -70 mV (con respecto al fluido extracelular) y el umbral para iniciar un pico es de aproximadamente -55 mV. El perfil de voltaje por tiempo durante un pico se conoce como el potencial de acción.
Cuando las señales se transmiten a largas distancias, el proceso de transmisión de señal tiende a ser una serie de potenciales de acción cuyas ocurrencias aumentan (mayor frecuencia) a medida que aumenta la señal de entrada. Hodgkin y Huxley (1952) presentaron el conjunto original de ecuaciones que describen la generación de un solo potencial de acción en el axón de calamar gigante. El potencial intracelular de la membrana típicamente se acumula hasta que se alcanza un umbral, que está alrededor de -55mV en el axón de calamar gigante. En el voltaje umbral, se genera un potencial de acción. Para posteriores disparos potenciales de acción, sin embargo, el valor umbral cambia. Describir estas variaciones de umbral requiere el conocimiento de los procesos moleculares que controlan los canales de conductancia que desencadenan potenciales de acción. Este conocimiento aún no se entiende lo suficiente como para describir cualitativamente el comportamiento de la señal eléctrica [MacG91].
La forma general del potencial de acción es causada principalmente por aumentos significativos en P K+ y P Na+, donde P K+ es un aumento más suave y gradual que P Na+. Ambos regresan cerca de los valores originales: P Na+ dentro de aproximadamente 1 ms y P K+ dentro de aproximadamente 2 ms (ver Figura 2.3.5-1). Ambos son iones positivos, pero [K] i > [K] o y [Na] i < [Na] o, por lo que el efecto sobre E son opuestos [Dowl92, Kand81]. Si P Na+ aumenta, fluirán más iones positivos del exterior al interior, elevando el potencial entre el interior y el exterior, denotado como E m. Sin embargo, si P K+ aumenta, fluirán más iones positivos del interior al exterior, disminuyendo el potencial entre el interior y el exterior.
Figura 2.3.5-1. Potencial de Acción y Permeabilidades Iónicas.
Después de que las señales de entrada hagan que E m aumente más allá de un umbral de aproximadamente —55mV, un fuerte aumento en P Na hace que E m aumente bruscamente a aproximadamente +60mV. A medida que P Na disminuye, P K aumenta, causando que E m eventualmente sobrepase el potencial de reposo antes de asentarse allí (alrededor de —70mV).
La secuencia de potencial de acción es, por lo tanto, algo así:
| Potencial de reposo: | E m ≈ —70 mV |
| La celda recibe entrada: | E m aumenta a aproximadamente —55 mV |
| Potencial de acción iniciado: | Fuerte aumento en P Na+, aumentando aún más E m a aproximadamente +50 mV Aumento más gradual en P K+ a medida que P Na+ disminuye, reduciendo E m P Na+ vuelve al valor de reposo, mientras que P K+ sigue siendo alto E m se reduce a aproximadamente —80 mV (sobreimpulso) a medida que P K+ disminuye las concentraciones de iones y las permeabilidades vuelven al reposo sate, E m ≈ —70 |
Cuanto más fuerte es la señal de entrada a la célula, más frecuentes son los potenciales de acción. Si la entrada está presente pero es muy débil, entonces E m puede asentarse en algún lugar entre —70 mV y —55 mV sin potenciales de acción. Una analogía podría ser una taza con fugas que se llena de un grifo: cuando se llena, se vacía, simulando el potencial de acción. Si el flujo de agua entrante no es suficiente, nunca se genera un potencial de acción.
2.3.6 Transmisión de señal axonal
Las neuronas reciben entradas de canales iónicos llamados dendritas y transmiten (salida) señales a través de sus axones. Algunas neuronas no tienen axones y sirven para mediar señales al permitir que las cargas iónicas se compartan entre neuronas adyacentes. Las neuronas que transmiten potenciales de acción suelen tener axones largos y conductores para la transmisión de la señal. La Figura 2.3.6-1 muestra un circuito de línea de transmisión con pérdidas que simula el comportamiento de transmisión de carga de un axón con capacitancia de membrana, C M, resistencia de membrana, R M, medida en Ω-cm (axones más largos o axones de mayor diámetro ==> más área superficial, menos resistencia), y resistencia axonal R A, medida en Ω/cm (cada unidad de longitud puede pensarse como una resistencia en serie). La constante de espacio, λ, se da como
\(\lambda=\sqrt{\frac{R_{M}}{R_{A}}} \Rightarrow V_{x}=V_{0} e^{-x / \lambda}\)
Ecuación de Constante Espacial
La constante espacial es análoga a las constantes de tiempo de los circuitos RC. Para señales que cambian rápidamente, la constante de tiempo de membrana es R M C M. V 0 aquí está el valor de CC al comienzo de la línea de transmisión, y V x es el valor a una distancia x de allí. Los valores típicos de λ son del orden de 0.1 a 1.0 mm [Kand81]. La constante de espacio se determina a partir de valores de CC, por lo que C M no se considera.
por lo que no se considera C M.
Figura 2.3.6-1. Circuito Modelo Axon.
A medida que un potencial de acción se propaga por un axón, la energía se pierde tanto en la resistencia al citoplasma de la serie como a la resistencia a la membrana paralela. La velocidad de transmisión se ve ralentizada por la capacitancia de la membrana.
La resistencia de un conductor disminuye a medida que aumenta el área de la sección transversal. Como resultado, algunas especies han desarrollado axones relativamente grandes, como el axón de calamar gigante que alcanza aproximadamente 1mm de diámetro. La resistencia disminuye en proporción al cuadrado del diámetro, pero la capacitancia aumenta en proporción. El efecto neto es una disminución en la constante de tiempo, R M C M, resultando en una transmisión más rápida. Otro enfoque biológico es rodear el axón con una capa aislante de mielina, llamada vaina mielinizada. El resultado es un aumento en la separación de las densidades de carga de capacitancia de membrana, lo que reduce la constante de tiempo RM C M ya que la capacitancia es inversamente proporcional a la distancia de separación
Ejemplo 2.3.6-1
Si la resistencia de la membrana es R M = 100 Ω mm y la resistencia axonal es R A = 10 Ω /mm, ¿a qué longitud una CC la señal bajará al 10% de su valor original?
Solución:
La ecuación de la constante espacial da
\(\lambda=\sqrt{\frac{R_{M}}{R_{A}}}=\sqrt{\frac{100 \Omega \mathrm{mm}}{10 \Omega / \mathrm{mm}}}=3.16 \mathrm{~mm}\)
\(0.1 V_{0}=V_{0} e^{-x / \lambda}\)
\(0.1=e^{-x / 3.16}\)
\(\ln 0.1=-\frac{x}{3.16}\)
\(x = 7.28 mm\)
■
Ejercicio 2.3.6-1
Si la resistencia de la membrana es R M = 80 Ω mm y la resistencia axonal es R A = 15 Ω /mm, ¿a qué longitud una CC la señal bajará a a) 10% de su valor original, b) 5% de su valor original y c) 1% de su valor original?
RESPUESTAS
a) 5.32 mm, b) 6.92 mm, c) 10.64 mm
■
2.3.7 Adaptación neuronal a través de inhibición lateral
La inhibición lateral es un fenómeno general que ocurre frecuentemente en capas de neuronas interconectadas. Las celdas están acopladas eléctricamente de modo que cuando una celda se dispara, inhibe que las células en su vecindario se disparen. Cuanto más conectada directamente esté una célula (por ejemplo, un vecino más cercano), mayor será el efecto de inhibición. Este proceso se exhibe en la capa celular horizontal (HC) en la retina para proporcionar la función de suavizado espacio-temporal [Dowl87]. La capa HC se puede modelar como una red de escalera de resistencia-condensador (RC) 2D, donde la constante de tiempo RC es la fuerza inhibidora de la red [Koch91].
La inhibición lateral en retina disminuye la señal de salida de fotorreceptores debido a la actividad en fotorreceptores cercanos; por lo tanto, las salidas de fotorreceptores se adaptan a cambios significativos en el vecindario local En términos de ingeniería, esto se considera un control de ganancia automático localizado (AGC). Un simple AGC aplicado en toda la imagen ayudaría a evitar la saturación de la imagen cuando hay luces brillantes y ayudaría a resaltar detalles oscuros en ausencia de luces brillantes. En un sistema de cámara convencional, se puede aplicar un único ajuste de ganancia a toda la imagen basado en el contenido de la imagen. Una variación de esto es la velocidad de obturación en la película que limita la duración del tiempo para recibir fotones. Se puede usar una película de alta velocidad (tiempo de integración corto) en presencia de luces brillantes, mientras que una película de velocidad lenta (mayor tiempo de integración) se puede usar en habitaciones oscuras. La dificultad es que tal elección se hace a través de toda la imagen. No sería posible capturar contrastes tanto oscuros como brillantes en una misma imagen.
Un AGC localizado, sin embargo, evitará la saturación debido a fuentes de intensidad brillante y permitirá detalles suficientes para resaltar objetos oscuros sobre un fondo oscuro. La inhibición lateral en una capa neuronal varía efectivamente el ACG a través del plano de procesamiento basado en la actividad promedio en el área localizada. Esto se logra en la primera capa celular horizontal en la retina.
La segunda capa de células retinianas conectadas lateralmente, las células amacrinas, añaden una inhibición lateral adicional al procesamiento retiniano, lo que hace que las salidas de células ganglionares en el nervio óptico se adapten al movimiento en la corriente de imágenes. La información de movimiento se envía inicialmente, pero luego se inhibe por esta capa. Se observa una adaptación similar a las señales transitorias en el sistema auditivo, ya que rápidamente se llama la atención hacia el inicio de un sonido, pero luego se suprime a medida que las señales inhibitorias neuronales se adaptan a este estímulo.
2.3.8 Un modelo de circuito de una neurona en equilibrio
Las permeabilidades iónicas (P K+, P Na+ y P Cl-) regulan cómo los iones lentos o rápidos pueden moverse de adentro a afuera o de afuera a dentro a través de la membrana celular de una neurona. Estos parámetros pueden modelarse como conductancias, como G K+, o resistencias, como R K+ = 1/ G K+. El potencial Nernst asociado con cada ion se puede modelar como una fuente independiente. Ya que [Cl -] i ≈ [Cl -] o el potencial Nernst para Cl - es esencialmente cero. Esto se debe en parte a que P Cl- tiende a cambiar para mantener las concentraciones aproximadamente iguales.
La Figura 2.3.8-1 muestra un modelo simplificado de una neurona en equilibrio. Las fuentes independientes representan los potenciales de Nernst debido a las diferencias de concentración entre el interior y el exterior de la célula. Para determinar el potencial de membrana en reposo, utilizamos la Ley de Voltaje (KVL) de Kirchoff para resolver el interior con respecto al exterior (tierra).
Ejemplo 2.3.8-1
Utilizando el modelo mostrado en la Figura 2.3.8-1 donde R K+ = 2MΩ, R Na+ = 1MΩ, E K+ = -75mV y E Na+ = +55mV determinan el potencial de fluido intracelular con respecto al fluido extracelular.
Solución:
Dejando que I K sea la corriente ascendente a través de R K y I Na sea la corriente ascendente a través de R Na,
-75mV + I K R K - I Na R Na - 55mV = 0, y I K = - I Na
=> I K (R K + R Na) = 130mV
=> I K = 43.3nA
=> V m = -75mV+ I K R K = -75mV+ (43.3nA) (2M) = 11.67 mV
Comprobar: - V m = +55mV+ I Na R Na = +55mV+ (-43.3nA) (1M) = 11.67 mV
■
La Figura 2.3.8-2 muestra el mismo modelo con fuentes de corriente dependientes que representan la Bomba Na-K. En ocasiones, los iones K + bombeados no están a la misma velocidad que los iones Na + bombeados hacia afuera. Sin embargo, si la neurona está en estado estacionario y [K +] i y [Na +] i son constantes, entonces los cálculos se simplifican como
I K = - I Bomba K y I Na = - I Na-Bomba
Para resolver el potencial de reposo, V m, observe estas dos ecuaciones mostradas anteriormente que se pueden combinar con estas relaciones actuales:
V m = E k + I K R K y V m = E Na + I Na R Na
Figura 2.3.8-2. Un modelo de una neurona en equilibrio con fuentes de corriente de bomba de iones.
Esta incluye fuentes de corriente dependientes que representan la bomba Na_K orgánica.
Ejemplo 2.3.8-2
En la Figura 2.3.8-2 dejemos que I K sea la corriente ascendente a través de R K y I Na sea la corriente ascendente a través de R Na. Calcular V m, I K y I Na si E k = -75 mV, E Na = +55 mV, P K = g K = 1μ mho, P Na = g Na = 0.2μ mho, y se bombean 4 iones Na + por cada 3 K + iones bombeados. Supongamos que [K +] i y [Na +] i son constantes, y se pueden descuidar otras influencias iónicas.
Solución:
R K = 1/ g K = 1MΩ
R Na = 1/ g Na = 5MΩ
“... 4 Na + iones hacia fuera por cada 3 K + in...” => 3 I Na-Bomba = - 4 I K-Bomba
=> I Bomba K = -0.75 I Bomba de Na
“... [K +] i y [Na +] i son constantes...” => I Na = - I Na-Bomba
=> I K = - I Bomba K = 0.75 I Bomba de Na
= -0.75 I Na
V m = -75mV + I K R K = +55mV + I Na R Na
=> -130mV = I Na R Na - (-0.75 I Na) R K
=> I Na = -22.61 nA
=> I K = (-0.75) I Na = 16.96 nA
V m = -75mV + I K R K = -58.04 mV
Comprobar: V m = +55mV + I Na R Na = -58.04 mV
■
Ejercicio 2.3.8-1
Dejar E K+ = -75mV y E Na+ = +55mV en el circuito de la Figura 2.3.8-1, donde I K es la corriente ascendente a través de R K y I Na es la corriente ascendente a través de R Na . Calcular V m para
- R K+ = 200KΩ, R Na+ = 5MΩ,
- R K+ = 2.6MΩ, R Na+ = 2.6MΩ, y
- R K+ = 5.1MΩ, R Na+ = 100KΩ
Con base en estos valores, complete el resto de la siguiente tabla:
| V m (mV) | |
| R K+ << R Na+ | ________________ |
| R K+ = 0.2MΩ, R Na+ = 5MΩ | ________________ |
| R K+ = 2.6MΩ, R Na+ = 2.6MΩ | ________________ |
| R K+ = 5.1MΩ, R Na+ = 0.1MΩ | ________________ |
| R K+ >> R Na+ | ________________ |
Respuestas:
| V m (mV) | |
| R K+ << R Na+ | ~ -75 mV |
| R K+ = 0.2MΩ, R Na+ = 5MΩ | -70 mV |
| R K+ = 2.6MΩ, R Na+ = 2.6MΩ | -10 mV |
| R K+ = 5.1MΩ, R Na+ = 0.1MΩ | 52.5 mV |
| R K+ >> R Na+ | ~ 55 mV |
Ejercicio 2.3.8-2
En la Figura 2.3.8-2 dejemos que I K sea la corriente ascendente a través de R K y I Na sea la corriente ascendente a través de R Na. Calcular V m, I K y I Na en el modelo en la Figura 2.3.8-2 si E k = -75 mV, E Na = +55 mV,
P K = g K = 5μ mho, P Na = g Na = 0.2μ mho, y se bombean 3 iones Na + por cada 2 K + iones bombeados. Supongamos que [K +] i y [Na +] i son constantes, y se pueden descuidar otras influencias iónicas.
Respuestas:
V m = -71.6mV, I K = 16.97nA, y I Na = -25.32nA
■
Ejercicio 2.4-3
Ejercicio de retrabajo 2.3.8-2 suponiendo que se bombean 5 iones K + por cada ion Na + bombeado hacia fuera:
En la Figura 2.3.8-2 dejemos que I K sea la corriente ascendente a través de R K y I Na sea la corriente ascendente a través de R Na. Calcular V m, I K y I Na en el modelo en la Figura 2.3.8-2 si E k = -75 mV, E Na = +55 mV,
P K = g K = 5μ mho, P Na = g Na = 0.2μ mho, y se bombean 5 K + iones por cada ion Na + bombeado. Supongamos que [K +] i y [Na +] i son constantes, y se pueden descuidar otras influencias iónicas.
Respuestas:
V m = -53.3 mV, I K = 108.3 nA y I Na = -21.67 nA
■
2.3.9 Detección de Movimiento Neuronal
Las entradas de neuronas adyacentes se pueden conectar de una manera que proporciona detección de movimiento. Las figuras 2.5-1 (a) y (b) muestran dos versiones de un modelo de detección de movimiento Hassenstein-Reichardt [Zorn90, Hass56]. Las dos entradas, x 1 y x 2, representan salidas de dos receptores adyacentes en un sistema sensorial. En primera instancia, una derivada de tiempo de una entrada se multiplica por el valor del receptor adyacente. En la segunda instancia, una versión retardada de una entrada se multiplica por el valor del receptor adyacente. En ambas instancias, se comparan las salidas de ambos productos: Si son iguales, se cancelan entre sí en la suma. De lo contrario, el resultado es positivo o negativo, dependiendo de la dirección del objeto.
En la Figura 2.3.9-1 (c) se mueve un bloque binario de tres elementos a la derecha (mitad superior) y luego a la izquierda (mitad inferior). La entrada es una matriz de diez elementos, y el bloque es visto por el patrón de unos. Se muestra la salida del detector de movimiento, seguida de los resultados interpretados. Ambos modelos (a) y (b) dan como resultado la misma salida y resultados interpretados. El ejemplo aquí es binario, de manera que los resultados son muy limpios. Para valores más realistas, se necesitarían establecer umbrales para reducir los efectos del ruido.
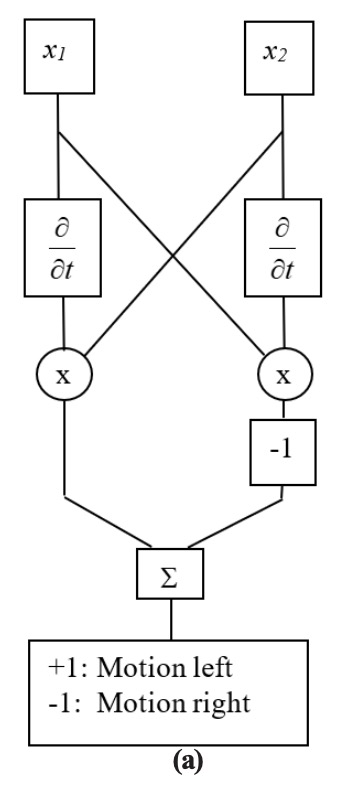
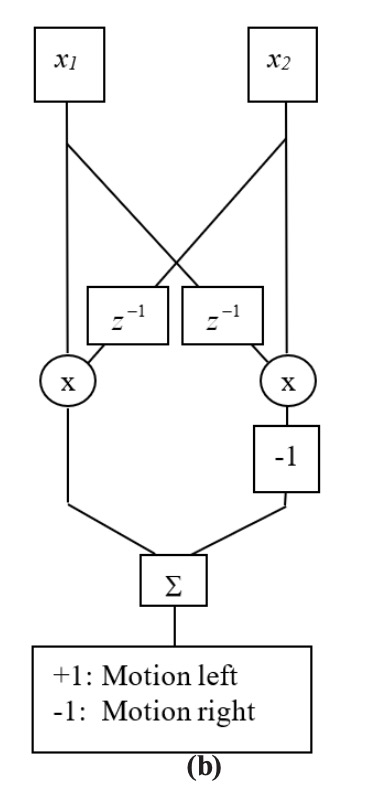
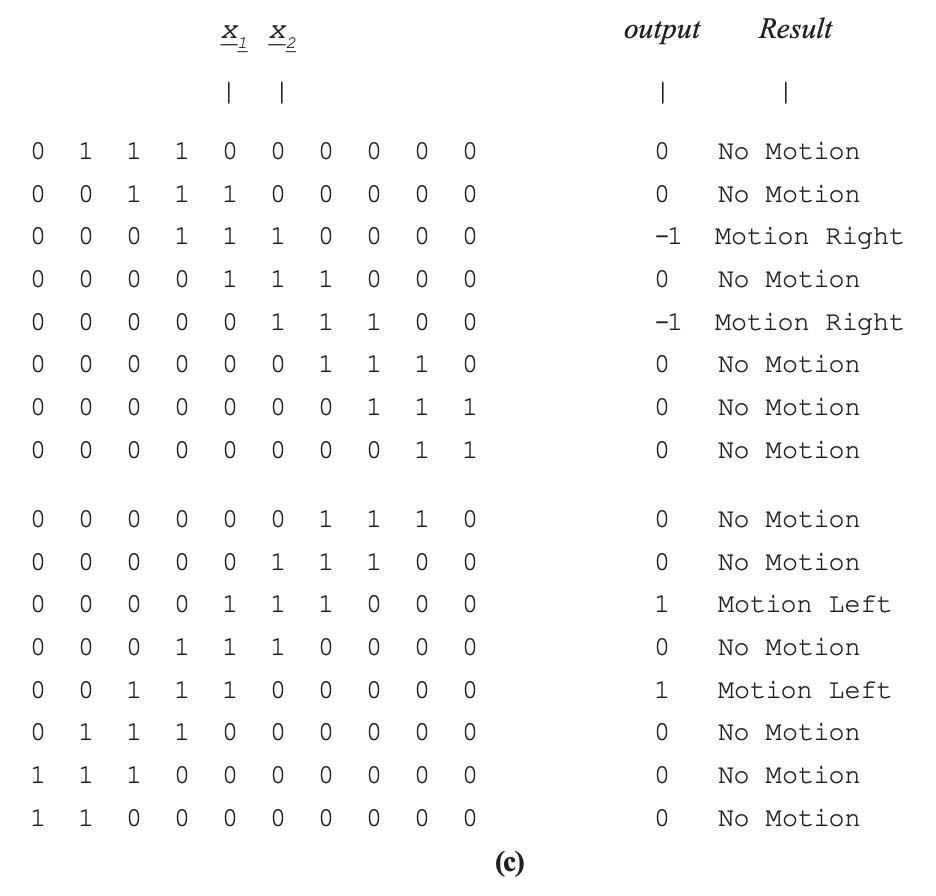
Figura 2.3.9—1. Detectores de Movimiento Hassenstein-Reichardt.
Se muestran dos implementaciones: (a) diferenciadores en canal, y (b) retardos de canal cruzado. (c) Los resultados de la simulación de MATLAB son los mismos para ambas implementaciones.
Ejercicio 2.3.9-1
Dar la salida esperada (Derecha, Izquierda o Sin Movimiento) de un detector de movimiento Hassenstein-Reichardt de dos elementos dadas las siguientes dos secuencias de entrada; supongamos que todos los valores anteriores son cero. Cualquiera de los modelos (derivados en canal o retardos entre canales) debería dar los mismos resultados:
| Secuencia 1 | Secuencia 2 |
| x 1 x 2 Salida | x 1 x 2 Salida |
| 0 0 Sin Movimiento | 0 0 Sin Movimiento |
| 0 0 __________ | 1 0 __________ |
| 1 1 __________ | 0 1 __________ |
| 0 0 __________ | 0 0 __________ |
| 1 0 __________ | 0 1 __________ |
| 0 1 __________ | 1 1 __________ |
| 1 0 __________ | 1 0 __________ |
| 0 0 __________ | 0 0 __________ |
Respuestas:
| Secuencia 1 | Secuencia 2 |
| x 1 x 2 Salida | x 1 x 2 Salida |
| 0 0 Sin Movimiento | 0 0 Sin Movimiento |
| 0 0 Sin Movimiento | 1 0 Sin Movimiento |
| 1 1 Sin Movimiento | 0 1 Movimiento a la derecha |
| 0 0 Sin Movimiento | 0 0 Sin Movimiento |
| 1 0 Sin Movimiento | 0 1 Sin Movimiento |
| 0 1 Movimiento a la derecha | 1 1 Movimiento Izquierdo |
| 1 0 Movimiento a la izquierda | 1 0 Movimiento a la izquierda |
| 0 0 Sin Movimiento | 0 0 Sin Movimiento |


