17.4: La ecuación de Nernst
- Page ID
- 1946
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Relacionar los potenciales de celda con los cambios de energía libre
- Usar la ecuación de Nernst para determinar los potenciales de celda en condiciones no estándar
- Hacer cálculos que involucran la conversión entre potenciales de celda, cambios de energía libre y constantes de equilibrio
Ahora extenderemos la electroquímica por determinando la relación entre \(E^\circ_\ce{celda}\) y las cantidades termodinámicas como ΔG ° (energía libre de Gibbs) y K (la constante de equilibrio). En las celdas galvánicas, la energía química se convierte en energía eléctrica, que se puede usar para hacer trabajo. El trabajo eléctrico es el producto de la carga transferida multiplicada por la diferencia del potencial (voltaje):
\[\mathrm{electrical\: work=volts \times (charge\: in\: coulombs)=J}\]
La carga de 1 mol de electrones está dada por la constante de Faraday (F)
\[ \begin{align*} F &=\dfrac{6.022 \times 10^{23}\:e^-}{mol} \times \dfrac{1.602 \times 10^{−19}\:C}{e^-} \\[5pt] &=9.648 \times 10^4\:\dfrac{C}{mol} \\[5pt] &=9.648 \times 10^4\:\dfrac{J}{V⋅mol} \end{align*}\]
Por lo tanto
\[\mathrm{total\: charge=(number\: of\: moles\: of\: e^-)} \times F=nF\]
En esta ecuación, \(n\) es el número de moles de electrones para la reacción equilibrada de oxidación-reducción. El potencial de celda medido es el potencial máximo que la celda puede producir y está relacionado con el trabajo eléctrico (wele) por
\[E_\ce{cell}=\dfrac{−w_\ce{ele}}{nF}\hspace{40px}\ce{or}\hspace{40px}w_\ce{ele}=−nFE_\ce{cell}\]
El signo negativo del trabajo indica que el trabajo eléctrico se hizo por el sistema (la celda galvánica) en los alrededores. En un capítulo anterior, la energía libre se definió como la energía que estaba disponible para hacer un trabajo. En particular, el cambio en la energía libre se definió en términos del trabajo máximo (\(w_{max}\)), que, para los sistemas electroquímicos, es \(w_{ele}\).
Podemos verificar que los signos son correctos cuando nos damos cuenta de que \(n\) y \(F\) son constantes positivas y que las celdas galvánicas, que tienen potenciales de celda positivos, involucran reacciones espontáneas. Por eso, las reacciones espontáneas, que tienen \(ΔG<0\), deben tener \(E_{celda}>0\). Si todos los reactivos y productos están en sus estados estándar, esto se convierte en
Esto nos da una manera de relacionar los potenciales de celda estándar con las constantes de equilibrio, ya que
\[ΔG°=−RT\ln K\]
\[−nFE^\circ_\ce{cell}=−RT\ln K\]
o
\[ E^\circ_\ce{cell}=\dfrac{RT}{nF}\ln K\]
La mayoría de las veces, las reacciones electroquímicas se ejecutan a una temperatura estándar (298.15 K). Recolectar los datos a esta temperatura nos da
\[\begin{align*} E^\circ_\ce{cell}&=\dfrac{RT}{nF}\:\ln K \\[5pt] &=\dfrac{\left(8.314\:\dfrac{\ce{J}}{\textrm{K⋅mol}}\right)(298.15\:K)}{n \times 96,485\: \textrm{C/V⋅mol}}\:\ln K \\[5pt] &=\dfrac{\mathrm{0.0257\: V}}{n}\:\ln K \end{align*} \]
donde n es el número de moles de electrones. Por razones históricas, el logaritmo en ecuaciones que involucran potenciales de celda a veces se expresa usando logaritmos de base 10 (log), que cambia la constante por un factor de 2.303:
\[E^\circ_\ce{cell}=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K\]
Por lo tanto, si se sabe o se puede calcular ΔG °, K o \(E^\circ_\ce{celda}\), las otras dos cantidades se pueden determinar fácilmente. Las relaciones se muestran gráficamente en la Figura \(\PageIndex{1}\).
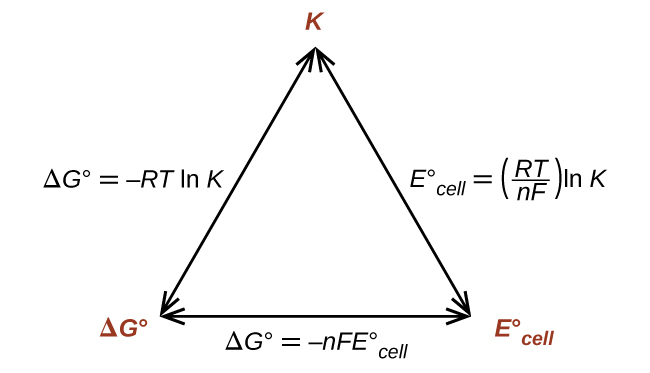
Dada cualquiera de las cantidades, se pueden calcular las otras dos.
Ejemplo \(\PageIndex{1}\): Constantes de equilibrio, potenciales y cambios de energía libre
¿Cuál es el cambio de energía libre estándar de Gibbs y la constante de equilibrio para la siguiente reacción a 25 °C?
Solución
La reacción involucra una reacción de oxidación-reducción, por eso el potencial de celda estándar se puede calcular usando los datos en Tabla P1.
\[\begin{align*}
&\textrm{anode (oxidation): }\ce{Fe}(s)⟶\ce{Fe^2+}(aq)+\ce{2e-} \hspace{40px} E^\circ_{\ce{Fe^2+/Fe}}=\mathrm{−0.447\: V} \nonumber\\
&\textrm{cathode (reduction): }2 \times (\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)) \hspace{40px} E^\circ_{\ce{Ag+/Ag}}=\mathrm{0.7996\: V} \nonumber\\
&E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=E^\circ_{\ce{Ag+/Ag}}−E^\circ_{\ce{Fe^2+/Fe}}=\mathrm{+1.247\: V} \nonumber
\end{align*} \nonumber\]
Recuerde que el potencial de celda del cátodo no se multiplica por dos al determinar el potencial de celda estándar. Con n = 2, la constante de equilibrio es entonces
\[E^\circ_\ce{cell}=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K \nonumber\]
\[\begin{align*} K&=10^{n \times E^\circ_\ce{cell}/\mathrm{0.0592\: V}} \\[5pt] &=10^{2 \times \mathrm{1.247\: V/0.0592\: V}} \\[5pt] &=10^{42.128} \\[5pt] &=1.3 \times 10^{42}\end{align*}\]
La energía libre estándar es entonces
\[ΔG°=−nFE^\circ_\ce{cell}\nonumber\]
\[ΔG°=\mathrm{−2 \times 96,485\:\dfrac{J}{\textrm{V⋅mol}} \times 1.247\: V=−240.6\:\dfrac{kJ}{mol}}\nonumber\]
Verifique su respuesta: un potencial de celda estándar positivo significa una reacción espontánea, por eso el cambio de energía libre estándar debe ser negativo y la constante de equilibrio debe ser> 1.
Ejercicio \(\PageIndex{1}\)
¿Cuál es el cambio de energía libre de Gibbs estándar y la constante de equilibrio para la siguiente reacción a temperatura ambiente? ¿La reacción es espontánea?
\[\ce{Sn}(s)+\ce{2Cu^2+}(aq)⇌\ce{Sn^2+}(aq)+\ce{2Cu+}(aq)\nonumber\]
- Respuesta
-
Espontáneo; n = 2; \(E^\circ_\ce{cell}=\mathrm{+0.291\: V}\); \(ΔG°=\mathrm{−56.2\:\dfrac{kJ}{mol}}\); \(K = 6.8 \times 10^9\).
Ahora que se ha establecido la conexión entre la energía libre y los potenciales de celda, siguen las concentraciones no estándar. Recuerde que
\[ΔG=ΔG°+RT\ln Q\]
donde \(Q\)es el cociente de la reacción (consulte el capítulo sobre los fundamentos del equilibrio). Convirtiendo a los potenciales de celda:
\[−nFE_\ce{cell}=−nFE^\circ_\ce{cell}+RT\ln Q \label{nernst1A}\]
o
\[E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{RT}{nF}\:\ln Q \label{nernst1B}\]
La ecuación \ref{nernst1B} es la ecuación de Nernst generalizada que se puede aplicar a cualquier temperatura. Sin embargo, se puede simplificar para reacciones que ocurren a 25 ° C (298.15 K) reescribiéndolo como
\[E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0257\: V}}{n}\:\ln Q \label{nernst2A}\]
o
\[ E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\log_{10} Q \label{nernst2B}\]
Si la temperatura no es 298.15 K, es necesario recalcular el potencial con la Ecuación \ref{nernst1B}. Con la ecuación de Nernst, es posible calcular el potencial de celda en condiciones no estándar. Este ajuste es necesario porque los potenciales determinados en diferentes condiciones tendrán valores diferentes.
Ejemplo \(\PageIndex{2}\): Potenciales de celda en condiciones no estándar
Considere la siguiente reacción a una temperatura ambiente:
\[\ce{Co}(s)+\ce{Fe^2+}(aq,\:1.94\:M)⟶\ce{Co^2+}(aq,\: 0.15\:M)+\ce{Fe}(s)\nonumber\]
¿Es el proceso espontáneo?
Solución
Hay dos maneras de resolver este problema. Si la información termodinámica de la Tabla T1 estuviera disponible, usted podría calcular el cambio de energía libre. Si el cambio de energía libre es negativo, el proceso es espontáneo. El otro enfoque, que usaremos, requiere información como la que se da en la Tabla P1. Usando esos datos, se puede determinar el potencial de celda. Si el potencial de celda es positivo, el proceso es espontáneo. Colectando información de la Tabla P1 y el problema,
&\textrm{Anode (oxidation): }\ce{Co}(s)⟶\ce{Co^2+}(aq)+\ce{2e-} \hspace{40px} E^\circ_{\ce{Co^2+/Co}}=\mathrm{−0.28\: V}\\
&\textrm{Cathode (reduction): }\ce{Fe^2+}(aq)+\ce{2e-}⟶\ce{Fe}(s) \hspace{40px} E^\circ_{\ce{Fe^2+/Fe}}=\mathrm{−0.447\: V}\\
&E^\circ_\ce{cell}=E^\circ_\ce{cathode}−E^\circ_\ce{anode}=\mathrm{−0.447\: V−(−0.28\: V)=−0.17\: V}
\end{align*}\nonumber\]
El proceso no es espontáneo en condiciones estándar. Usando la ecuación de Nernst y las concentraciones indicadas en el problema y \(n = 2\),
\[Q=\ce{\dfrac{[Co^2+]}{[Fe^2+]}}=\dfrac{0.15\:M}{1.94\:M}=0.077\nonumber\]
Ahora podemos insertarlos en la ecuación de Nernst a una temperatura ambiente (Ecuación \ref{nernst2B})
\[\begin{align*} E_\ce{cell} &=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\:\log Q \\[5pt] &=\mathrm{−0.17\: V−\dfrac{0.0592\: V}{2}\:\log 0.077} \\[5pt] &=\mathrm{−0.17\: V+0.033\: V=−0.014\: V} \end{align*}\]
El proceso es (todavía) no espontáneo.
Ejercicio \(\PageIndex{2}\)
¿Cuál es el potencial de celda para la siguiente reacción a una temperatura ambiente?
\[\ce{Al}(s)│\ce{Al^3+}(aq,\:0.15\:M)║\ce{Cu^2+}(aq,\:0.025\:M)│\ce{Cu}(s)\nonumber\]
¿Cuáles son los valores de n y Q para la reacción general? ¿Es la reacción espontánea en estas condiciones?
- Respuesta
-
n = 6; Q = 1440; Ecell = +1.97 V, espontáneo.
Finalmente, estudiaremos un tipo especial de celda llamada la celda de concentración. En una celda de concentración, los electrodos son del mismo material y las semiceldas solo difieren en la concentración. Dado que uno o ambos compartimentos no es estándar, los potenciales de celda serán desiguales; por eso habrá una diferencia de potencial, que se puede determinar con la ayuda de la ecuación de Nernst.
Ejemplo \(\PageIndex{3}\): Celda de concentración
¿Cuál es el potencial celular de la celda de concentración descrita por
Solución
De la información dada:
\[\begin{align*}
&\textrm{Anode: }\ce{Zn}(s)⟶\ce{Zn^2+}(aq,\: 0.10\:M)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−0.7618\: V}\\
&\textrm{Cathode: }\ce{Zn^2+}(aq,\: 0.50\:M)+\ce{2e-}⟶\ce{Zn}(s) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{−0.7618\: V}\\
&\overline{\textrm{Overall: }\ce{Zn^2+}(aq,\: 0.50\:M)⟶\ce{Zn^2+}(aq,\: 0.10\:M) \hspace{40px} E^\circ_\ce{cell}=\mathrm{0.000\: V}}
\end{align*} \nonumber\]
El potencial de celda estándar es cero porque el ánodo y el cátodo involucran la misma reacción; sólo cambia la concentración de Zn2+. Sustituyendo en la ecuación de Nernst,
\[E_\ce{cell}=\mathrm{0.000\: V−\dfrac{0.0592\: V}{2}\:\log\dfrac{0.10}{0.50}=+0.021\: V} \nonumber\]
y el proceso es espontáneo en estas condiciones.
Verifique su respuesta: en una celda de concentración, el potencial de celda estándar siempre será cero. Para obtener un potencial de celda positivo (proceso espontáneo), el cociente de la reacción Q debe ser <1. Q <1 en este caso, el proceso es espontáneo.
Ejercicio \(\PageIndex{3}\)
¿Qué valor de Q para la celda de concentración anterior resultaría en un voltaje de 0.10 V? Si la concentración de ion zinc en el cátodo fue de 0.50 M, ¿Cuál fue la concentración en el ánodo?
- Respuesta
-
Q = 0.00042; [Zn2+]cat = 2.1 \times 10−4 M.
Resumen
El trabajo eléctrico (wele) es el negativo del producto de la carga total (Q) y el potencial de la celda (Ecell). La carga total se puede calcular como el número de moles de electrones (n) multiplicado por la constante de Faraday (F = 96,485 C / mol e−). El trabajo eléctrico es el trabajo máximo que puede producir el sistema y, es igual al cambio de energía libre. Así, cualquier cosa que se pueda hacer con un cambio de energía libre también se puede hacer con un potencial de celda. La ecuación de Nernst relaciona el potencial de celda en condiciones no estándar con el logaritmo del cociente de la reacción. Las celdas de concentración aprovechan esta relación y producen un potencial de celda positivo usando las semiceldas que solo difieren en la concentración de sus solutos.
Ecuaciones Clave
- \(E^\circ_\ce{cell}=\dfrac{RT}{nF}\:\ln K\)
- \(E^\circ_\ce{cell}=\dfrac{\mathrm{0.0257\: V}}{n}\:\ln K=\dfrac{\mathrm{0.0592\: V}}{n}\:\log K \hspace{40px} \mathrm{(at\: 298.15\:\mathit{K})}\)
- \(E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{RT}{nF}\:\ln Q \hspace{40px} \textrm{(Nernst equation)}\)
- \(E_\ce{cell}=E^\circ_\ce{cell}−\dfrac{\mathit{0.0257\: V}}{n}\:\ln Q=E^\circ_\ce{cell}−\dfrac{\mathrm{0.0592\: V}}{n}\:\log Q \hspace{40px} \mathrm{(at\: 298.15\:\mathit{K})}\)
- ΔG = −nFEcell
- \(ΔG^∘=−nFE^\circ_\ce{cell}\)
- \(w_\ce{ele}=w_\ce{max}=−nFE_\ce{cell}\)
Glosario
- celda de concentración
- celda galvánica en la que las semiceldas son iguales excepto por la concentración de solutos; espontáneo cuando la reacción general es la dilución del soluto
- trabajo eléctrico (Wele)
- negativo de la carga total multiplicado por el potencial de la celda; igual a wmax para el sistema y es igual al cambio de energía libre (ΔG)
- Constante de Faraday (F)
- Carga de 1 mol de electrones; F = 96,485 C / mol e−
- Ecuación de Nernst
- ecuación que relaciona el logaritmo del cociente de la reacción (Q) con los potenciales de celda no estándar; se puede usar para relacionar las constantes de equilibrio con los potenciales de celda estándar
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


