15.3: Equilibrios múltiples
- Page ID
- 1921
Habilidades para desarrollar
- Describir ejemplos de sistemas involucrando dos (o más) equilibrios químicos simultáneos
- Calcular concentraciones de reactivos y productos para sistemas de equilibrios múltiples
- Comparar la disolución y la formación de los electrolitos débiles
Algunas veces cuando una reacción de equilibrio no puede adecuadamente describir el sistema siendo estudiado. A veces tenemos más de un tipo de equilibrio ocurriendo al mismo tiempo ( por ejemplo, una reacción de ácido-base y una reacción de precipitación).
El océano es un ejemplo único de un sistema con equilibrios múltiples, o múltiples estados de equilibrio de solubilidad trabajando simultáneamente. El dióxido de carbono en el aire se disuelve en el agua del mar y forma el ácido carbónico (H2CO3). El ácido carbónico se ioniza para formar los iones de hidrógeno y los iones de bicarbonato \(\ce{(HCO3- )}\), que se puede ionizar aun mas en iones de hidrógeno y carbonato \(\ce{(CO3^2- )}\):
\[\ce{CO2}(g)⇌\ce{CO2}(aq)\]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq)\]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq)\]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq)\]
El exceso de iones de H+ hace que el agua de mar sea más ácida. Un aumento en la acidificación del océano puede tener un impacto negativo en los la formación de arrecifes de coral, porque no pueden absorber el carbonato de calcio que necesitan para crecer y mantener sus esqueletos (Figura \(\PageIndex{1}\)). En turno, esto interrumpe el biosistema local que depende en el arrecife de coral para sobrevivir. Si se ven afectados suficientes arrecifes de coral, las interrupciones de vida marina se pueden sentir globalmente. Los océanos del mundo se encuentran en medio de un período de intensa acidificación, que se cree que comenzó a mediados del siglo XIX, y que ahora se está acelerando a un ritmo más rápido que cualquier cambio en el pH oceánico en los últimos 20 millones de años.

Aprenda mas sobre la acidificación del mar y como afecta otras criaturas marinas.
Los sólidos un poco solubles derivados de los ácidos débiles generalmente se disuelven en los ácidos fuertes, a menos que sus productos de solubilidad sean muy pequeños. Por ejemplo, podemos disolver el CuCO3, FeS y Ca3(PO4)2 en HCl porque sus aniones básicos reaccionan para formar ácidos débiles (H2CO3, H2S y \(\ce{H2PO4-}\)). La disminución resultante en la concentración del anión da como resultado un desplazamiento de las concentraciones de equilibrio hacia la derecha de acuerdo con el principio de Le Chatelier.

Para nosotros es de particular relevancia la disolución de la hidroxiapatita, Ca5(PO4)3OH, en ácido. Las apatitas son una clase de minerales de fosfato de calcio (Figura \(\PageIndex{2}\)); una forma biológica de la hidroxiapatita se encuentra como mineral principal en el esmalte de nuestros dientes. Una mezcla de hidroxiapatita y agua (o saliva) contiene una mezcla en equilibrio de Ca5(PO4)3OH sólido y iones de Ca2+ disueltos, \(\ce{PO4^3-}\) y los iones de OH–:
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq)\]
Cuando se exponen al ácido, los iones de fosfato reaccionan con los iones de hidronio para formar iones de fosfato de hidrógeno y últimamente al ácido fosfórico:
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O}\]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O}\]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O}\]
El ion de hidróxido reacciona para formar el agua:
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O}\]
Estas reacciones disminuyen las concentraciones de los iones de fosfato e hidróxido, y la hidroxiapatita adicional se disuelve en una solución ácida de acuerdo con el principio de Le Chatelier. Nuestros dientes desarrollan caries cuando los residuos ácidos producidos por las bacterias que crecen en ellos hacen que la hidroxiapatita del esmalte se disuelva. Las pastas dentales con fluoruro contienen fluoruro de sodio, NaF o fluoruro estannoso [más apropiadamente llamado el fluoruro de estaño (II)], SnF2. Funcionan por dreemplazando el io de n OH– en la hidroxiapatita con el ion de F–, produciendo fluorapatita, Ca5(PO4)3F:
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-}\]
El Ca5(PO4)3F que resulta es un poco menos soluble que el Ca5(PO4)3OH, y F– es una base más débil que el OH–. Ambos factores hacen que la fluorapatita sea más resistente al ataque de los ácidos que la hidroxiapatita. Para obtener más información, consulte el artículo Química en la vida cotidiana sobre el papel del flúor en la prevención de la caries dental.
Papel del fluoruro en la prevención de la caries dental
Como vimos previamente, los iones de fluoruro ayudan a proteger nuestros dientes al reaccionar con la hidroxiapatita para formar la fluorapatita, Ca5(PO4)3F. Ya que falta del ión de hidróxido, la fluorapatita es más resistente a los ataques de los ácidos en la boca y es menos soluble, protegiendo nuestros dientes. Los científicos descubrieron que el agua naturalmente fluorada podría ser beneficiosa para los dientes, por lo que se convirtió en una práctica común agregar fluoruro al agua potable. Las pastas dentales y los enjuagues bucales también contienen cantidades de fluoruro (Figura \(\PageIndex{3}\)).

Desafortunadamente, el exceso de fluoruro puede ser perjudicial. Las fuentes naturales de agua potable en varias partes del mundo tienen concentraciones variables de fluoruro, y los lugares donde esa concentración es alta son propensos a ciertos riesgos para la salud cuando no hay otra fuente de agua potable. El efecto secundario más grave del exceso de fluoruro es la enfermedad ósea, fluorosis esquelética. Cuando hay un exceso de fluoruro en el cuerpo, puede causar que las articulaciones se hagan rígidas y los huesos se vuelvan más gruesos. Puede afectar gravemente la movilidad y afectar negativamente a la glándula tiroides. La fluorosis esquelética es una afección que padecen más de 2.7 millones de personas en todo el mundo. Entonces, aunque el fluoruro puede proteger nuestros dientes de las caries, la Agencia de Protección Ambiental de EE. UU. establece un nivel máximo de 4 ppm (4 mg/L) de fluoruro en el agua potable en los EE. UU. Los niveles de fluoruro en el agua no están regulados en todos los países, por eso la fluorosis es un problema en áreas con altos niveles de fluoruro en las aguas subterráneas.
Cuando la lluvia ácida ataca la piedra caliza o el mármol, que son carbonatos de calcio, se produce una reacción similar al ácido con la hidroxiapatita. El ion de hidronio de la lluvia ácida se combina con el ion carbonato de los carbonatos de calcio y forma el ion hidrogenocarbonato, un ácido débil:
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l)\]
El hidrogenocarbonato de calcio, Ca(HCO3)2, es soluble, por eso los objetos hechos de piedra caliza y mármol se disuelven lentamente en la lluvia ácida.
Si se agrega el carbonato de calcio a un ácido concentrado, el ion de hidronio reacciona con el ion carbonato según la ecuación:
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l)\]
(La lluvia ácida generalmente no es lo suficientemente ácida para causar esta reacción; sin embargo, los ácidos de laboratorio sí lo son). La solución se puede saturar con el ácido carbónico del electrolito débil, que es inestable, y puede formar gas de dióxido de carbono:
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l)\]
Estas reacciones disminuyen la concentración de los iones de carbonato y el carbonato de calcio adicional se disuelve. Si hay suficiente ácido presente, la concentración del ion carbonato se reduce a un nivel tan bajo que el cociente de reacción para la disolución del carbonato cálcico permanece menor que el producto de solubilidad del carbonato cálcico, incluso después de que se haya disuelto todo el carbonato cálcico.
Ejemplo\(\PageIndex{1}\): Prevención de la precipitación de Mg(OH)2
Calcule la concentración del ion de amonio que se requiere para evitar la precipitación de Mg(OH)2 en una solución con [Mg2+] = 0.10 M y [NH3] = 0.10 M.
Solución
Dos equilibrios son parte de este sistema:
- Reacción (1): \(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Reacción (2): \(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Para evitar la formación de Mg(OH)2 sólido, debemos ajustar la concentración de OH– de modo que el cociente de reacción para la Ecuación (1), Q = [Mg2+] [OH–]2, sea menor que Ksp para Mg(OH)2. (Para simplificar el cálculo, determinamos la concentración de OH– cuando Q = Ksp.) [OH–] se puede reducir mediante la adición de \(\ce{NH4+}\), que desplaza la Reacción (2) hacia la izquierda y reduce [OH–].
- Determinamos a que [OH–] nos da Q = Ksp cuando [Mg2+] = 0.10 M: \[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
El Mg(OH)2 solido no se formará en esta solución cuando [OH–] es menos que 9.4 × 10–6 M.
Cuando \(\ce{[NH4+]}\) es igual a 0.19 M, [OH–] será 9.4 × 10–6 M. Cualquier \(\ce{[NH4+]}\) mas grande que 0.19 M reducirá [OH–] a menos que 9.4 × 10–6 M y prevenir la formación de Mg(OH)2.
Ejercicio \(\PageIndex{1}\)
Considere los dos equilibrios:
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
y calcule la concentración del ión de hidronio requerida para evitar la precipitación de ZnS en una solución que es 0.050 M en Zn2+ y saturada con H2S (0.10 M H2S).
- Respuesta
-
\[\ce{[H3O+]}>0.2\:M \nonumber\]
([S2–] es menos que 2 × 10–26 M y la precipitación de ZnS no ocurre.)
Por lo tanto, los cálculos precisos de la solubilidad de los sólidos a partir del producto de solubilidad se limitan a los casos en los que la única reacción significativa que ocurre cuando el sólido se disuelve es la formación de sus iones.
Ejemplo \(\PageIndex{2}\): Equilbrios Múltiples
Los haluros de plata no expuestos se eliminan de la película fotográfica cuando reaccionan con el tiosulfato de sodio (\(\ce{Na2S2O3}\), llamado hipo) para formar el ion complejo \(\ce{Ag(S2O3)2^3-}\) (Kf = 4.7 × 1013). La reacción con el bromuro de plata es:
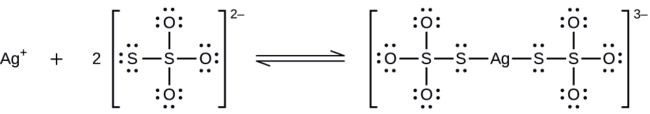
Que masa de Na2S2O3 se requiere para preparar 1.00 L de una solución que disolverá 1.00 g de AgBr mediante la formación de \(\ce{Ag(S2O3)2^3-}\)?
Solución
Hay dos equilibrios involucrados cuando AgBr se disuelve en una solución que contiene el ión de \(\ce{S2O3^2-}\):
- Reacción (1): \(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Reacción (2): \(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Para que se disuelva 1.00 g de AgBr, el [Ag+] que resulta en la solución debe ser lo suficientemente bajo para que Q para reacción (1) sea menor que Ksp para esta reacción. Reducimos [Ag+] cuando agregamos \(\ce{S2O3^2-}\) y por lo tanto hacemos que reacción (2) se desplace hacia la derecha. Necesitamos los siguientes pasos para determinar qué masa de Na2S2O3 se necesita para proporcionar la \(\ce{S2O3^2-}\).
- Calculamos [Br–] producido por la disolución completa de 1.00 g de AgBr (5.33 × 10–3 mol AgBr) en 1.00 L de solución: \[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
Usamos [Br–] y Ksp para determinar la concentración máxima posible de Ag+ que puede estar presente sin causar la precipitación de AgBr:
- Determinamos que (\mathit{[S_2O_3^{2-}]}\) requerido para producir [Ag+] = 9.4 × 10-11 M después de que el ion Ag+ restante haya reaccionado con \(\mathit{S_2O_3^{2-}}\) de acuerdo con la ecuación:
\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Porque 5.33 × 10–3 mol de AgBr disuelve:
\[(5.33×10^{−3})−(9.4×10^{−11})=5.33×10^{−3}\ce{\:mol\:Ag(S2O3)2^3-} \nonumber \]Así, a equilibrio: \(\ce{[Ag(S2O3)2^3- ]}\) = 5.33 × 10–3 M, [Ag+] = 9.4 × 10–11 M, y Q = Kf = 4.7 × 1013:
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \] \[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Cuando \(\ce{[S2O3^2- ]}\) es 1.1 × 10–3 M, [Ag+] es 9.4 × 10–11 M y todo el AgBr permanece disuelto.
- Determinamos el número total de moles de \(\mathit{S_2O_3^{2-}}\) que se deben agregar a la solución. Esto es igual a la cantidad que reacciona con Ag + para formar \(\ce{Ag(S2O3)2^3-}\) más la cantidad de \(\ce{S2O3^2-}\) libre en solución en equilibrio. Para formar 5.33 × 10–3 moles de \(\ce{Ag(S2O3)2^3-}\) se requieren 2 × (5.33 × 10–3) moles de \(\ce{S2O3^2-}\). Además, hay 1.1 × 10–3 mol de \(\ce{S2O3^2-} \) sin reaccionar (Paso 3). Por tanto, la cantidad total de \(\ce{S2O3^2-}\) que se debe agregar es: \[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Determinamos la masa de Na2S2O3 requerida para producir 1.18 × 10–2 mol \(\mathit{S_2O_3^{2 -}}\) usando la masa molar de Na2S2O3:
\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Por tanto, 1.00 L de una solución preparada a partir de 1.9 g de Na2S2O3 disuelve 1.0 g de AgBr.
Ejercicio \(\PageIndex{2}\)
Se sabe que el AgCl(s), o el cloruro de plata, tiene una solubilidad muy baja: \(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\), Ksp = 1.6 × 10–10. Agregando el amoníaco aumenta la solubilidad de AgCl significativamente porque se forma un ion complejo: \(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), Kf = 1.7 × 107. ¿Qué masa de NH3 se requiere para preparar 1.00 L de solución que disolverá 2.00 g de AgCl mediante la formación de \(\ce{Ag(NH3)2+}\)?
- Respuesta
-
1.00 L de una solución preparada con 4.81 g de NH3 disuelve 2.0 g de AgCl.
Disolución versus formación de electrolitos débiles
Podemos determinar cómo cambiar la concentración de los iones en el equilibrio entre un sólido un poco soluble y una solución de sus iones aplicando el principio de Le Chatelier. Por ejemplo, una forma de controlar la concentración del ion manganeso (II), Mn2+, en una solución es ajustar el pH de la solución y, en consecuencia, manipular el equilibrio entre el hidróxido de manganeso (II) sólido un poco soluble, manganeso (II) ion e ion hidróxido:
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2}\]
Esto podría ser importante para una lavandería porque la ropa lavada con el agua que tiene una concentración de manganeso más grande que 0.1 mg por litro se puede manchar con manganeso. Podemos reducir la concentración de manganeso por aumentando la concentración de los iones de hidróxido. Podríamos agregar, por ejemplo, una pequeña cantidad de NaOH o alguna otra base como los silicatos que se encuentran en muchos detergentes para ropa. A medida que aumenta la concentración de iones OH–, el equilibrio se desplaza hacia la izquierda y la concentración de iones Mn2+ se reduje mientras la cantidad de Mn(OH)2 sólido aumenta en la mezcla de equilibrio, como predice el principio de Le Chatelier.
Ejemplo \(\PageIndex{3}\): Equilibrio de solubilidad de un sólido un poco soluble
¿Cuál es el efecto sobre la cantidad de Mg(OH)2 sólido que se disuelve y las concentraciones de Mg2+ y OH– cuando cada uno de los siguientes se agrega a una mezcla de Mg(OH)2 sólido en el agua en equilibrio?
- MgCl2
- KOH
- an acid
- NaNO3
- Mg(OH)2
Solución
El equilibrio entre el Mg(OH)2 sólido y una solución de Mg2+ y OH– es:
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(a) La reacción se desplaza hacia la izquierda para disminuir la tensión producida por el ion Mg2+ adicional, de acuerdo con el principio de Le Chatelier. En términos cuantitativos, el Mg2+ añadido hace que el cociente de la reacción sea mayor que el producto de solubilidad (Q> Ksp), y se forma el Mg(OH)2 hasta que el cociente de la reacción sea igual a Ksp. En el nuevo equilibrio, [OH–] es menor y [Mg2+] es mayor que en la solución de Mg(OH)2 en el agua pura. Hay más Mg(OH)2 sólido presente.
(b) La reacción se desplaza hacia la izquierda para disminuir la tensión del ion OH– adicional. Se forma Mg(OH)2 hasta que el cociente de reacción sea igual a Ksp. En el nuevo equilibrio, [OH–] es mayor y [Mg2+] es menor que en la solución de Mg(OH)2 en el agua pura. Hay más Mg(OH)2 sólido presente.
(c) La concentración de OH– se reduce cuando el OH– reacciona con el ácido. La reacción se desplaza hacia la derecha para disminuir del estrés de causado por la disminución de los iones de OH–. En términos cuantitativos, la disminución de la concentración de OH– hace que el cociente de la reacción sea menor que el producto de solubilidad (Q <Ksp), y el Mg(OH)2 adicional se disuelve hasta que el cociente de la reacción sea igual a Ksp. En el nuevo equilibrio, [OH–] es menor y [Mg2+] es mayor que en la solución de Mg(OH)2 en el agua pura. Se disuelve más Mg(OH)2.
(d) El NaNO3 no contiene ninguna de las especies involucradas en el equilibrio, por eso esperar que no tenga un efecto apreciable en las concentraciones de Mg2+ y OH–. (Como hemos visto anteriormente, las sales disueltas cambian las actividades de los iones de un electrolito. Sin embargo, el efecto de la sal es generalmente pequeña y descuidaremos los pequeños errores que pueden resultar).
(e) La adición de Mg(OH)2 sólido no tiene ningún efecto sobre la solubilidad del Mg(OH)2 o sobre la concentración de Mg2+ y OH–. La concentración de Mg(OH)2 no aparece en la ecuación para el cociente de la reacción:
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber\]
Por tanto, cambiando la cantidad del hidróxido de magnesio sólido en la mezcla no tiene ningún efecto sobre el valor de Q, y no se requiere ningún cambio para restaurar Q al valor de la constante de equilibrio.
Ejercicio \(\PageIndex{3}\)
¿Cuál es el efecto sobre la cantidad de NiCO3 sólido que se disuelve y las concentraciones de Ni2+ y \(\ce{CO3^2-}\) cuando cada uno de los siguientes se agrega a una mezcla de NiCO3 sólido que es un poco soluble y el agua en equilibrio?
- Ni(NO3)2
- KClO4
- NiCO3
- K2CO3
- HNO3 (reacciona con el carbonato para producir \(\ce{HCO3-}\) o H2O y CO2)
- Respuesta a
-
la masa de \(\ce{NiCO3(s)}\) aumenta, \([\ce{Ni^{2+}}]\) aumenta, \(\ce{[CO3^2- ]}\) disminuye
- Respuesta b
-
ningún efecto
- Respuesta c
-
ningún efecto excepto para aumentar la cantidad del sólido \(\ce{NiCO3}\)
- Respuesta d
-
la masa de \(\ce{NiCO3(s)}\) aumenta, \([\ce{Ni^{2+}}]\) disminuye, \(\ce{[CO3^2- ]}\) aumenta
- Respuesta e
-
la masa de \(\ce{NiCO3(s)}\) disminuye, \([\ce{Ni^{2+}}]\)aumenta, \(\ce{[CO3^2- ]}\) disminuye
Resumen
Varios sistemas que encontramos consisten en equilibrios múltiples, sistemas donde dos o más procesos de equilibrio ocurren simultáneamente. Algunos ejemplos comunes incluyen la lluvia ácida, la fluoración y la disolución del dióxido de carbono en el agua de mar. Al observar estos sistemas, debemos considerar cada equilibrio separadamente y luego combinar las constantes de equilibrio individuales en un producto de solubilidad o expresión de cociente de reacción utilizando las herramientas del primer capítulo de equilibrio. El principio de Le Chatelier también se debe tomar en cuenta, ya que cada reacción en un sistema de equilibrio múltiple cambiará hacia reactivos o productos en función de lo que se agrega a la reacción inicial y cómo afecta a cada reacción de equilibrio subsecuente.
Glosario
- equilibrios múltiples
- sistema caracterizado por más de un estado de equilibrio entre un sólido iónico un poco soluble y una solución acuosa de iones que trabajan simultáneamente
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


