17.5: Batteries and Fuel Cells
- Page ID
- 1947
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Clasifique las baterías como primarias o secundarias
- Liste algunas de las características y las limitaciones de las baterías
- Proporcionar una descripción general de una pila combustible
Una batería es una celda electroquímica o una serie de celdas que produce una corriente eléctrica. En principio, cualquier celda galvánica se puede usar como una batería. Una batería ideal nunca se agotaría, produciría un voltaje invariable y sería capaz de soportar condiciones ambientales extremas de calor y humedad. Las baterías reales crean un equilibrio entre las características ideales y las limitaciones prácticas. Por ejemplo, la masa de la batería de un automóvil es de aproximadamente 18 kg o aproximadamente el 1% de la masa de un automóvil o camión liviano promedio. Este tipo de batería proporcionaría energía casi ilimitada si se usara en un teléfono inteligente, pero no se podría usar para esta aplicación debido a su masa. Por lo tanto, ninguna batería es la "mejor" y las baterías se seleccionan para una aplicación en particular, teniendo en cuenta aspectos como la masa de la batería, su costo, confiabilidad y capacidad actual. Hay dos tipos básicos de baterías: primaria y secundaria. Después, se describen algunas baterías de cada tipo.
Visite este sitio para aprender mas sobre las baterías.
Baterías primarias
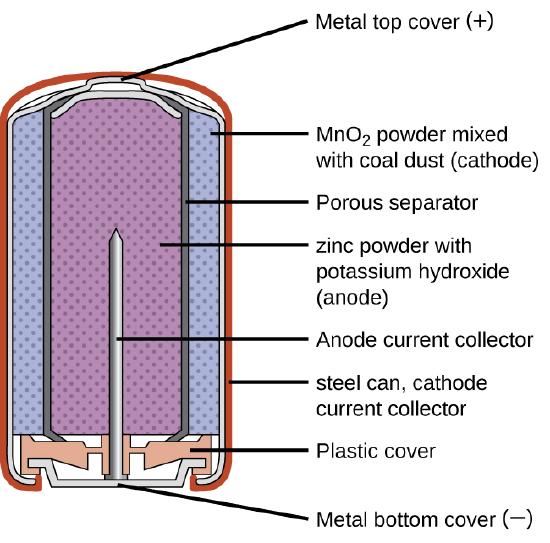
Las baterías primarias son baterías de un solo uso porque no se pueden recargar. Una batería primaria común es la celda seca (Figura \(\PageIndex{1}\)). La celda seca es una batería de zinc-carbono. La lata de zinc sirve como un recipiente y como el electrodo negativo. El electrodo positivo es una varilla de carbono rodeada por una pasta de óxido de manganeso (IV), cloruro de zinc, cloruro de amonio, polvo de carbono y una pequeña cantidad de agua. La reacción en el ánodo se puede representar como la oxidación ordinaria del zinc:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \hspace{20px} E^\circ_{\ce{Zn^2+/Zn}}=\mathrm{−0.7618\: V}\]
La reacción en el cátodo es más complicada, esto es porque ocurre más de una reacción. La serie de reacciones que ocurren en el cátodo es aproximadamente
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-}\]
La reacción general de la batería de zinc-carbono se puede representar como
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-}\]
con un potencial de celda general que inicialmente es de aproximadamente 1.5 V, pero disminuye a medida que se usa la batería. Es importante recordar que el voltaje liberado por una batería es el mismo independientemente del tamaño de la batería. Por esta razón, las baterías D, C, A, AA y AAA tienen el mismo voltaje nominal. Sin embargo, las baterías más grandes pueden liberar más moles de electrones. A medida que el contenedor de zinc se oxida, su contenido eventualmente se escapa, por eso este tipo de batería no se debe dejar en ningún dispositivo eléctrico durante períodos prolongados.

Las pilas alcalinas (Figura \(\PageIndex{2}\)) se desarrollaron en la década de 1950 en parte para abordar algunos de los problemas de funcionamiento de las pilas secas de zinc-carbono. Están fabricadas para reemplazar exactamente las pilas secas de zinc-carbono. Como sugiere su nombre, este tipo de baterías usan electrolitos alcalinos, a veces el hidróxido de potasio. Las reacciones son
\[\begin{align*} &\textrm{anode: }\ce{Zn}(s)+\ce{2OH-}(aq)⟶\ce{ZnO}(s)+\ce{H2O}(l)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−1.28\: V}\\ &\underline{\textrm{cathode: }\ce{2MnO2}(s)+\ce{H2O}(l)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2OH-}(aq) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{+0.15\: V}}\\ &\textrm{overall: }\ce{Zn}(s)+\ce{2MnO2}(s)⟶\ce{ZnO}(s)+\ce{Mn2O3}(s) \hspace{40px} E^\circ_\ce{cell}=\mathrm{+1.43\: V} \end{align*}\]
Una batería alcalina puede liberar entre tres y cinco veces la energía de una celda seca de zinc-carbono de tamaño similar. Las pilas alcalinas son propensas a perder el hidróxido de potasio, por eso también deben retirarse de los dispositivos para su almacenamiento a largo plazo. Mientras algunas pilas alcalinas son recargables, la mayoría no lo son. Los intentos de recargar una batería alcalina que no es recargable a veces provocan la rotura de la batería y la fuga del electrolito de hidróxido de potasio.
Baterías secundarias
Las baterías secundarias son recargables. Estos son los tipos de baterías que se encuentran en los dispositivos como los teléfonos inteligentes, las tabletas electrónicas y los automóviles.
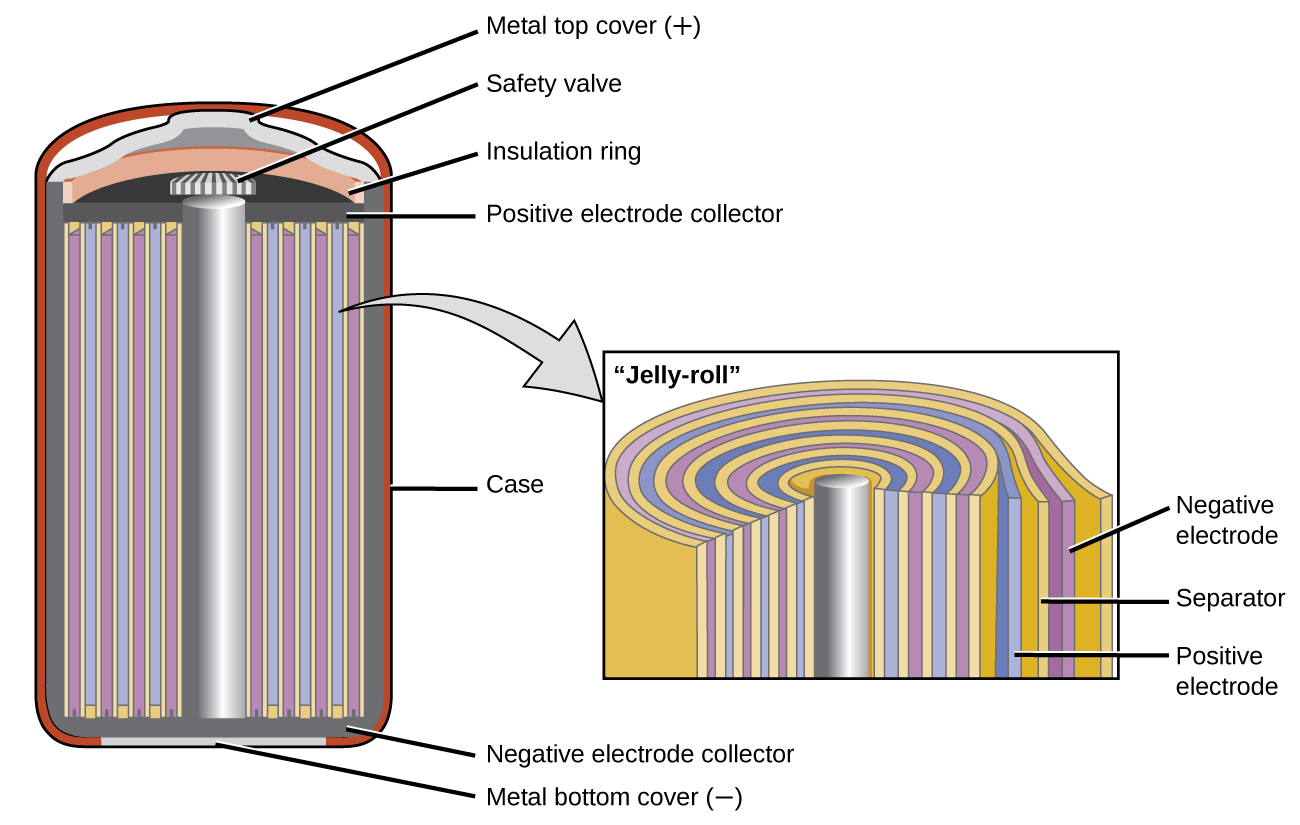
Las baterías de níquel-cadmio o NiCd (Figura \(\PageIndex{3}\)) consisten de un cátodo niquelado, un ánodo cubierto de cadmio y un electrodo de hidróxido de potasio. Las placas positivas y negativas, que el separador evita que se produzcan cortocircuitos, se enrollan juntas y se colocan en la caja. Este es un diseño de “rollo de gelatina” y permite que la celda de NiCd suministre mucha más corriente que una batería alcalina de tamaño similar. Las reacciones son
\[\begin{align*}
&\textrm{anode: }\ce{Cd}(s)+\ce{2OH-}(aq)⟶\ce{Cd(OH)2}(s)+\ce{2e-}\\
&\underline{\textrm{cathode: }\ce{NiO2}(s)+\ce{2H2O}(l)+\ce{2e-}⟶\ce{Ni(OH)2}(s)+\ce{2OH-}(aq)}\\
&\textrm{overall: }\ce{Cd}(s)+\ce{NiO2}(s)+\ce{2H2O}(l)⟶\ce{Cd(OH)2}(s)+\ce{Ni(OH)2}(s) \end{align*}\]
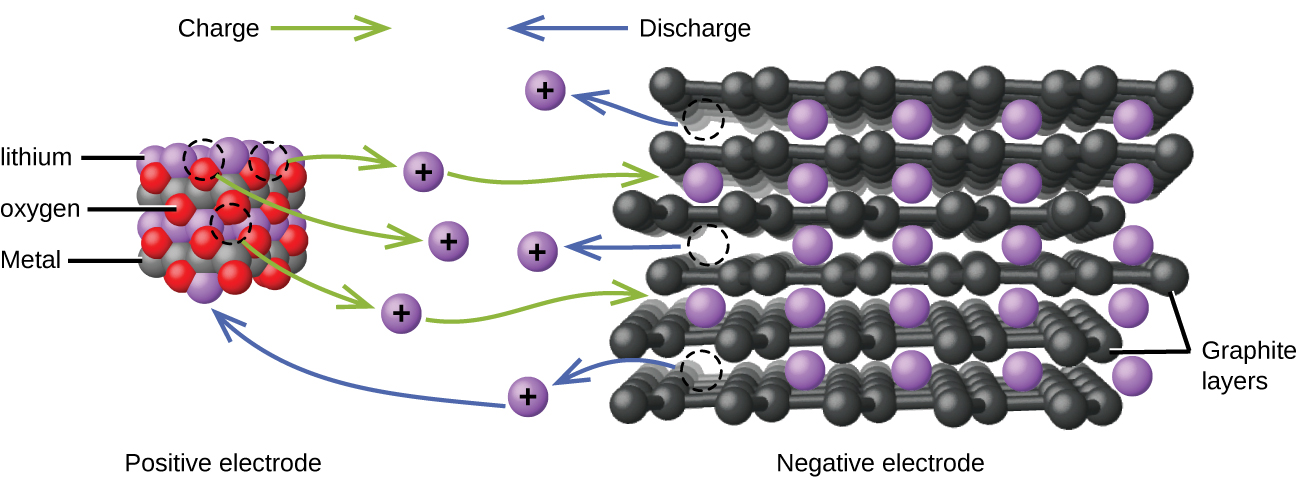
Las baterías de iones de litio (Figura \(\PageIndex{4}\)) se encuentran entre las baterías recargables más populares y se usan en muchos dispositivos electrónicos portátiles. Las reacciones son
\[\begin{align*} &\textrm{anode: }\ce{LiCoO2}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{Li+}+x\ce{e-}\\ &\textrm{cathode: }x\ce{Li+}+x\ce{e-}+x\ce{C6}⇌x\ce{LiC6}\\ &\overline{\textrm{overall: }\ce{LiCoO2}+x\ce{C6}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{LiC6}} \end{align*}\]
Con los coeficientes que representan moles, x no es más de aproximadamente 0.5 moles. El voltaje de la batería es de aproximadamente 3.7 V. Las baterías de litio son populares porque pueden proporcionar una gran cantidad de corriente, son más livianas que las baterías comparables de otros tipos, producen un voltaje casi constante a medida que se descargan y solo pierden su carga lentamente cuando se almacenan.
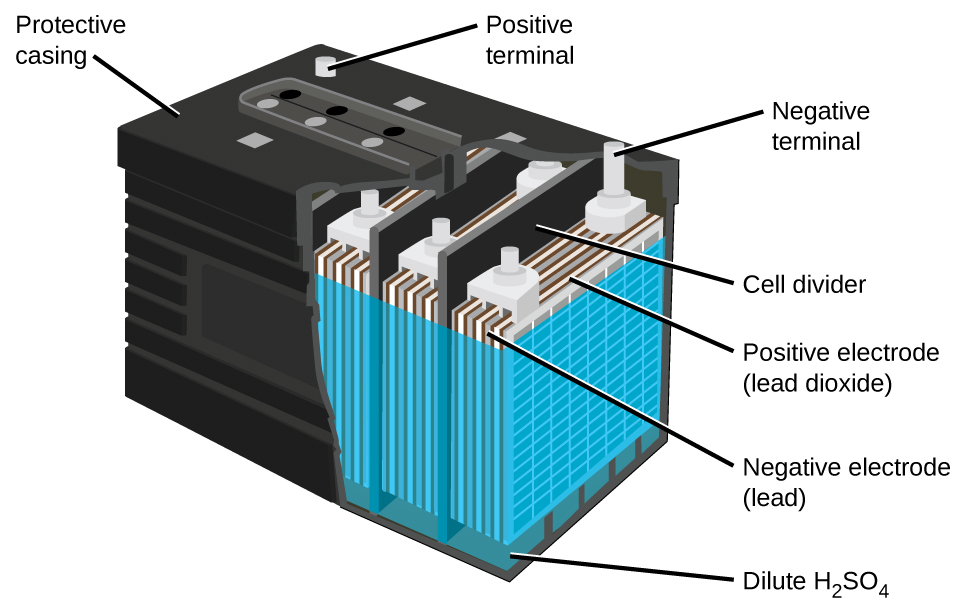
La batería de plomo y ácido (Figura \(\PageIndex{5}\)) es el tipo de batería secundaria que se usa en un automóvil. Es económico y capaz de producir la alta corriente requerida por los motores de arranque en los automóviles. Las reacciones de una batería de plomo y ácido son
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*}\]
Cada celda produce 2 V, por eso seis celdas están conectadas en serie para producir una batería de automóvil de 12 V. Las baterías de plomo y ácido son pesadas y contienen un electrolito líquido cáustico, pero a veces siguen siendo la batería de elección debido a su alta densidad de corriente. Ya que estas baterías contienen una cantidad significativa de plomo, siempre deben desecharse correctamente.
Pilas de combustible
Una pila de combustible es un dispositivo que convierte la energía química en energía eléctrica. Las pilas de combustible son similares a las baterías, pero requieren una fuente continua de combustible, a veces es el hidrógeno. Continuarán produciendo electricidad mientras haya combustible disponible. Las pilas de combustible de hidrógeno se han usado para suministrar energía a satélites, cápsulas espaciales, automóviles, barcos y submarinos (Figura \(\PageIndex{6}\)).
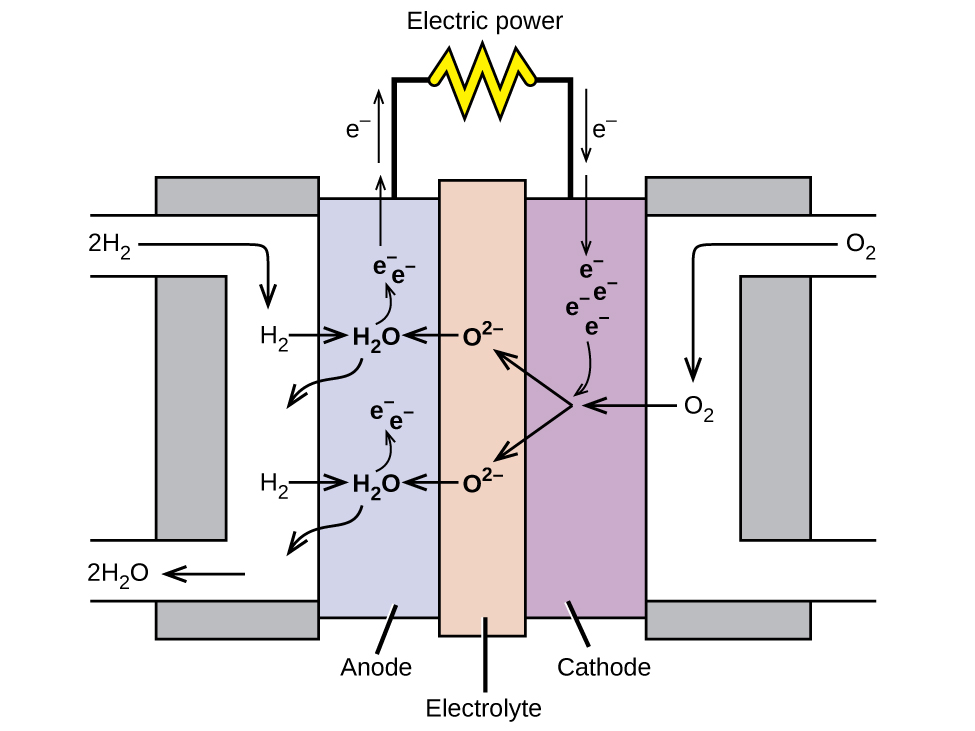
En una pila de combustible de hidrógeno, las reacciones son
\[\begin{align*}
&\textrm{anode: }\ce{2H2 + 2O^2- ⟶ 2H2O + 4e-}\\
&\underline{\textrm{cathode: }\ce{O2 + 4e- ⟶ 2O^2-}\hspace{55px}}\\
&\textrm{overall: }\ce{2H2 + O2 ⟶ 2H2O} \end{align*}\]
El voltaje es de aproximadamente 0.9 V. La eficiencia de las pilas de combustible es típicamente de aproximadamente 40% a 60%, que es más alta que el típico motor de combustión interna (25% a 35%) y, en el caso de la pila de combustible de hidrógeno, produce solo agua como un escape. Actualmente, las pilas de combustible son bastante caras y contienen características que las hacen fallar después de un tiempo relativamente corto.
Resumen
Las baterías son celdas galvánicas, o una serie de celdas, que producen una corriente eléctrica. Cuando las celdas se combinan en baterías, el potencial de la batería es un múltiplo entero del potencial de una sola celda. Hay dos tipos básicos de baterías: primaria y secundaria. Las baterías primarias son de "un solo uso" y no se pueden recargar. Las pilas secas y (la mayoría) de las pilas alcalinas son ejemplos de pilas primarias. El segundo tipo es recargable y se llama una batería secundaria. Los ejemplos de baterías secundarias incluyen baterías de níquel-cadmio (NiCd), plomo y ácido e iones de litio. Las pilas de combustible son similares a las baterías porque también generan una corriente eléctrica, pero requieren la adición continua de combustible y oxidante. La celda de combustible de hidrógeno usa el hidrógeno y el oxígeno del aire para producir el agua y generalmente es más eficiente que los motores de combustión interna.
Glosario
- pila alcalina
- batería primaria que usa un electrolito alcalino (a veces el hidróxido de potasio); diseñado para ser un reemplazo exacto de la celda seca, pero con más almacenamiento de energía y menos fugas de electrolitos que la celda seca típica
- batería
- celda galvánica o serie de celdas que produce una corriente; en teoría, cualquier celda galvánica
- pila seca
- batería primaria, también llamada una batería de zinc-carbono; se puede usar en cualquier orientación porque usa un electrolito como una pasta; tiende a perder electrolitos cuando se almacena
- pila de combustible
- dispositivos que producen una corriente eléctrica siempre que se agreguen continuamente el combustible y el oxidante; más eficiente que los motores de combustión interna
- batería de plomo y ácido
- batería secundaria que consiste de múltiples celdas; la batería de plomo y ácido que se encuentra en los automóviles tiene seis celdas y un voltaje de 12 V
- batería de iones de litio
- batería secundaria muy popular; usa iones de litio para conducir la corriente y es ligero, recargable y produce un potencial casi constante aunque se descargue
- batería de níquel-cadmio
- (Batería de NiCd) batería secundaria que usa el cadmio, que es un metal pesado tóxico; más pesado que las baterías de iones de litio, pero con características de funcionamento similares
- batería primaria
- batería de un solo uso no recargable
- batería secundaria
- batería que se puede recargar
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


