17.7: La electrolisis
- Page ID
- 1949
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Describir las celdas electrolíticas y su relación con las celdas galvánicas.
- Hacer varios cálculos relacionados con la electrólisis
En las celdas galvánicas, la energía química se convierte en energía eléctrica. Lo contrario es cierto para las celdas electrolíticas. En las células electrolíticas, la energía eléctrica hace que se produzcan reacciones no espontáneas en un proceso conocido como la electrólisis. La batería de carga eléctrica muestra uno de esos procesos. La energía eléctrica se convierte en energía química en la batería cuando se carga. Una vez cargada, la batería se puede usar para darle energía al automóvil. Los mismos principios están involucrados en las celdas electrolíticas que en las celdas galvánicas. Veremos tres celdas electrolíticas y los aspectos cuantitativos de la electrólisis.
La electrólisis del cloruro de sodio fundido
En el cloruro de sodio fundido, los iones pueden migrar libremente a los electrodos de una celda electrolítica. En la Figura \(\PageIndex{1}\) se muestra un diagrama simplificado de la celda usada comercialmente para producir el sodio metálico y el cloro gaseoso. El sodio es un agente reductor fuerte y el cloro se usa para purificar el agua y se usa en antisépticos y en la producción de papel. Las reacciones son
\[\begin{align}
&\textrm{anode: }\ce{2Cl-}(l) ⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px}E^\circ_{\ce{Cl2/Cl-}}=\mathrm{+1.3\: V}\\
&\textrm{cathode: }\ce{Na+}(l)+\ce{e-} ⟶\ce{Na}(l) \hspace{20px}E^\circ_{\ce{Na+/Na}}=\mathrm{−2.7\: V}\\
& \overline{\textrm{overall: } \ce{2Na+}(l)+\ce{2Cl-}(l) ⟶\ce{2Na}(l)+\ce{Cl2}(g) \hspace{20px}E^\circ_\ce{cell}=\mathrm{−4.0\: V}}
\end{align}\]
La fuente de alimentación (batería) debe suministrar un mínimo de 4 V, pero, en la práctica, los voltajes aplicados normalmente son más altos debido a ineficiencias en el proceso.

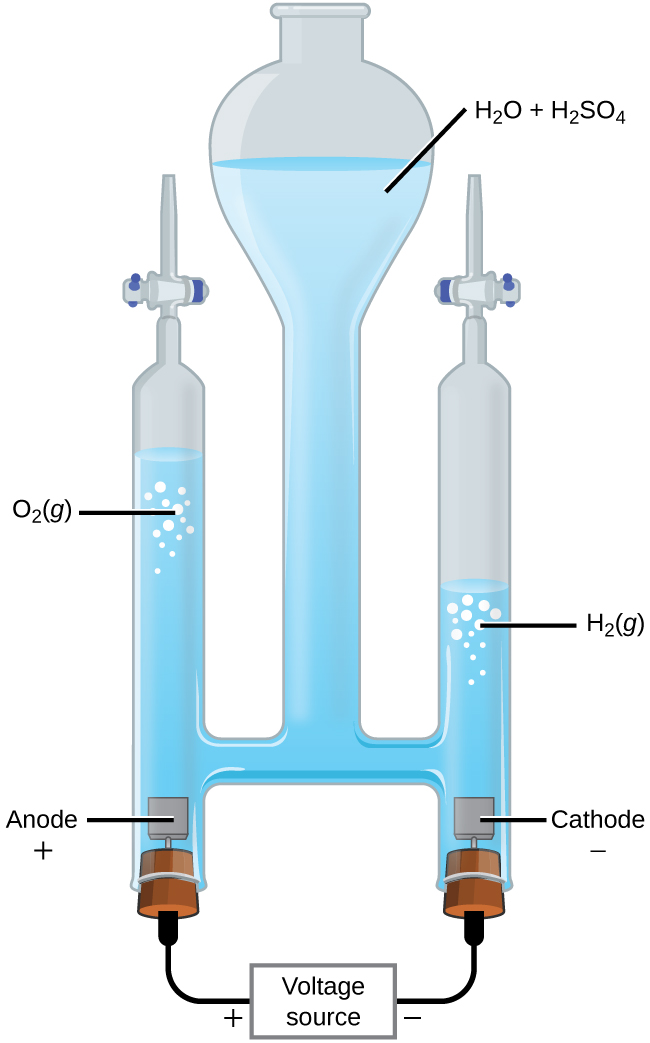
La electrólisis del agua
Es posible dividir el agua en hidrógeno y oxígeno gaseoso por la electrólisis. Los ácidos se agregan típicamente para aumentar la concentración de los iones de hidrógeno en la solución (Figura \(\PageIndex{2}\)). Las reacciones son
&\textrm{anode: }\ce{2H2O}(l)⟶\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-} \hspace{20px} E^\circ_\ce{anode}=\mathrm{+1.229\: V}\\
&\textrm{cathode: }\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g) \hspace{20px} E^\circ_\ce{cathode}=\mathrm{0\: V}\\
&\overline{\textrm{overall: }\ce{2H2O}(l)⟶\ce{2H2}(g)+\ce{O2}(g) \hspace{20px} E^\circ_\ce{cell}=\mathrm{−1.229\: V}}
\end{align}\]
Tenga en cuenta que el ácido sulfúrico no se usa y que el volumen de gas hidrógeno producido es el doble del volumen de gas oxígeno producido. El voltaje mínimo aplicado es 1.229 V.
La electrólisis del cloruro de sodio acuoso
La electrólisis de cloruro de sodio acuoso es el ejemplo más común de la electrólisis porque más de una especie se puede oxidar y reducir. Considerando el ánodo primero, las posibles reacciones son
&\textrm{(i) }\ce{2Cl-}(aq)⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px} E^\circ_\ce{anode}=\mathrm{+1.35827\: V}\\
&\textrm{(ii) }\ce{2H2O}(l)⟶\ce{O2}(g)+\ce{4H+}(aq)+\ce{4e-} \hspace{20px} E^\circ_\ce{anode}=\mathrm{+1.229\: V}
\end{align}\]
Estos valores sugieren que el agua se debe oxidar en el ánodo porque se necesitaría un potencial más pequeño; el uso de la reacción (ii) para la oxidación daría un potencial de celda menos negativo. Cuando se hace el experimento, resulta que se produce cloro, no oxígeno, en el ánodo. El proceso inesperado es tan común en electroquímica que se le ha dado el nombre de sobrepotencial. El sobrepotencial es la diferencia entre el voltaje teórico de la celda y el voltaje real que es necesario para causar la electrólisis. Resulta que el sobrepotencial de oxígeno es bastante alto y hace que el potencial de reducción sea más positivo. Como resultado, en condiciones normales, el gas cloro es lo que realmente se forma en el ánodo.
Ahora considere el cátodo. Pueden ocurrir tres reducciones:
&\textrm{(iii) }\ce{2H+}(aq)+\ce{2e-}⟶\ce{H2}(g) \hspace{20px} E^\circ_\ce{cathode}=\mathrm{0\: V}\\
&\textrm{(iv) }\ce{2H2O}(l)+\ce{2e-}⟶\ce{H2}(g)+\ce{2OH-}(aq) \hspace{20px} E^\circ_\ce{cathode}=\mathrm{−0.8277\:V}\\
&\textrm{(v) }\ce{Na+}(aq)+\ce{e-}⟶\ce{Na}(s) \hspace{20px} E^\circ_\ce{cathode}=\mathrm{−2.71\: V}
\end{align}\]
La reacción (v) se excluye porque tiene un potencial de reducción muy negativo. En condiciones de estado estándar, se preferiría la reacción (iii) a la reacción (iv). Sin embargo, el pH de una solución de cloruro de sodio es 7, por eso la concentración de iones de hidrógeno es solo 1 × 10−7 M. A concentraciones tan bajas, la reacción (iii) no es muy probable y ocurre la reacción (iv). La reacción general es entonces
A medida que avanza la reacción, los iones de hidróxido reemplazan a los iones de cloruro en la solución. Así, se puede obtener el hidróxido de sodio evaporando el agua una vez completada la electrólisis. El hidróxido de sodio es valioso y se usa para cosas como limpiador de hornos, abridor de desagües y en la producción de papel, telas y jabón.
Galvanoplastia
Un uso importante de las celdas electrolíticas es la galvanoplastia. La galvanoplastia resulta en una fina capa de un metal sobre una superficie conductora. Las razones para la galvanoplastia incluyen hacer que el objeto sea más resistente a la corrosión, fortalecer la superficie, producir un acabado más atractivo o purificar el metal. Los metales comúnmente usados en la galvanoplastia incluyen el cadmio, cromo, cobre, oro, níquel, plata y estaño. Los productos de consumo comunes incluyen vajillas plateadas o doradas, piezas de automóviles cromadas y las joyas. Podemos tener una idea de cómo funciona esto investigando cómo se produce la vajilla plateada (Figura \(\PageIndex{3}\)).

En la figura, el ánodo consiste en un electrodo de plata, que se muestra a la izquierda. El cátodo se encuentra a la derecha y es la cuchara, que está hecha de un metal económico. Ambos electrodos se sumergen en una solución de nitrato de plata. Cuando aumenta el potencial, la corriente fluye. El metal plateado se pierde en el ánodo cuando se disuelve.
\[\textrm{anode: }\ce{Ag}(s)⟶\ce{Ag+}(aq)+\ce{e-}\]
La masa del cátodo aumenta a medida que los iones de plata de la solución se depositan en la cuchara.
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\]
El resultado neto es la transferencia de metal plateado del ánodo al cátodo. La calidad del objeto suele estar determinada por el grosor de la plata depositada y la tasa de deposición.
Aspectos cuantitativos de la electrólisis
La cantidad de corriente que se permite fluir en una celda electrolítica está relacionada con el número de moles de electrones. El número de moles de electrones se puede relacionar con los reactivos y los productos usando la estequiometría. Recuerde que la unidad SI para la corriente (I) es el amperio (A), que es el equivalente a 1 culombio por segundo (1 A = \(\mathrm{1\:\dfrac{C}{s}}\)) . La carga total (Q, en culombios) está dada por
\[Q=I×t=n×F\]
donde
- t es el tiempo en segundos,
- n es el numero de moles de electrones y
- F es el constante de Faraday.
Los moles de electrones se pueden usar en los problemas de estequiometría. El tiempo requerido para depositar una cantidad especifica de metal se podría solicitar, como en el segundo de los siguientes ejemplos.
Ejemplo \(\PageIndex{1}\): Conversión de corriente a moles de electrones
En un proceso usado para la galvanoplastia de la plata, se pasó una corriente de 10.23 A a través de una celda electrolítica durante exactamente 1 hora. ¿Cuántos moles de electrones pasaron por la celda? ¿Qué masa de plata se depositó en el cátodo de la solución de nitrato de plata?
Solución
La constante de Faraday se puede usar para convertir la carga (Q) en moles de electrones (n). La carga es la corriente (I) multiplicada por el tiempo
\[n=\dfrac{Q}{F}=\mathrm{\dfrac{\dfrac{10.23\: C}{s}×1\: hr×\dfrac{60\: min}{hr}×\dfrac{60\:s}{min}}{96,485\: C/mol\: e^-}=\dfrac{36,830\: C}{96,485\: C/mol\:e^-}=0.3817\: mol\: e^-}\]
Del problema, la solución contiene AgNO3, por eso la reacción en el cátodo involucra 1 mol de electrones por cada mol de plata.
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s)\]
La masa atómica de la platea es 107.9 g/mol, entonces
\[\mathrm{mass\: Ag=0.3817\: mol\: e^-×\dfrac{1\: mol\: Ag}{1\: mol\: e^-}×\dfrac{107.9\: g\: Ag}{1\: mol\: Ag}=41.19\: g\: Ag}\]
Verifique su respuesta: De la estequiometría, 1 mol de electrones produciría 1 mol de plata. Se uso menos de medio mol de electrones y se produjo menos de medio mol de plata.
Ejercicio \(\PageIndex{1}\)
El metal de aluminio se puede hacer a partir de los iones de aluminio por la electrólisis. ¿Cuál es la semirreacción en el cátodo? ¿Qué masa de aluminio metálico se recuperaría si una corriente de 2.50 × 103 A pasara a través de la solución durante 15.0 minutos? Suponga que el rendimiento es 100%.
- Respuesta
-
\(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\); 7.77 mol Al = 210.0 g Al.
Ejemplo \(\PageIndex{2}\): Tiempo requerido para la deposición
En una aplicación, se debe depositar una capa de cromo de 0.010 mm en una pieza con una superficie total de 3.3 m2 a partir de una solución que contenga iones de cromo (III). ¿Cuánto tiempo tomaría para depositar la capa de cromo si la corriente es de 33.46 A? La densidad del cromo (metal) es de 7.19 g/cm3.
Solución
Este problema cubre varios temas discutidos antes. Un resumen de lo que se debe hacer es:
- Si se puede determinar la carga total, el tiempo requerido es solo la carga dividida por la corriente
- La carga total se puede obtener de la cantidad de Cr necesaria y la estequiometría
- La cantidad de Cr se puede obtener usando la densidad y el volumen de Cr requerido
- El volumen Cr requerido es el espesor multiplicado por el área
Resolviendo por pasos, y chequeando las unidades, el volumen de Cr requerido es
\[\mathrm{volume=\left(0.010\: mm×\dfrac{1\: cm}{10\: mm}\right)×\left(3.3\:m^2×\left(\dfrac{10,000\:cm^2}{1\:m^2}\right)\right)=33\: cm^3}\]
Se usaran centímetros cúbicos porque coinciden con la unidad de volumen usada para la densidad. La cantidad de Cr es entonces
\[\mathrm{mass=volume×density=33\cancel{cm^3}×\dfrac{7.19\: g}{\cancel{cm^3}}=237\: g\: Cr}\]
\[\mathrm{mol\: Cr=237\: g\: Cr×\dfrac{1\: mol\: Cr}{52.00\: g\: Cr}=4.56\: mol\: Cr}\]
Dado que la solución contiene iones de cromo (III), se requieren 3 moles de electrones por cada mol de Cr. La carga total es entonces
\[Q=\mathrm{4.56\: mol\: Cr×\dfrac{3\:mol\: e^-}{1\: mol\: Cr}×\dfrac{96485\: C}{mol\: e^-}=1.32×10^6\:C}\]
El tiempo requerido es entonces
\[t=\dfrac{Q}{I}=\mathrm{\dfrac{1.32×10^6\:C}{33.46\: C/s}=3.95×10^4\:s=11.0\: hr}\]
Verifique su respuesta: en un problema largo como este, una sola verificación probablemente no es suficiente. Cada uno de los pasos da un número razonable, por eso es probable que todo sea correcto. Preste atención especial a las conversiones de unidades y la estequiometría.
Ejercicio \(\PageIndex{2}\)
¿Qué masa de zinc se requiere para galvanizar la parte superior de una hoja de hierro de 3.00 m × 5.50 m hasta un espesor de 0.100 mm de zinc? Si el zinc proviene de una solución de Zn(NO3)2 y la corriente es de 25.5 A, ¿Cuánto tiempo tomará para galvanizar la parte superior del hierro? La densidad del zinc es de 7.140 g/cm3.
- Respuesta
-
231 g Zn requerido en 446 minutos.
Resumen
Usar electricidad para forzar a que ocurra un proceso no espontáneo es la electrólisis. Las celdas electrolíticas son celdas electroquímicas con potenciales de celda negativos (es decir, una energía libre de Gibbs positiva), por eso no son espontáneas. La electrólisis puede ocurrir en las celdas electrolíticas mediante la introducción de una fuente de alimentación, que suministra la energía para forzar a los electrones a fluir en una dirección no espontánea. La electrólisis ocurre en soluciones que contienen suficientes iones para que la corriente pueda fluir. Si la solución contiene solo un material, como la electrólisis del cloruro de sodio fundido, es una cuestión sencilla determinar qué se oxida y qué se reduce. En sistemas más complicados, como la electrólisis de cloruro de sodio acuoso, más de una especie se puede oxidar o reducir y los potenciales de reducción estándar se usan para determinar la oxidación más probable (la semirreacción con el potencial de reducción estándar más grande [más positivo] ) y reducción (la semirreacción con el potencial de reducción estándar más pequeño [menos positivo]). A veces, se producen semirreacciones inesperadas debido al sobrepotencial. El sobrepotencial es la diferencia entre el potencial teórico de reducción de la semirreacción y el voltaje real requerido. Cuando está presente, el potencial aplicado se debe aumentar, haciendo posible que ocurra una reacción diferente en la celda electrolítica. La carga total, Q, que pasa a través de una celda electrolítica se puede expresar como la corriente (I) multiplicada por el tiempo (Q = It) o como los moles de electrones (n) multiplicados por la constante de Faraday (Q = nF). Estas relaciones se pueden usar para determinar cosas como la cantidad de material usado o generado durante la electrólisis, cuánto tiempo debe continuar la reacción o qué valor de corriente se requiere.
Glosario
- electrólisis
- proceso que usa la energía eléctrica para causar un proceso no espontáneo
- celda electrolítica
- celda electroquímica en la que se usa la electrólisis; celda electroquímica con potenciales de celda negativos
- la galvanoplastia
- depositar una capa delgada de un metal sobre una superficie conductora
- sobrepotencial
- diferencia entre el potencial teórico y el potencial real en una celda electrolítica; el voltaje "extra" necesario para que se produzca una reacción electroquímica no espontánea
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


