3.4: Estereoisometría — quiralidad, estereocentros, enantiómeros
- Page ID
- 2326
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
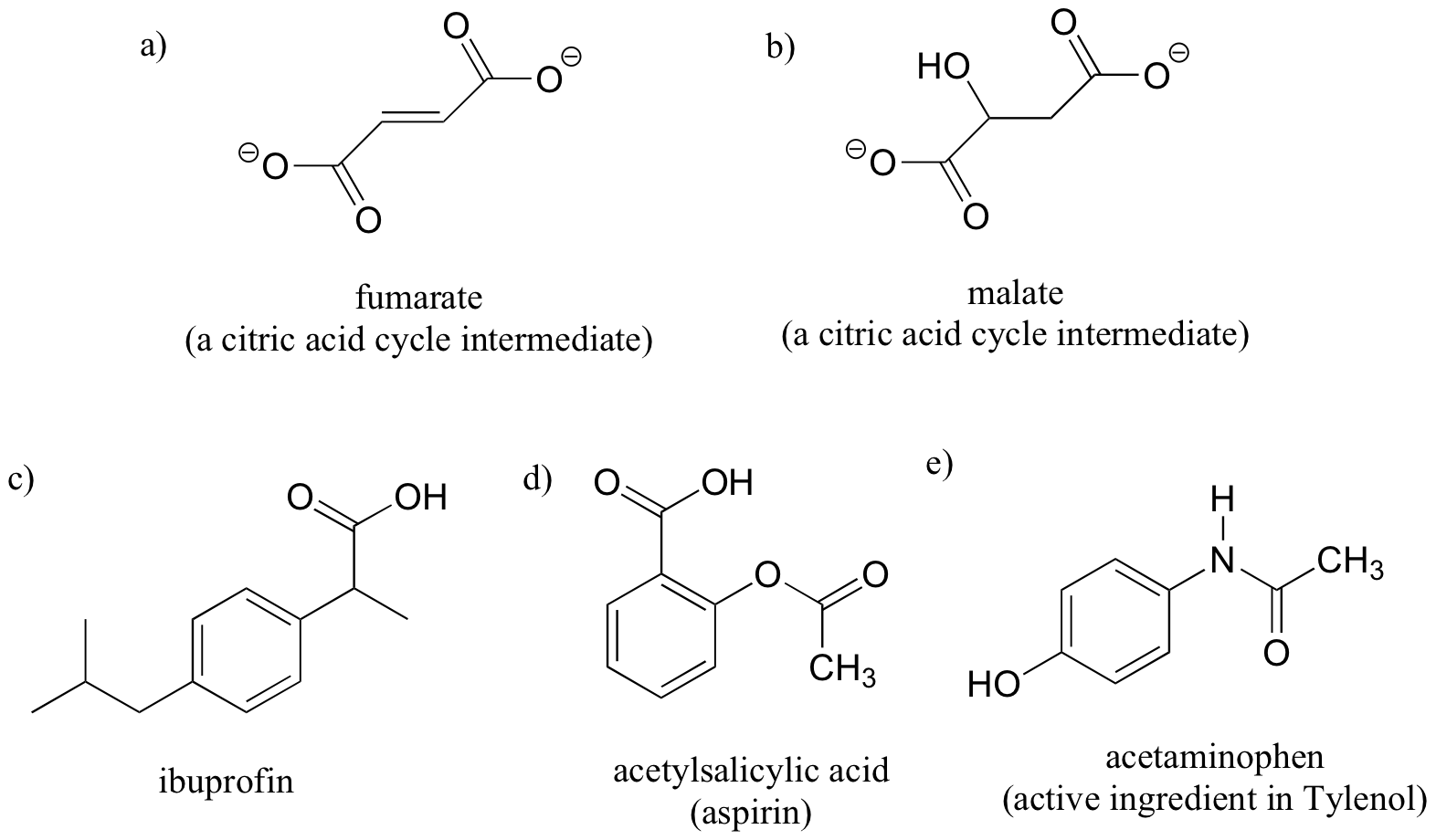
En la década de 1960, un medicamento llamado talidomida era ampliamente prescrito en la Europa occidental para aliviar las náuseas del embarazo en las mujeres embarazadas.
La talidomida previamente se había utilizado en otros países como un antidepresivo, y se creía ser segura y efectiva para ambos propósitos. La droga no fue aprobado para su uso en los EE.UU. No pasó mucho tiempo, sin embargo, antes de que los médicos se dieron cuenta de que algo había salido terriblemente mal: muchos bebés nacidos de mujeres que habían tomado talidomida durante el embarazo sufrieron de defectos de nacimiento graves.
Los investigadores se dieron cuenta más tarde de que el problema radica en el hecho de que se estaba prestando la talidomida como una mezcla de dos formas isoméricas diferentes.
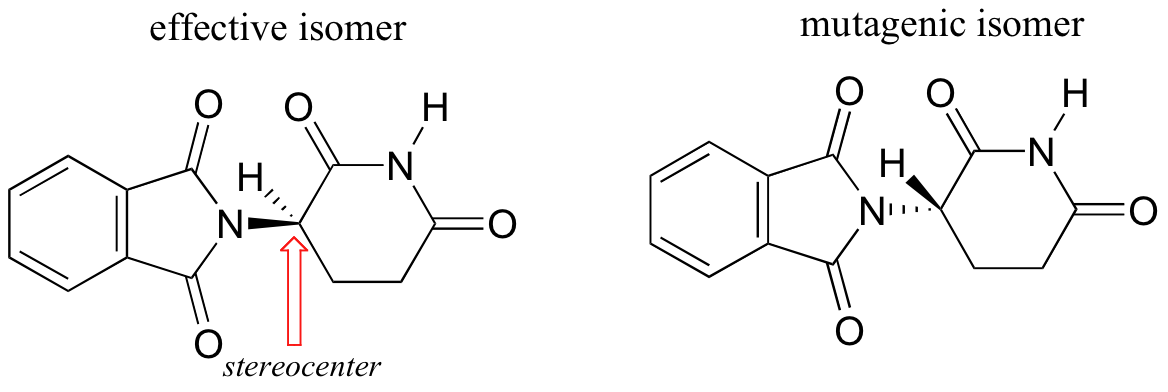
Uno de los isómeros era un medicamento eficaz, el otro causó los efectos secundarios. Ambas formas isómeras tienen la misma fórmula molecular y la misma conectividad de átomo a átomo, por lo que no son isómeros constitucionales. En lo que difieren es en la disposición en el espacio tridimensional sobre un carbono tetraédrico, sp3-hibridado. Estas dos formas de talidomida son estereoisómeros.
Tenga en cuenta que el carbono en cuestión tiene cuatro sustituyentes diferentes (dos de ellos resultan ser conectados por una estructura de anillo). Carbonos tetraédrica con cuatro grupos sustituyentes diferentes se llaman estereocentros.
Ejemplo 3.3.1
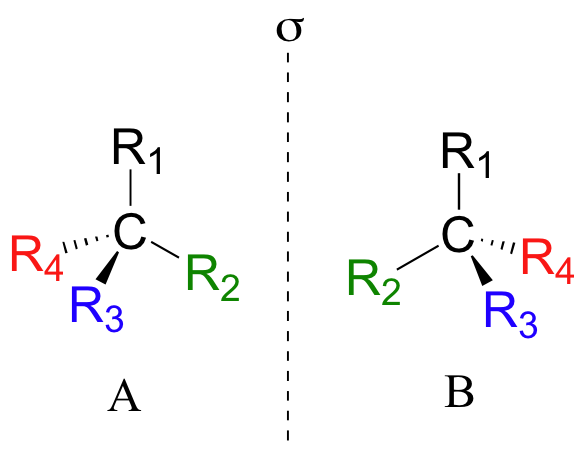
Si se fijan bien en la figura de arriba, te darás cuenta de que la molécula A y la molécula B son imágenes espejo entre sí (la línea denominada 's' representa un plano de simetría). Por otra parte, no son superponibles: si recogemos la molécula A, le damos la vuelta y la colocamos junto a la molécula B, vemos que las dos estructuras no se pueden superponer entre sí. Son diferentes moléculas!
Si usted hace los modelos de los dos estereoisómeros de la talidomida y haces lo mismo, verás que ellos también son imágenes de espejo, y no se pueden superponer (le ayudará mirar una versión en color de la figura de abajo).
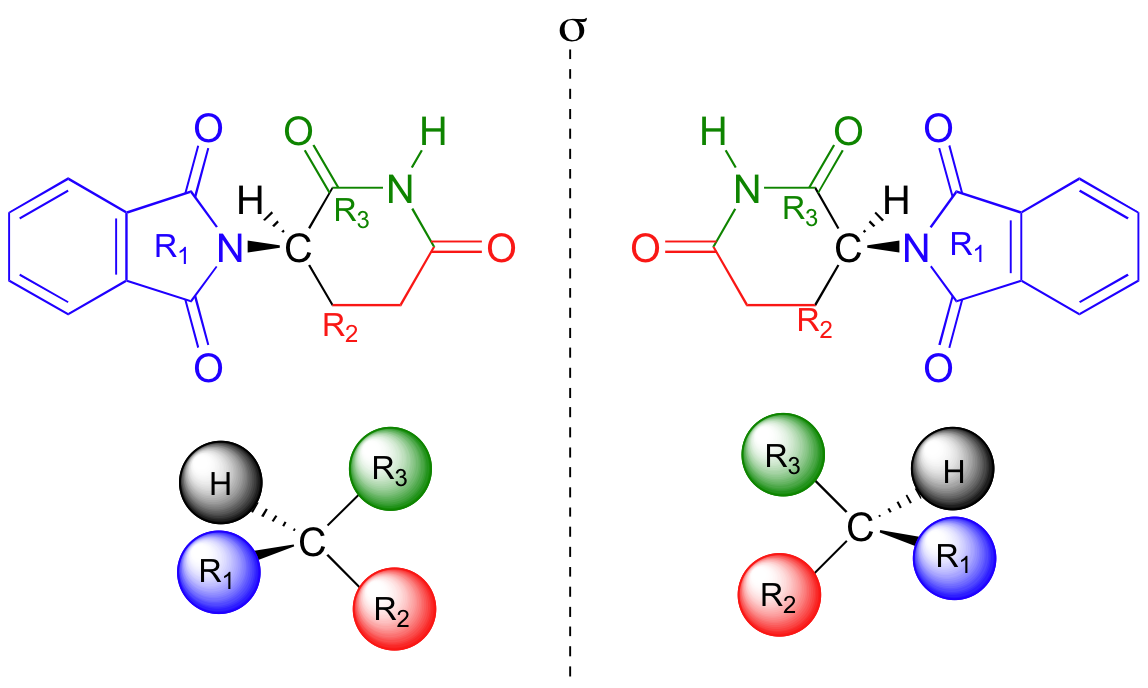
La talidomida es una molécula quiral. Algo se considera ser quiral si no se puede superponer sobre su propia imagen en el espejo - en otras palabras, si es asimétrica (falta en simetría). El término "quiral" se deriva de la palabra griega para 'prepotencia' - es decir diestro o zurdo. Sus manos son quirales: su mano derecha es un reflejo de la mano izquierda, pero si se coloca una mano encima de la otra, ambas palmas hacia abajo, se ve que no son superponibles.
Un par de estereoisómeros que son imágenes especulares no superponibles entre sí son consideradas de tiener un tipo específico de relación estereoisomérico - que son un par de enantiómeros. La talidomida existe como un par de enantiómeros. En el nivel macro, las manos izquierda y derecha son también un par de enantiómeros.
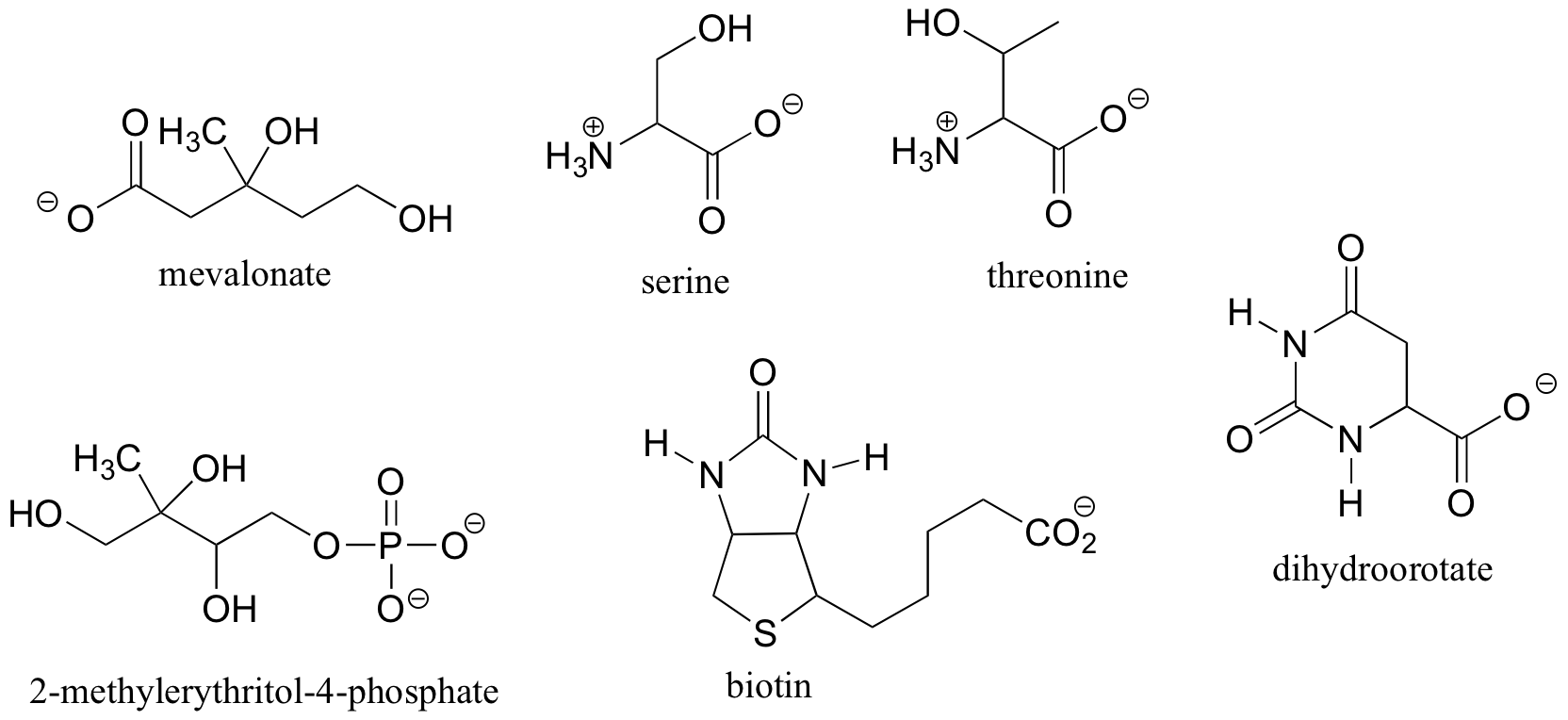
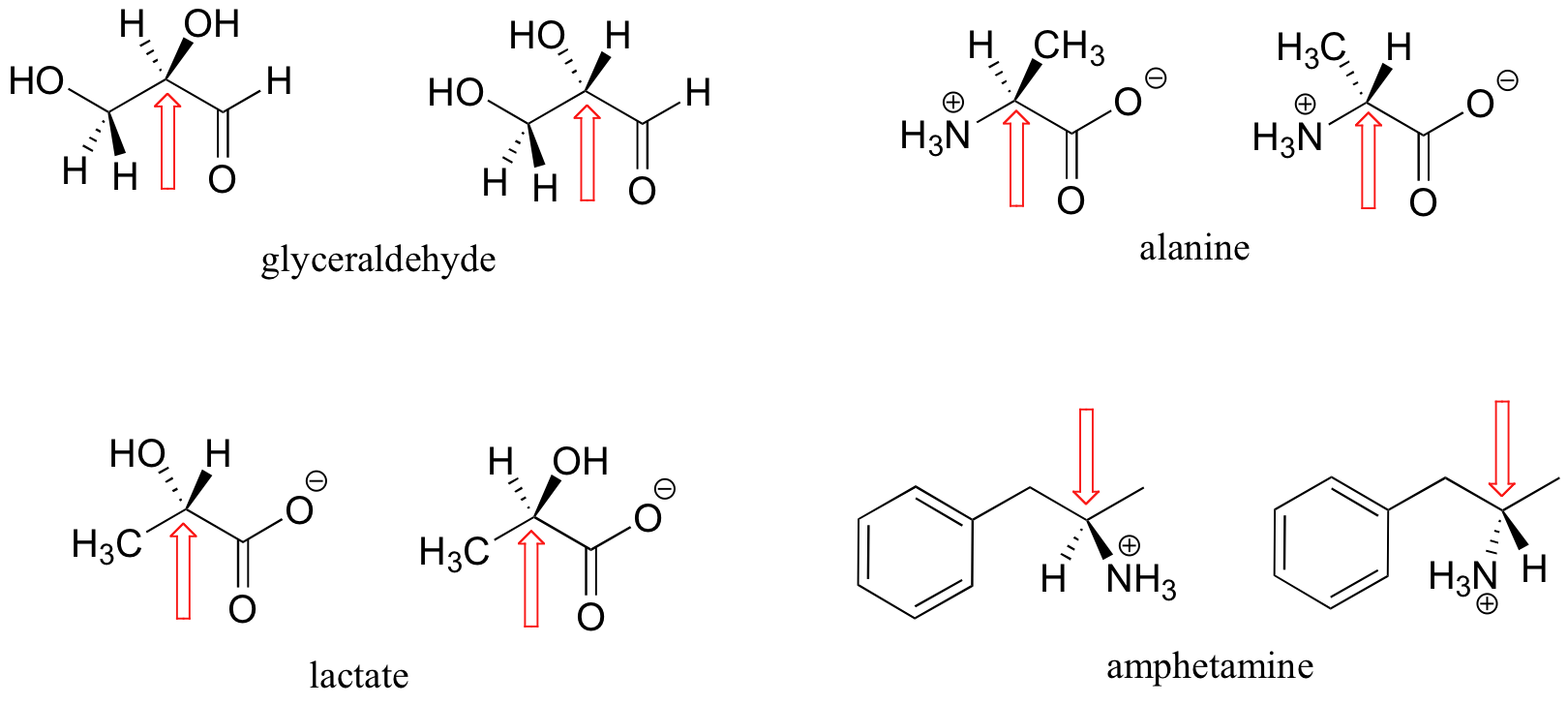
Aquí hay algunos ejemplos más de las moléculas quirales que existen como pares de enantiómeros. En cada uno de estos ejemplos, hay una sola estereocentro, se indica con una flecha. (Muchas moléculas tienen más de un estereocentro, pero vamos a llegar a eso un poco más tarde!)
Aquí están algunos ejemplos de moléculas que son aquiral (no quiral). Nótese que ninguna de estas moléculas tiene un estereocentro.
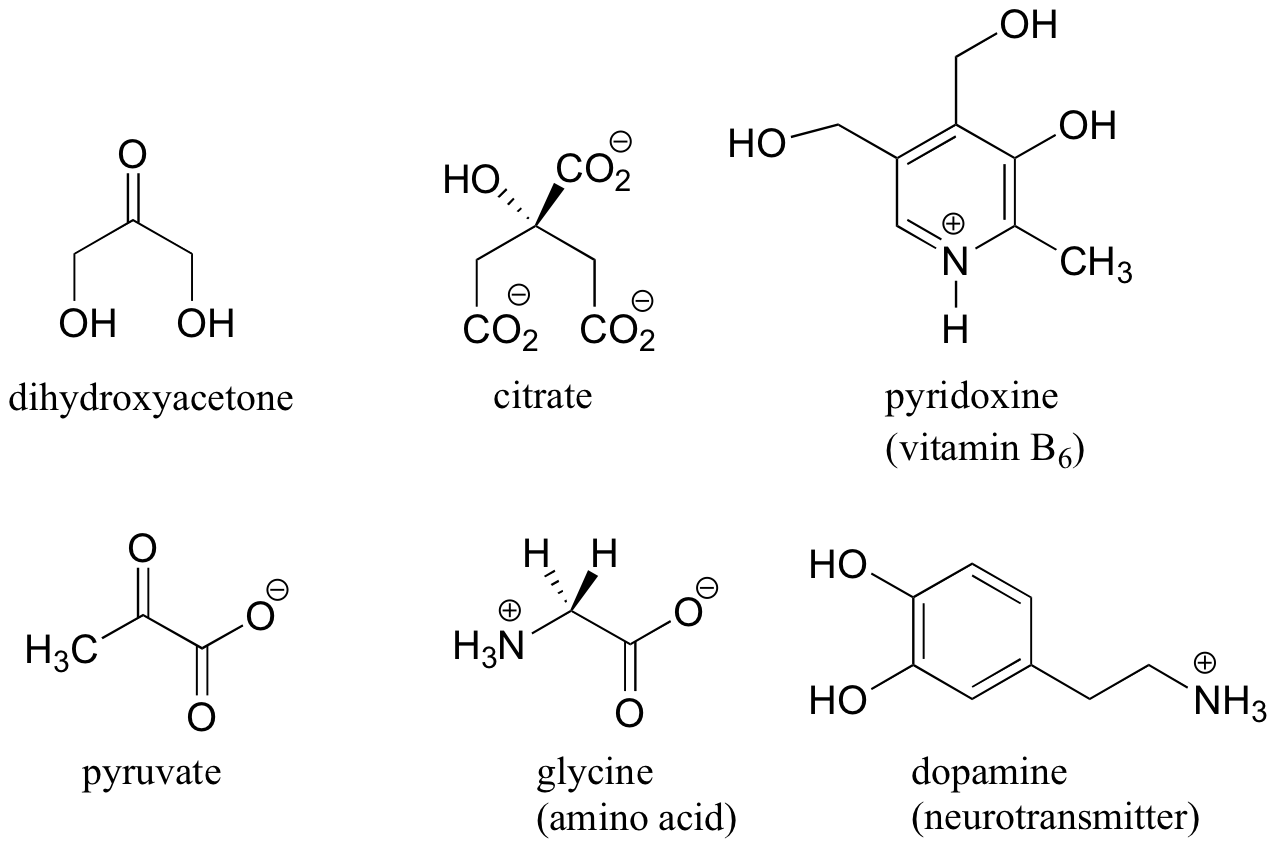
Es difícil de ilustrar sobre la página de dos dimensiones, pero usted verá si usted construye modelos de estas moléculas aquirales , en cada caso, hay al menos un plano de simetría, donde un lado del plano es la imagen reflejada de la otra. La quiralidad está ligado conceptualmente a la idea de asimetría, y cualquier molécula que tiene un plano de simetría no puede ser quiral. Al buscar un plano de simetría, sin embargo, debemos tener en cuenta todas las posibles conformaciones que una molécula puede adoptar. Incluso una molécula muy simple como etano, por ejemplo, es asimétrica en muchos de sus innumerables conformaciones posibles - pero tiene simetría evidente tanto en las conformaciones eclipsadas y escalonadas, y por esta razón es aquiral.
Buscando planos de simetría en una molécula es útil, pero a menudo difícil en la práctica. En la mayoría de casos, la manera más fácil de decidir si una molécula es quiral o aquirales es buscando uno o más estereocentros - con algunas raras excepciones (véase la sección 3.7B), la regla general es que las moléculas con al menos un estereocentro son quirales, y las moléculas sin estereocentros son aquirales. Estereocentros de carbono también se denominan con bastante frecuencia como carbonos quirales.
Al evaluar una molécula para quiralidad, es importante reconocer que la cuestión de si o no la convención de dibujo de cuña discontinua / sólido se utiliza es irrelevante. Las moléculas quirales a veces son dibujadas sin utilizar cuñas (aunque, obviamente, esto significa que la información estereoquímica está siendo omitida). Por el contrario, las cuñas se pueden utilizar en los carbonos que no son estereocentros - vean, por ejemplo, a los dibujos de glicina y citrato en la figura anterior. Sólo porque usted ve cuñas punteadas y sólidas en una estructura, no asuma automáticamente que usted está mirando un estereocentro.
Otros elementos además de carbono pueden ser estereocentros. El centro fósforo de ion fosfato y ésteres de fosfato orgánico, por ejemplo, es tetraédrica, y por lo tanto potencialmente es un estereocentro.

Veremos en el capítulo 10 cómo los investigadores, con el fin de investigar la estereoquímica de las reacciones en el centro de fosfato, incorporaron azufre y / o 17O y 18O isótopos de oxígeno (el isótopo "normal" es 16O) para crear grupos fosfato quirales. Triésteres de fosfato son quiral si los tres grupos sustituyentes son diferentes.
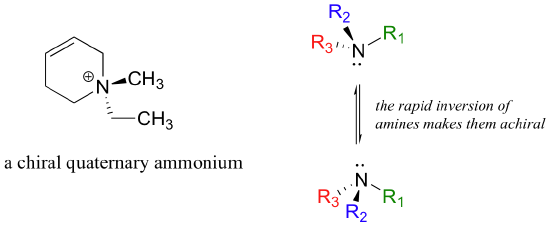
Grupos de amonio cuaternario asimétricas también son quirales. Aminas, sin embargo, no son quirales, porque rápidamente se invierten o se convierten 'adentro hacia afuera', a temperatura ambiente.
Ejemplo 3.3.2