10.1: Descripción general de la reacción de fosfato y la transferencia de fosforilo
- Page ID
- 2384
10.1A: Nomenclatura y siglas
Grupos fosforilo son derivados del ácido fosfórico, un ácido fuerte que se utiliza comúnmente en el laboratorio. La base conjugada totalmente desprotonado de ácido fosfórico se llama un ion fosfato o fosfato inorgánico (a menudo abreviado 'Pi'). Cuando dos grupos fosfato están unidos el uno al otro, el enlace se conoce como un "anhídrido fosfato ', y el ion se llama' pirofosfato inorgánico '(PPi abreviatura).
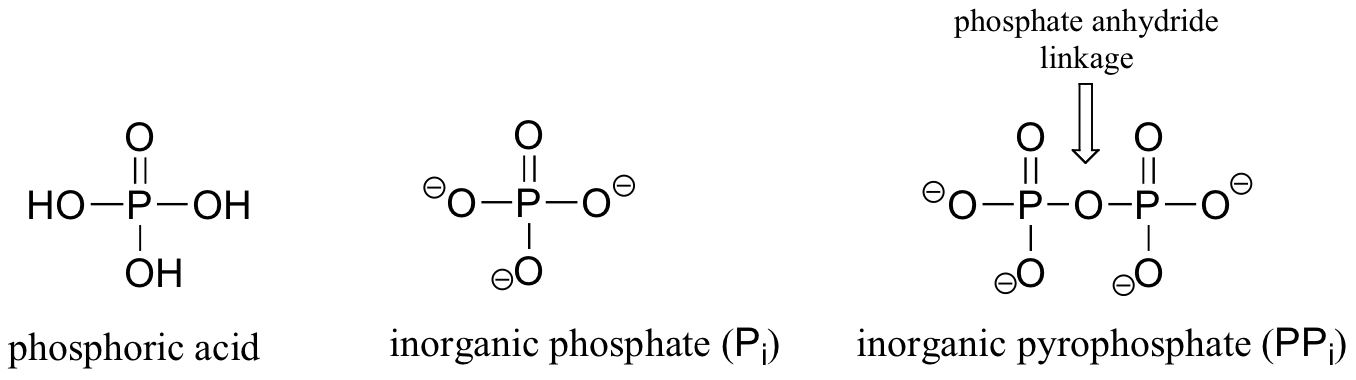
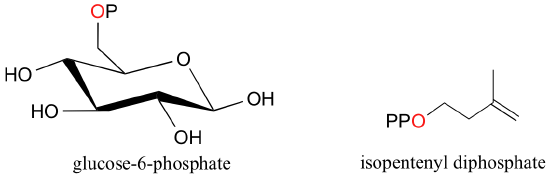
Cuando un ion fosfato está unido a un átomo de carbono en una molécula orgánica, el enlace químico se conoce como un éster de fosfato, y toda la especie se denomina monofosfato orgánica. Glucosa-6-fosfato es un ejemplo.
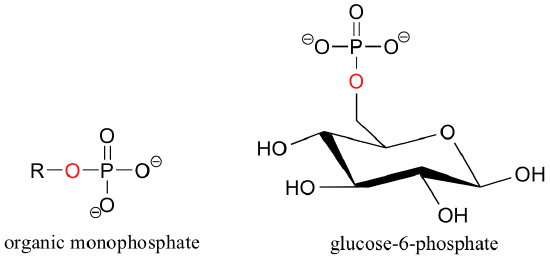
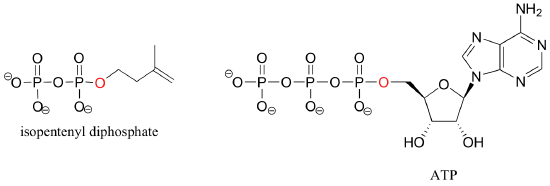
Si una molécula orgánica está ligada a dos o tres grupos fosfato, las especies resultantes se denominan difosfatos y trifosfatos orgánicos.

Isopentenyl difosfato y trifosfato de adenosina (ATP) son buenos ejemplos:
Átomos de oxígeno en grupos fosfato se conocen como 'puente' y 'no-puente', dependiendo de su posición. Un difosfato orgánica cuenta con dos puentes y cinco oxígenos no-puente.
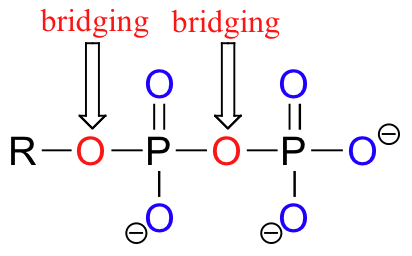
Cuando un solo fosfato está unido a dos grupos orgánicos, se utiliza el término 'diéster de fosfato'. La columna vertebral de ADN se compone de diésteres de fosfato.
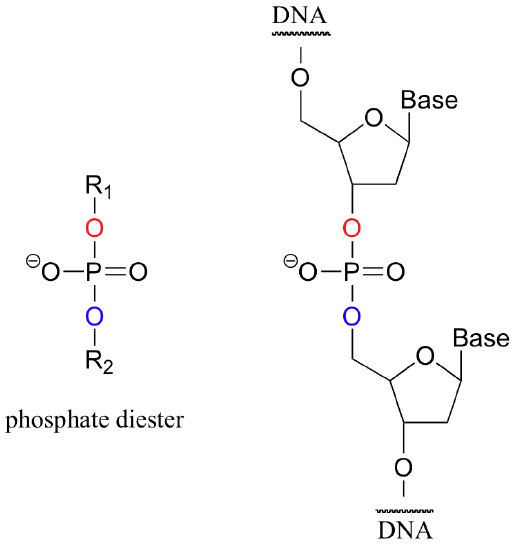
El término ‘grupo fosforilo’ es una forma general de referirse a todos los grupos basados en fosfatos mencionados en los párrafos anteriores.
Recuerde (Sección 1.4A) que los grupos de fosfato en las estructuras orgánicas a veces se abrevia simplemente como 'P', una convención que usaremos a lo largo de este texto. Por ejemplo, glucosa-6-fosfato y difosfato de isopentenilo son referidas como se muestra a continuación. Observe que la abreviatura "P" que incluye los átomos de oxígeno y cargas negativas asociadas con los grupos de fosfato.
10.1B: Ácido constantes y estados de protonación
El ácido fosfórico es triprótico, lo que significa que tiene tres hidrógenos ácidos disponibles para donar, con valores de pKa de 2.1, 7.2 y 12.3, respectivamente. Estos valores constantes de ácido nos dicen que, en el pH fisiológico de aproximadamente 7.3, todas las especies de ácido fosfórico en solución han donado al menos un protón, y más de la mitad han donado dos, lo que significa que la carga promedio de el ion fosfato es ligeramente mayor que -1.5. Monofosfatos, difosfatos, y trifosfatos orgánicos están desprotonados predominantemente a pH 7.3, lo que significa que llevan cargas de ligeramente menores que -2, -3, -4 y, respectivamente. Por convención, por lo general se dibujan en sus estados totalmente desprotonadas.
10.1C: Vinculación de fosfinas y fosfatos
Mirando a la ubicación de fosfato en la tabla periódica, se podría esperar que reaccione de una manera similar a nitrógeno, que se encuentra justo encima de ella en la quinta columna. De hecho, fosfinas - análogos de fósforo de aminas - se utilizan comúnmente en el laboratorio orgánico.
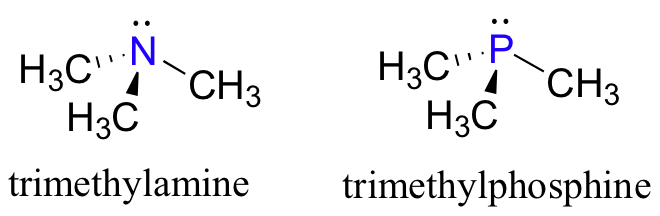
Al igual que en las aminas, el átomo central de fósforo en una fosfina hibrida sp3, con un par solitario de electrones ocupando una de los cuatro orbitas híbridas sp3. En el caso de fosfinas, sin embargo, las orbitas sp3 son híbridas de una sola orbita 3s y tres orbitas 3p, en lugar de orbitales 2s y 2p, como en aminas.

En las moléculas biológicas, de la forma más importante de fósforo no es fosfina, pero el grupo fosforilo. Los cuatro sustituyentes de oxígeno en los grupos fosforilo están distribuidos alrededor de el átomo central de fósforo con geometría tetraédrica, sin embargo, hay un total de cinco enlaces hacia el fósforo - cuatro enlaces sigma y un enlace pi deslocalizado. La razón por la que fósforo pueden romper la "regla del octeto” es que esta en la tercera fila de la tabla periódica, y por lo tanto ha orbitales d disponibles para la unión. En la imagen hibrida de orbitas para iones fosfato (PO4 3-), una sola 3s y tres orbitas 3p se combinan para formar cuatro orbitas híbridas sp3 con geometría tetraédrica. Cuatro de los cinco electrones cenefa en fósforo ocupan orbitas sp3, y el quinto ocupa una orbita d sin hibridar.
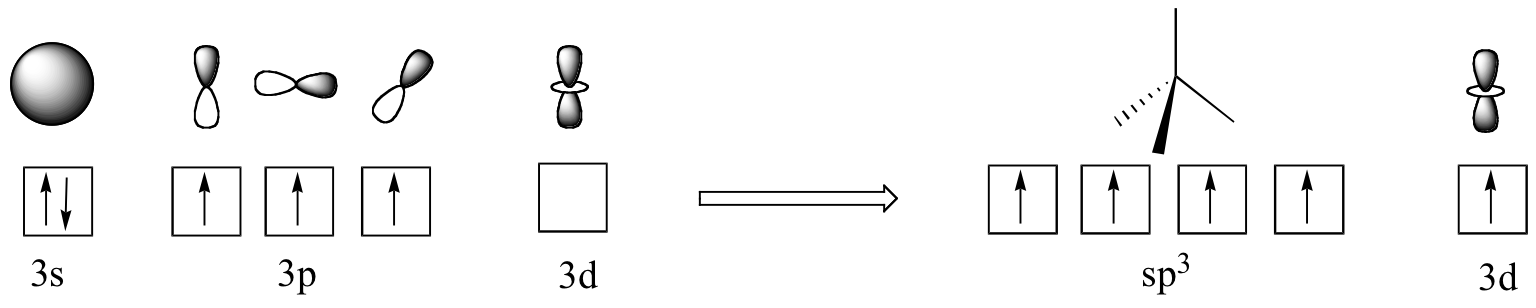
El fósforo es así capaz de formar cinco interacciones de unión, en lugar de tres como es fosfina. Las cuatro orbitas sp3 en fósforo son capases de superponerse con una orbita sp2 de un átomo de oxígeno (que forma un marco tetraédrico), mientras que un quinto enlace deslocalizado (un enlace pi) es formado lado-a-lado por solapamiento de la orbita d en fósforo con orbitas 2p en los oxígenos.
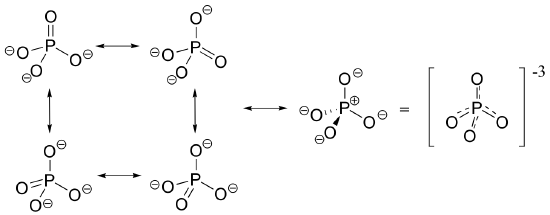
La -3 carga de un ion de fosfato totalmente desprotonado se distribuye uniformemente entre los cuatro oxígenos, y cada enlace fósforo-oxígeno puede ser considerada teniendo un poco de carácter de doble enlace.
En los ésteres de fosfato, ésteres y anhídridos el enlace pi está deslocalizado principalmente en los enlaces sin puente, mientras que los enlaces del puente tienen principalmente carácter de enlace sencillo. En un fosfodiéster, por ejemplo, los dos oxígenos sin puente comparten una carga -1, como se ilustra por los dos contribuyentes principales de resonancia. En los contribuyentes de resonancia en la que los puentes de oxígenos se muestran como enlaces dobles, existe una separación adicional de carga - por lo tanto estos contribuyentes son menores y hacen una contribución relativamente poco importante para el panorama general de unión.
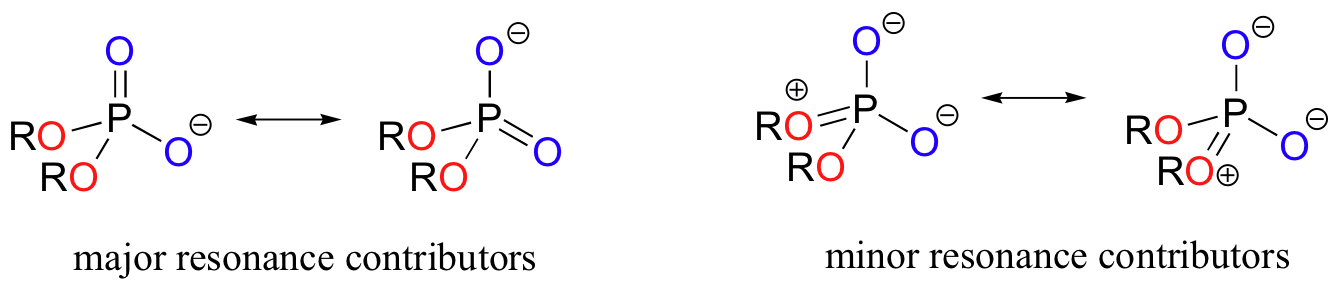

Ejercicio 10.1.1
Dibuja todas las estructuras de resonancia que muestran la deslocalización de la carga en un (totalmente desprotonado) monofosfato orgánico. Si un "orden de enlace" de 1.0 es un enlace sencillo, y un orden de enlace de 2.0 es un doble enlace, ¿cuál es el orden de enlace aproximado de enlaces puente y sin puente de P-O?
A lo largo de este capítulo, los grupos fosforilo suelen ser dibujados sin mostrar la geometría tetraédrica, y enlaces pi y las cargas negativas a menudo se muestran como localizado en una posición. Esto se hace para simplificar - sin embargo es importante recordar siempre que el grupo fosforilo es en realidad tetraédrica, y que los electrones pi están deslocalizados en los enlaces no-puente.
10.1D: Reacciones de transferencia de fosforilo - general
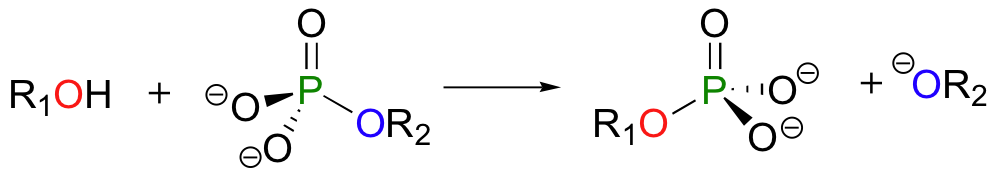
En una reacción de transferencia de fosforilo, un grupo fosforilo se transfiere de una molécula donante de fosforilo (designada 'R2' en la siguiente figura) a un grupo aceptor de fosforilo (designada 'R1'). La siguiente ilustración muestra la transferencia de un solo grupo de fosfato de R2 a R1:
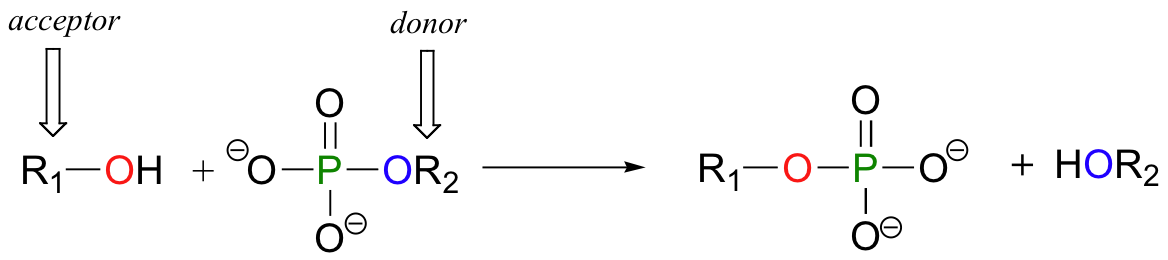
Un alcohol, por ejemplo, se puede transformar en un monofosfato orgánico mediante la aceptación de uno de los grupos de fosfato de ATP (aprenderemos más acerca de la ATP en breve).
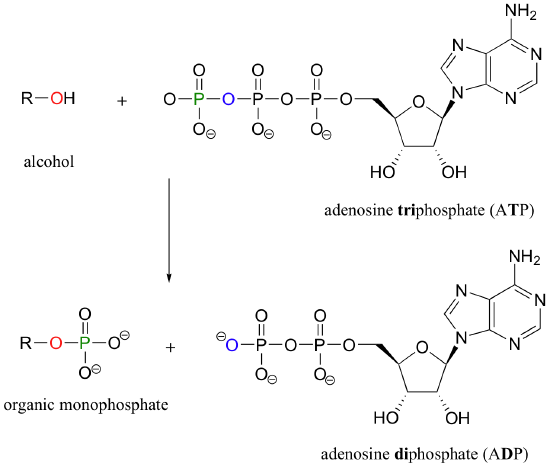
Un monofosfato orgánica se convierte de nuevo en un alcohol cuando su grupo de fosfato se transfiere a una molécula de agua:
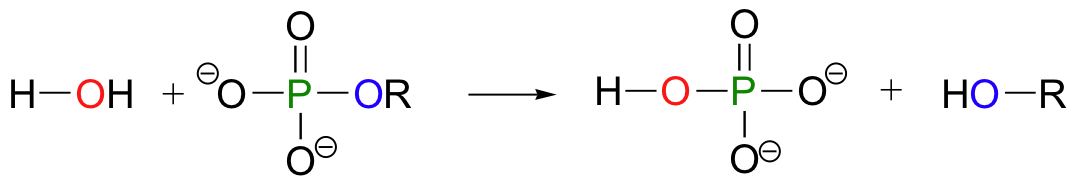
En el curso de este capítulo, veremos otros tipos de reacciones de transferencia de fosforilo, pero todas poden ser descritas esencialmente por el mismo mecanismo.
Veamos más de cerca el mecanismo de reacción de transferencia de fosforilo, utilizando como ejemplo la transferencia de un grupo fosfato de adenosina trifosfato (ATP) al grupo hidroxilo C6 de la glucosa, una reacción catalizada por quinasa glucosa.
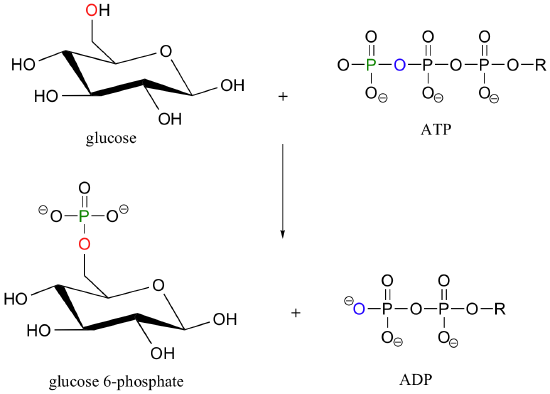
Para simplificar las cosas en la discusión mecanicista por venir, vamos a abreviar esta reacción como:
Un aspecto muy importante de las reacciones de transferencia de fosforilo biológicos es que la electrofilia del átomo de fósforo se ve reforzada por el ácido de Lewis (aceptor de electrones) efecto de un ion o mas de magnesio. Enzimas que catalizan la transferencia de fosforilo-unen iones Mg2 + de tal manera que puedan interactuar con oxígenos sin puente fosforilo sobre el sustrato.
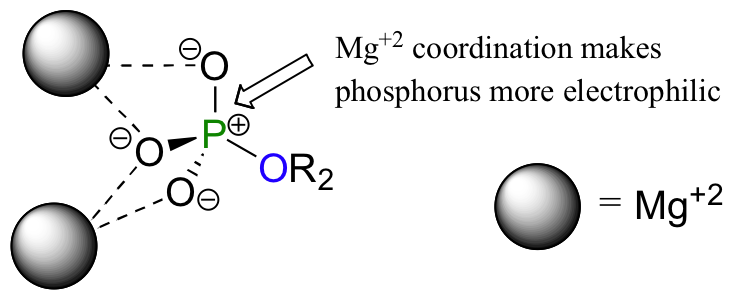
Los iones metálicos positivamente cargados estabilizan la carga negativa sobre los átomos de oxígeno, que tiene el efecto de aumentar el momento bipolar del enlace fósforo-oxígeno. Por lo tanto, el fósforo tiene una carga positiva parcial más grande, que hace que sea un mejor electrófilo.
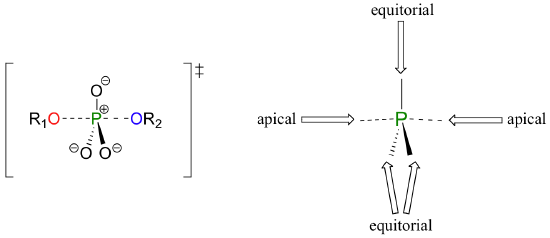
Una reacción de transferencia de fosforilo es muy parecido a una reacción SN2 en un carbon. Al igual que en una reacción SN2, el nucleófilo en una transferencia de fosforilo se acerca al centro electrófilo por la parte trasera, opuesto al grupo saliente. A medida que el nucleófilo se acerca y el grupo saliente comienza su salida, la geometría cambia en el átomo de fósforo de tetraédrico a bipiramidal trigonal, en el estado de transición. Como la ligadura de fósforo nucleófilo se acorta y el vínculo grupo fósforo se alarga, la imagen de unión alrededor del átomo de fósforo vuelve a su estado tetraédrico original, pero la configuración estereoquímica se ha volteado, o invertida.
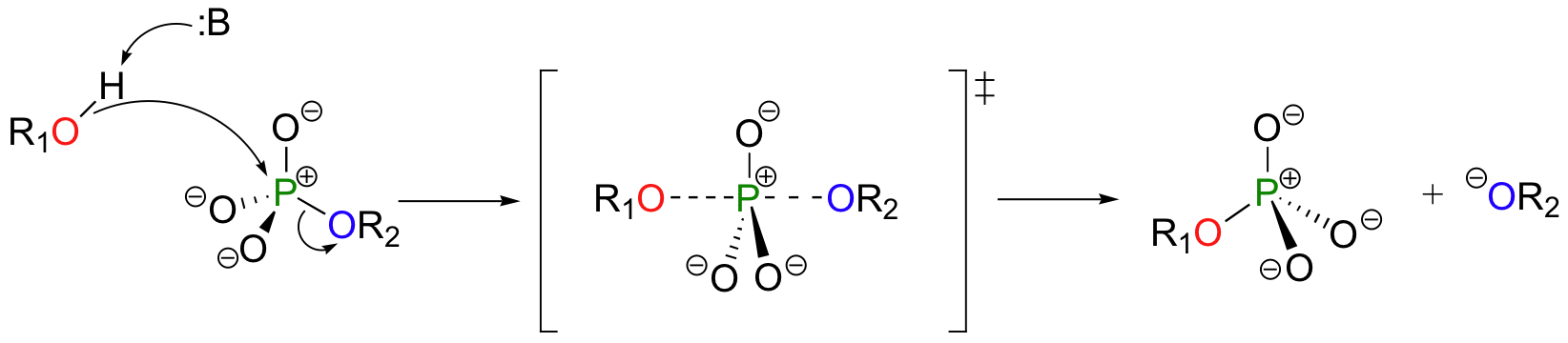
En el estado de transición bipiramidal trigonal, los cinco sustituyentes no son equivalentes: los tres oxígenos sin puente se dice están ecuatorial (que forma la base de un bipirámide trigonal), mientras que el nucleófilo y el grupo saliente se dice que son apical (ocupando el puntas de las dos pirámides).
Aunque la inversión estereoquímica en reacciones de transferencia de fosforilo es predicha por la teoría, el hecho de que los grupos fosforilo son aquirales hizo imposible observar el fenómeno directamente hasta 1978, cuando un grupo de investigadores fue capaz de sintetizar ésteres fosfatos orgánicos en los que los isotopos estables de oxigeno 17O y 18O se incorporaron específicamente. Esto creó un centro quiral fosfato.

Experimentos posteriores con enzimas catalizadores con transferencia-fosforilo confirmaron que estas reacciones tienen lugar con inversión estereoquímica. (Nature 1978 275, 564; Ann Rev Biochem 1980 49, 877).
10.1E: Reacciones de transferencia de fosforilo - ¿concertada, adición-eliminación, o disociativa?
En la discusión anterior, el mecanismo de reacción de transferencia de fosforilo se representa como un estado de transición SN2, con ambos enlaces apicales en algún estado acerca de romperse o formar en la parte superior de la ‘colina de energía’:
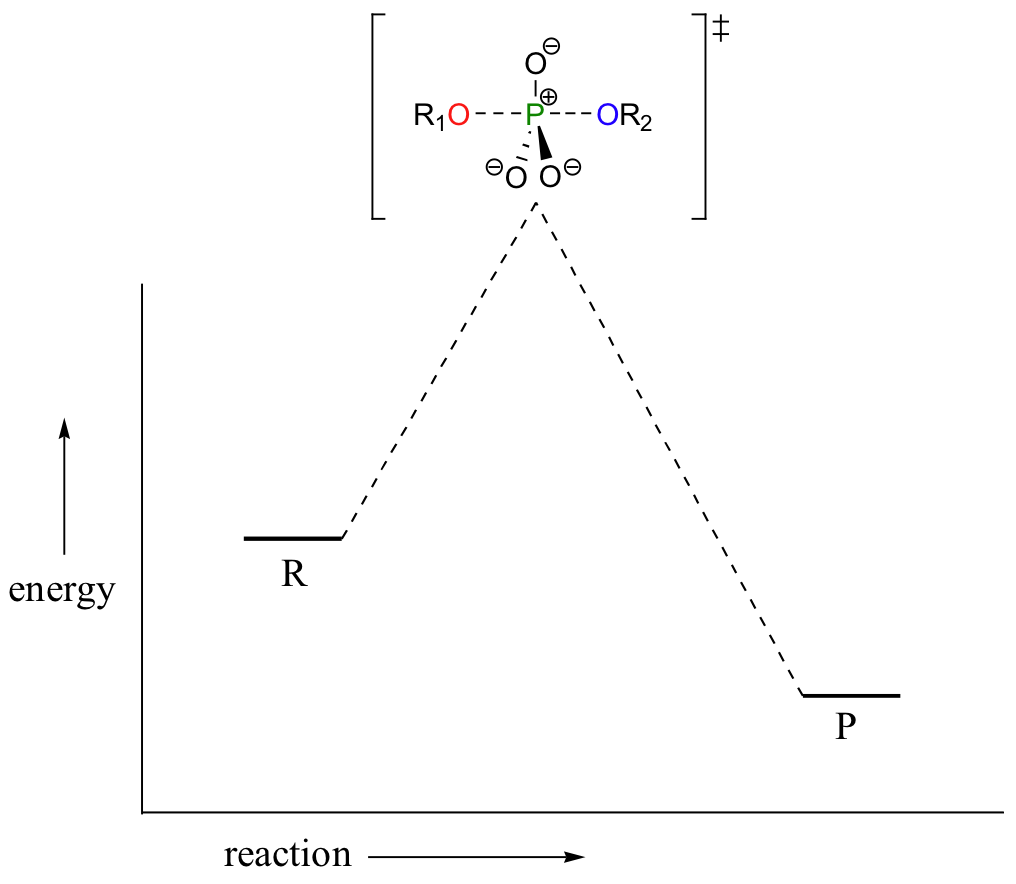
Este no es el único mecanismo que ha sido propuesto para estas reacciones - de hecho, otros dos posibles mecanismos han sido sugeridos.
En un modelo mecánico alterno de dos pasos, el nucleófilo puede atacar primero, formando una pentavalente, bipiramidal triangular intermedio, (comparado a un estado de transición pentavalente). La reacción se completa cuando el grupo saliente es expulsado. Las especies intermedias ocuparían un valle de energía entre los dos estados de transición.
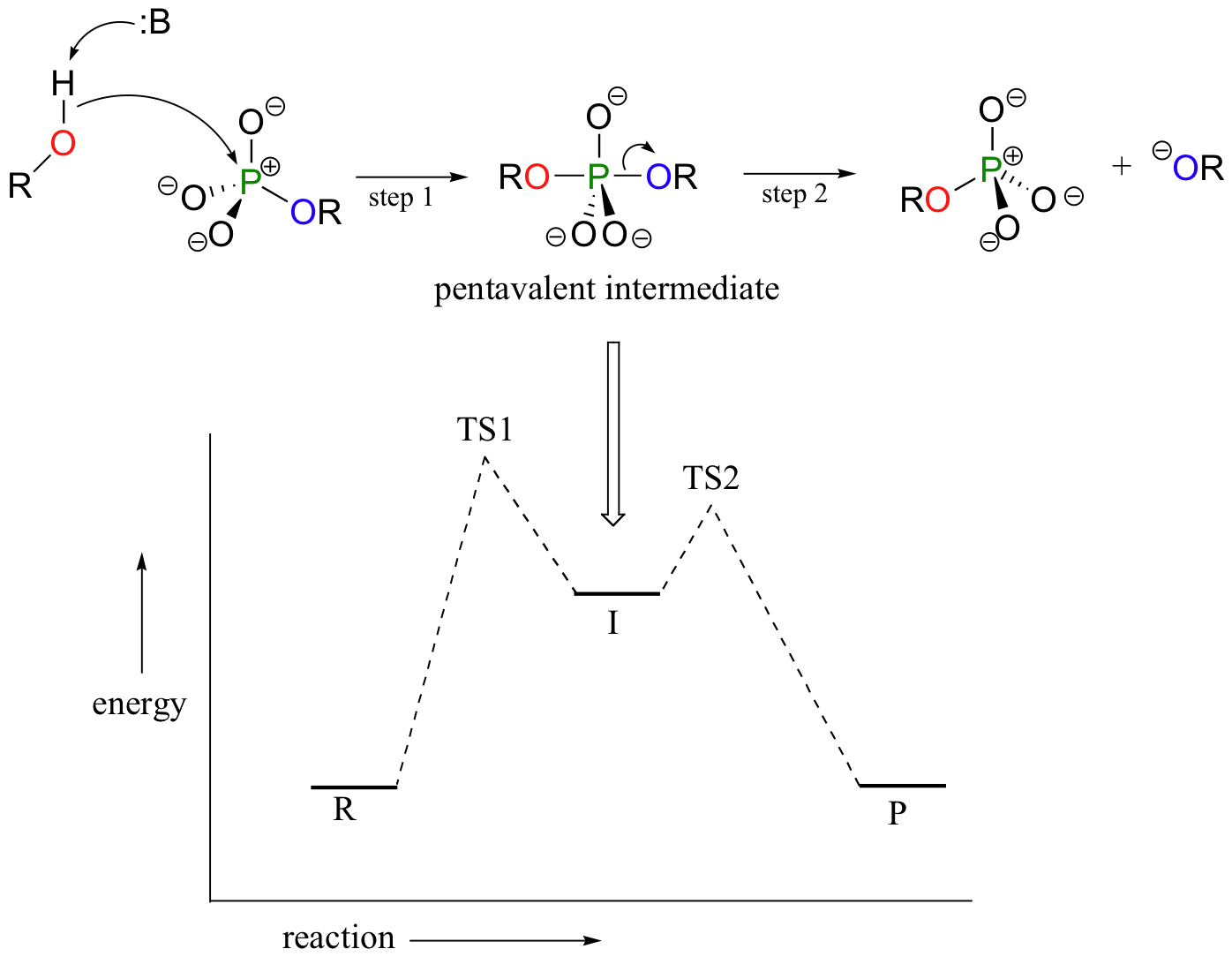
Esto es referido a menudo como un mecanismo de ‘adición-eliminación’- el nucleófilo se hade a el fosfato primer, formando un intermedio pentavalente, y despues el grupo saliente es eliminado.
Un intermedio pentavalente no es posible en una reacción SN2 en un centro de carbono, porque el carbono, como un elemento de la segunda fila, no tiene ninguna orbita d y no puede formar cinco conexiones. Fósforo, en cambio, es un elemento de la tercera fila y es capaz de formar más de cuatro enlaces. Pentacloruro de fósforo, después de todo, es un compuesto estable que tiene cinco enlaces a cloro en la geometría bipiramidal trigonal alrededor de el fósforo central.
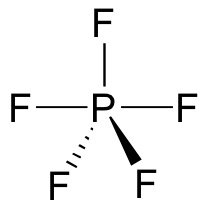
El átomo de fósforo en PCl5 (y en la hipotético intermedia pentavalente de arriba) se considera que sea sp3d hibridado:

Hay una tercera posibilidad: la reacción podría proceder de una manera disociativa, como SN1. En este modelo, la unión del grupo de fósforo se rompe primero, lo que resulta en un ‘metafosfato’ intermedio. Este intermedio, que corresponde a el carbocatión intermedio en una reacción SN1, es atacado por el nucleófilo para formar el producto final.
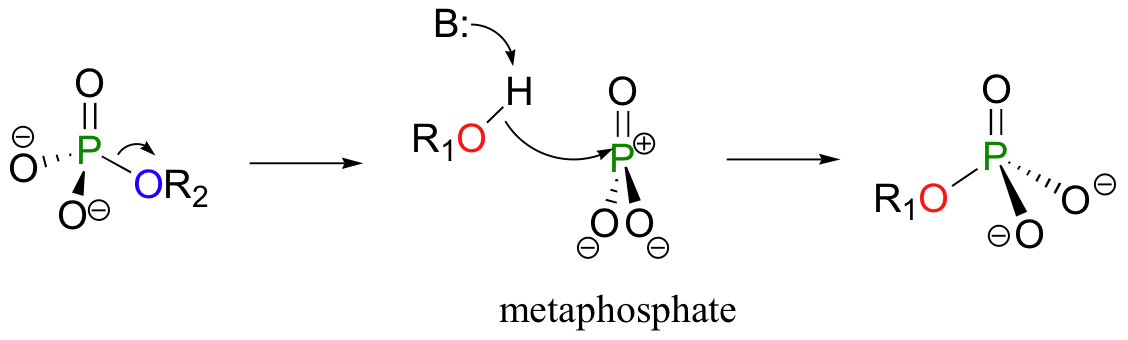
Entonces, ¿cuál es el mecanismo real para una reacción de transferencia de fosforilo - concertada, adición-eliminación, o disociativa? A los químicos les encanta investigar y discutir sobre cuestiones como esta! Al igual que el argumento SN1 / SN2 discutido en el capítulo anterior, realmente se reduce a una sola pregunta. ¿Qué sucede primero, formación de enlace o quebrantamiento – o estos dos eventos ocurren al mismo tiempo? A partir de la evidencia acumulada hasta la fecha, parece que las reacciones de transferencia de fosforilo enzimática pueden ocurrir por todos los tres mecanismos - y, a menudo en algún punto intermedio - dependiendo de la naturaleza del nucleófilo, electrófilo, y el grupo saliente, así como el sitio de actividad de el enzima que cataliza la reacción. Aunque se cree que muchas de las reacciones de transferencia de fosforilo, tanto enzimática y no enzimática, proceder con algún grado de carácter disociativo (como SN1), todavía no existe una comprensión clara de lo que sucede entre compuesto de inicio y el producto. Considerando la importancia de las reacciones de transferencia de fosforilo en las vías metabólicas, esta zona es claramente muy prometedora para mayor investigación. (FASEB J. 1995 9, 1585; Trends Biochem Sci. 2004 29, 495).
En aras de la simplicidad y la claridad, las transferencias fosforilo en este texto generalmente se representan como concertada, reacciones como SN2, en dos dimensiones, con un doble enlace localizado, pero debe de tener siempre en cuenta la existencia de una pentavalente, estado de transición trigonal bipiramidal / intermedio. Además, tenga en cuenta que en otros libros y artículos estas reacciones se pueden encontrar de manera algo diferente.


