16.1: La espontaneidad
- Page ID
- 1924
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Distinguir entre procesos espontáneos y no espontáneos.
- Describir la dispersión de materia y energía que acompaña a ciertos procesos espontáneos.
En esta sección, considere las diferencias entre dos tipos de cambios en un sistema: los que ocurren espontáneamente y los que ocurren por fuerza. Al hacer esto, entenderemos por qué algunos sistemas están naturalmente inclinados a cambiar en una dirección bajo ciertas condiciones y con qué rapidez o lentitud avanza el cambio natural. También obtendremos información sobre cómo la espontaneidad de un proceso afecta la distribución de energía y materia dentro del sistema.
Los procesos espontáneos y no espontáneos
Los procesos tienen una tendencia natural a ocurrir en una dirección bajo un conjunto dado de condiciones. El agua fluirá naturalmente hacia abajo, pero el flujo hacia arriba requiere una intervención externa, como el uso de una bomba. El hierro expuesto a la atmósfera terrestre se corroe, pero el óxido no se convierte en hierro sin un tratamiento químico intencional. Un proceso espontáneo es aquel que ocurre naturalmente bajo ciertas condiciones. Un proceso no espontáneo, por otro lado, no pasará a menos que sea "impulsado" por el flujo continuo de energía de una fuente externa. Un proceso que es espontáneo en una dirección bajo un conjunto particular de condiciones no es espontáneo en la dirección opuesta. A temperatura ambiente y presión atmosférica típica, por ejemplo, el hielo se derretirá espontáneamente, pero el agua no se congelará espontáneamente.
La espontaneidad de un proceso no se correlaciona con la velocidad del proceso. Un cambio espontáneo puede ser tan rápido que es esencialmente instantáneo o tan lento que no se puede observar durante ningún período de tiempo práctico. Para ilustrar este concepto, considérese la desintegración de los isótopos radiactivos, un tema que se discute más en el capítulo sobre la química nuclear. La desintegración radiactiva es, por definición, un proceso espontáneo en el que los núcleos de isótopos inestables emiten radiación a medida que se convierten en núcleos más estables. Todos los procesos de desintegración ocurren espontáneamente, pero las tasas a las que los diferentes isótopos se desintegran varían extensamente. El Tecnecio-99m es un radioisótopo popular para estudios de imágenes médicas que sufre una desintegración relativamente rápida y exhibe una vida media de aproximadamente seis horas. El Uranio-238 es el isótopo más abundante del uranio y su desintegración ocurre mucho más lentamente, exhibiendo una vida media de más de cuatro mil millones de años (Figura \(\PageIndex{1}\)).
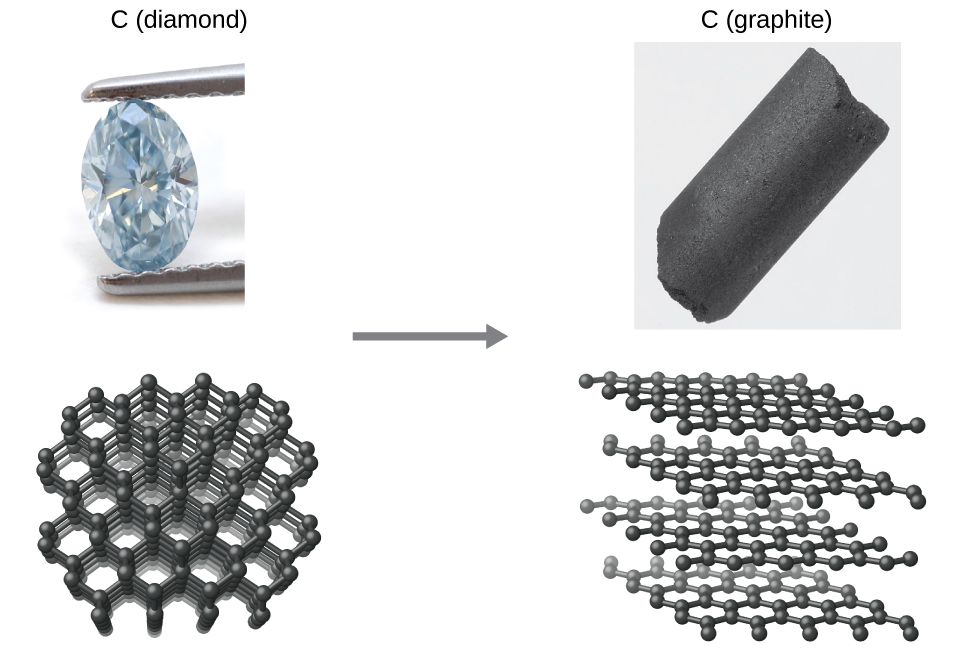
Como otro ejemplo, considere la conversión de diamante en grafito (Figura \(\PageIndex{2}\)).
\[\ce{C}_{(s,\textrm{ diamond})}⟶\ce{C}_{(s,\textrm{ graphite})} \label{Eq1}\]
El diagrama de fase del carbono indica que el grafito es la forma estable de este elemento bajo presión atmosférica ambiental, mientras que el diamante es el alótropo estable a presiones muy altas, como las presentes durante su formación geológica. Los cálculos termodinámicos del tipo descrito en la última sección de este capítulo indican que la conversión de diamante en grafito a presión ambiental ocurre espontáneamente, sin embargo, se observa que los diamantes existen y persisten en estas condiciones. Aunque el proceso es espontáneo en condiciones ambientales típicas, su velocidad es extremadamente lenta, por lo que, para todos los propósitos prácticos, los diamantes son "para siempre". Situaciones como estas enfatizan la importante distinción entre los aspectos termodinámico y cinético de un proceso. En este caso particular, se dice que los diamantes son termodinámicamente inestables pero cinéticamente estables en condiciones ambientales.
Dispersión de materia y energía
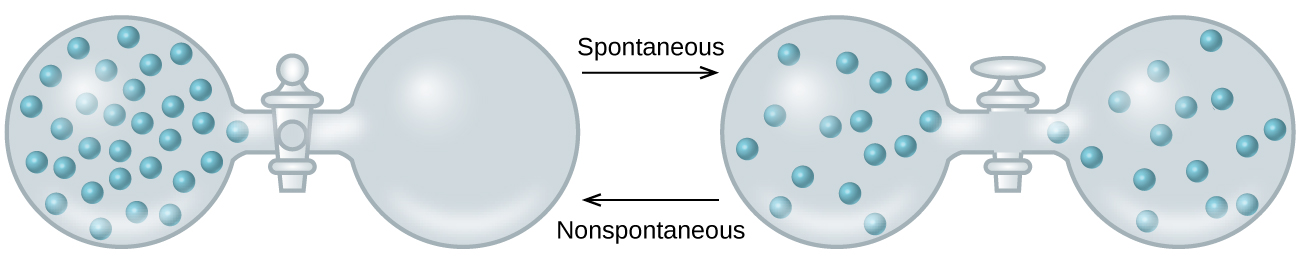
A medida que extendemos nuestra discusión de los conceptos termodinámicos hacia el objetivo de predecir la espontaneidad, consideremos ahora un sistema aislado que consta de dos matraces conectados con una válvula cerrada. Inicialmente hay un gas ideal a la izquierda y un vacío a la derecha (Figura \(\PageIndex{3}\)). Cuando se abre la válvula, el gas se expande espontáneamente para llenar ambos matraces. Recordando la definición de trabajo de presión-volumen del capítulo sobre termoquímica, tenga en cuenta que no se ha realizado ningún trabajo porque la presión en el vacío es cero.
\[w=−PΔV=0 \;\;\; \mathrm{(P=0\: in\: a\: vaccum)} \label{Eq2}\]
Tenga en cuenta también que, dado que el sistema está aislado, no se ha intercambiado calor con el entorno (q = 0). La primera ley de la termodinámica confirma que no ha habido cambios en la energía interna del sistema como resultado de este proceso.
\[ΔU=q+w=0+0=0 \label{Eq3}\]
La espontaneidad de este proceso, por lo tanto, no es la consecuencia de ningún cambio de energía que es parte del proceso. En vez, la fuerza impulsora parece estar relacionada con la dispersión uniforme de materia que resulta cuando se permite que el gas se expanda. Inicialmente, el sistema estaba compuesto por un matraz que contenía materia y otro matraz que no contenía nada. Después de que el proceso espontáneo ocurrió, la materia se distribuyó más (ocupando el doble de su volumen original) y de manera más uniforme (presente en cantidades iguales en cada frasco).
Ahora considere dos objetos a diferentes temperaturas: el objeto X a la temperatura TX y el objeto Y a la temperatura TY, con TX> TY (Figura \(\PageIndex{4}\)). Cuando estos objetos están en contacto, el calor fluye espontáneamente del objeto más caliente (X) al más frío (Y). Esto corresponde a una pérdida de energía térmica por X y una ganancia de energía térmica por Y.
\[q_\ce{X}<0 \hspace{20px} \ce{and} \hspace{20px} q_\ce{Y}=−q_\ce{X}>0 \label{Eq4}\]
Desde la perspectiva de este sistema de dos objetos, no hubo una ganancia o pérdida neta de energía térmica, sino que la energía térmica disponible se redistribuyó entre los dos objetos. Este proceso espontáneo resultó en una dispersión de energía más uniforme.

Como lo ilustran los dos procesos descritos, un factor importante para determinar la espontaneidad de un proceso es el grado en que cambia la dispersión o distribución de materia y / o energía. En cada caso, ocurrió un proceso espontáneo que resultó en una distribución más uniforme de materia o energía.
Ejemplo \(\PageIndex{1}\): Redistribución de la materia durante un proceso espontáneo
Describa cómo se redistribuye la materia cuando los siguientes procesos espontáneos ocurren:
- Un sólido se sublime.
- Un gas se condensa.
- Una gota de colorante para alimentos agregada a un vaso de agua forma una solución de color uniforme.
Solución

- La sublimación es la conversión de un sólido (densidad relativamente alta) en un gas (densidad mucho menor). Este proceso produce una dispersión de materia mucho más grande, ya que las moléculas ocuparán un volumen mucho más grande después de la transición de sólido a gas.
- La condensación es la conversión de un gas (densidad relativamente baja) en un líquido (densidad mucho más grande). Este proceso produce una dispersión de materia menor, ya que las moléculas ocuparán un volumen mucho menor después de la transición de sólido a gas.
- El proceso en cuestión es la dilución. Las moléculas de colorante alimentario ocupan inicialmente un volumen mucho menor (la gota de solución de colorante) del que ocupan una vez que se completa el proceso (en el vaso de agua lleno). Por tanto, el proceso necesita una mayor dispersión de materia. El proceso también puede producir una dispersión más uniforme de la materia, ya que el estado inicial del sistema involucra dos regiones de diferentes concentraciones de tinte (alta en la gota, cero en el agua), y el estado final del sistema contiene una sola concentración de tinte.
Ejercicio \(\PageIndex{1}\)
Describa cómo se redistribuye la materia y/o la energía cuando vacías un bote de aire comprimido en un cuarto.
- Respuesta
-
Este también es un proceso de dilución, análogo al ejemplo (c). Implica una dispersión mayor y más uniforme de la materia, ya que se permite que el aire comprimido en el recipiente se expande hacia el aire de menor presión del cuarto.
Resumen
Los procesos químicos y físicos tienen una tendencia natural a ocurrir en una dirección bajo ciertas condiciones. Un proceso espontáneo ocurre sin la necesidad de un flujo continuo de energía de alguna fuente externa, mientras que un proceso no espontáneo lo requiere. Los sistemas que pasan por un proceso espontáneo pueden o no experimentar una ganancia o pérdida de energía, pero experimentarán un cambio en la forma en que la materia y/o la energía se distribuyen dentro del sistema.
Glosario
- proceso no espontáneo
- proceso que requiere un flujo continua de energía de una fuente externa
- cambio espontáneo
- proceso que pasa sin un flujo continuo de energía de una fuente externa
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


