18.8: La ocurrencia, preparación y propiedades del fósforo
- Page ID
- 1959
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Describir las propiedades, preparación y usos del fósforo.
El fósforo se prepara industrialmente usando el calentamiento del fosfato de calcio, esto se obtiene de la roca fosfórica con arena y coque.
\[\ce{2Ca3(PO4)2}(s)+\ce{6SiO2}(s)+\ce{10C}(s) \xrightarrow{Δ} \ce{6CaSiO3}(l)+\ce{10CO}(g)+\ce{P4}(g)\]
El fósforo se destila fuera del horno y se condensa en un sólido o se quema para formar el P4O10. La preparación de muchos otros compuestos de fósforo comienza con el P4O10. Los ácidos y fosfatos se usan como fertilizantes y en la industria química. Otros usos se encuentran en la fabricación de aleaciones especiales como el ferrofosforo y el bronce fosforoso. El fósforo es importante en la fabricación de los pesticidas, fósforos y algunos plásticos. El fósforo es un no metal activo. En los compuestos, el fósforo normalmente tiene estados de oxidación de 3−, 3+ y 5+. El fósforo exhibe números de oxidación que son inusuales para un elemento del grupo 15 en compuestos que contienen enlaces fósforo-fósforo; los ejemplos incluyen tetrahidruro de difósforo, H2P-PH2, y trisulfuro de tetrafosforo, P4S3, que se muestra en la figure \(\PageIndex{1}\).
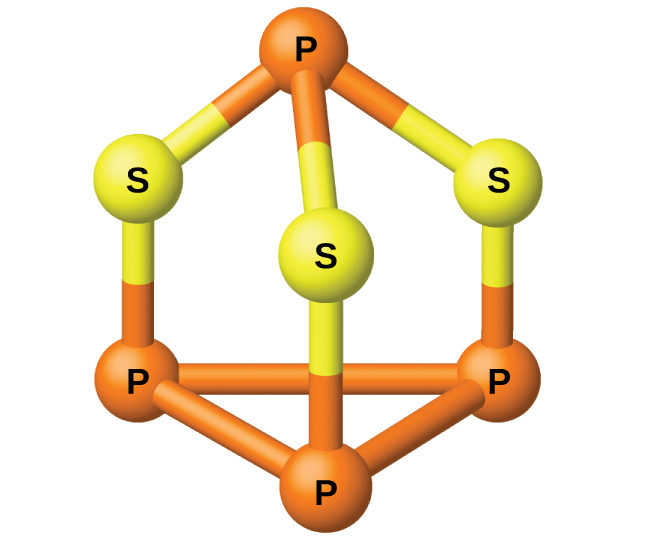
Figura \(\PageIndex{1}\): P4S3 es un componente de la punta de los fósforos.
Los compuestos de fósforo y oxígeno
El fósforo forma dos óxidos comunes, el óxido de fósforo (III) (o el hexaóxido de tetrafosforo), P4O6, y el óxido de fósforo (V) (o el decaóxido de tetrafosforo), P4O10, ambos se muestran en la Figura \(\PageIndex{2}\). El óxido de fósforo (III) es un sólido cristalino blanco que huela a ajo. Su vapor es muy venenoso. Se oxida lentamente en el aire y se inflama cuando se calienta a 70 °C, formando el P4O10. El óxido de fósforo (III) se disuelve lentamente en el agua fría para formar el ácido fosforoso, H3PO3.
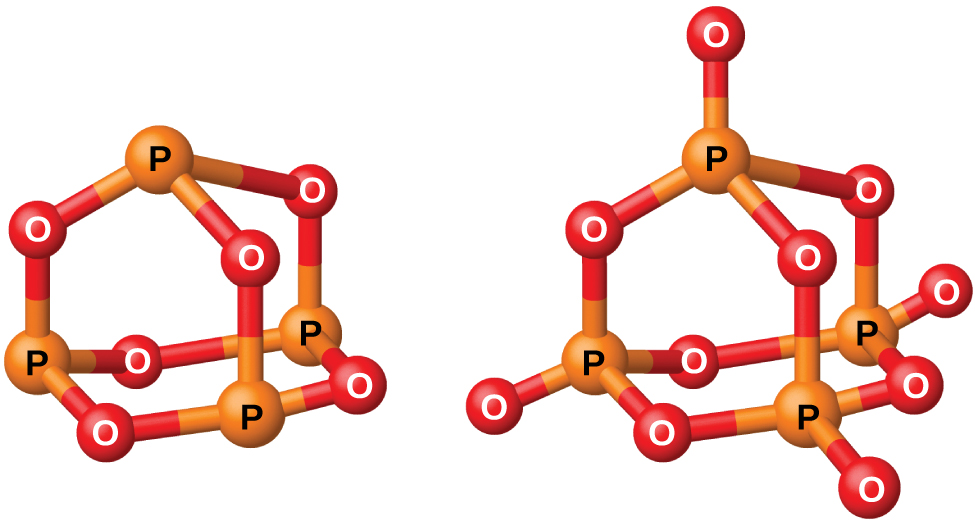
Figura \(\PageIndex{2}\): Esta imagen muestra las estructuras moleculares de P4O6 (izquierda) y P4O10 (derecha).
El óxido de fósforo (V), P4O10, es un polvo blanco que se prepara por quemando el fósforo en un exceso de oxígeno. Su entalpía de formación es muy alta (-2984 kJ), y es bastante estable y un agente oxidante malo. Cuando el P4O10 se cae en el agua, produce un silbido, calor y el ácido ortofosfórico
\[\ce{P4O10}(s)+\ce{6H2O}(l)⟶\ce{4H3PO4}(aq)\]
Porque el óxido de fósforo (V) tiene una gran afinidad por el agua, es un excelente agente secante de los gases y disolventes, y puede eliminar el agua de muchos compuestos.
Los compuestos de fósforo con los halógenos
El fósforo reaccionará directamente con los halógenos, formando los trihaluros, PX3 y los pentahaluros, PX5. Los trihaluros son mucho más estables que los correspondientes trihaluros de nitrógeno; los pentahaluros de nitrógeno no se forman porque el nitrógeno no puede formar más de cuatro enlaces.
Los cloruros PCl3 y PCl5, que se muestran en la Figura \(\PageIndex{3}\), son los haluros más importantes del fósforo. El tricloruro de fósforo es un líquido incoloro que se prepara por pasando el cloro sobre el fósforo fundido. El pentacloruro de fósforo es un sólido blanquecino que se prepara por oxidando el tricloruro con un exceso de cloro. El pentacloruro se sublima cuando se calienta y forma un equilibrio con el tricloruro y el cloro cuando se calienta.
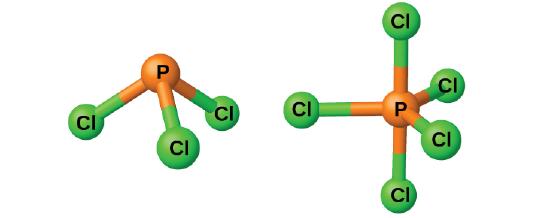
Figura \(\PageIndex{3}\): This image shows the molecular structure of PCl3 (left) and PCl5 (right) in the gas phase.
Como la mayoría de los otros haluros no metálicos, ambos cloruros de fósforo reaccionan con un exceso de agua y producen el cloruro de hidrógeno y un oxiácido: el PCl3 produce el ácido fosforoso H3PO3 y el PCl5 produce el ácido fosfórico, H3PO4.
Los pentahaluros del fósforo son ácidos de Lewis porque el fósforo tiene los orbitales de valencia d vacíos. Estos compuestos reaccionan fácilmente con los iones haluro (bases de Lewis) para producir el anión \(\ce{PX6-}\). Mientras que el pentafluoruro de fósforo es un compuesto molecular en todos los estados, los estudios de rayos X muestran que el pentacloruro de fósforo sólido es un compuesto iónico, \(\ce{[PCl4+][PCl6-]}\), al igual que el pentabromuro de fósforo, \(\ce{[PBr4+]}\)[Br−], y pentayoduro de fósforo, \(\ce{[PI4+]}\)[I−].
Resumen
El fósforo (grupo 15) normalmente tiene los estados de oxidación de 3− con metales activos y de 3+ y 5+ con no metales más electronegativos. Los halógenos y el oxígeno oxidan al fósforo. Los óxidos son el óxido de fósforo (V), P4O10 y el óxido de fósforo (III), P4O6. Se usa la reacción de un fosfato con el ácido sulfúrico o la reacción del agua con el óxido de fósforo (V) para formar el ácido ortofosfórico, H3PO4. El ácido ortofosfórico es triprótico y forma 3 tipos de sales.
Contribuyentes y atribuciones
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


