5.3: Reemplazos específicos
- Page ID
- 73733
Estrategias Alternativas de Reactivos
Eliminación de Lactosa
La oportunidad de eliminar la lactosa a través de un proceso de separación se puede lograr uniendo glutaraldehído (grupo aldehído de dos extremos terminales abajo, izquierda) a una partícula de sílice aminada (imagen a la derecha) que luego se une covalentemente a una enzima galactosidasa que puede usarse para eliminar la lactosa de los productos lácteos. seguido de acoplamiento con galactosidasa y reacción con leche.
Cuaternización de Aaminas
Los cationes de amonio cuaternario, quats, son iones cargados positivamente de la estructura que se muestra a continuación:
El grupo R puede ser un grupo alquilo o un grupo arilo. A diferencia del amonio (NH 4 +), los cationes de amonio cuaternario están permanentemente cargados, independientemente del pH.
Química Combinatoria
La química combinatoria es una aproximación a la síntesis química que hace posible la preparación de un gran número (por ejemplo, millones) de compuestos en un solo barrido. Estas bibliotecas pueden ser mezclas, compuestos individuales o estructuras computacionales.
La química combinatoria puede ser utilizada para moléculas pequeñas, así como para biomacromoléculas como péptidos. La síntesis puede conducir rápidamente a un gran número de productos. Como ejemplo, una molécula con tres puntos de funcionalidad o diversidad (R1, R2 y R 3) puede generar estructuras, donde N R# = el número de diferentes sustituyentes utilizados. El principio básico de la química combinatoria es la preparación de un gran número de compuestos que luego se utilizan para identificar los componentes útiles de las bibliotecas.
Aunque la química combinatoria ha estado en juego en los últimos 25 años, sus raíces van a la década de 1960 cuando un investigador de Rockefeller, Bruce Merrifield, comenzó a investigar la síntesis de péptidos en fase sólida. Ha tenido su mayor impacto en la industria farmacéutica donde los investigadores optimizan el perfil de actividad de un compuesto al crear una biblioteca de muchos compuestos diferentes pero relacionados.
Almidón
El almidón es un biomaterial de almacenamiento de energía generado a partir de dióxido de carbono y agua durante la fotosíntesis. Entre la panoplia de polímeros naturales, el almidón es de considerable interés por su biodegradabilidad, bajo costo, renovabilidad y biocompatibilidad. Por lo tanto, se considera un candidato prometedor para el desarrollo sustentable de nuevos materiales funcionales.
El almidón está compuesto por dos homopolímeros de D-glucosa: amilasa, un α-D- (1, 4') -glucano prácticamente lineal y amilopectina ramificada, con muchos puntos de ramificación α-1, 6'-enlazados (Figura\(\PageIndex{4}\)).
El almidón es un poliol: tiene por lo tanto, dos grupos hidroxilo secundarios en C-2 y C-3, y un hidroxilo primario en C-6 cuando no está enlazado. También es bastante hidrófilo y puede oxidarse y reducirse para la formación de éteres y ésteres y muchas otras moléculas funcionales. El almidón tiene diversas proporciones de amilosa y amilopectina de aproximadamente 10— 20% de amilosa y 80— 90% de amilopectina según la fuente. Forma una estructura helicoidal y ocurre naturalmente como gránulos discretos porque las cadenas de amilopectina de ramificación corta pueden formar estructuras helicoidales para cristalizar. Tiene un MW de 500-20K que consiste en unidades a- (1à4) -D-glucosa cuya forma extendida tiene un rango de radio hidrodinámico de 7-22 nm. La forma helicoidal de la molécula generalmente forma una hélice rígida a la izquierda cuya estructura, no diferente al ADN, está soportada por enlaces H entre los átomos de O2 y O6. La amilosa puede sufrir sinéresis (síntesis de deshidratación) entre residuos de glucano vecinales (vecinos) para formar la cavidad de ciclodextrina en la que el interior mantiene una hidrofobicidad. Curiosamente, puede formar cristalitos bicatenarios que son resistentes a la amilasa (la enzima putativa para su deconstrucción), y enlaces H y solubilidad. La macromolécula de crowing del almidón, CD, es el sueño de un verdadero químico verde debido a una serie de propiedades maravillosas. A continuación se muestra la estructura toroidal de CD y dimensiones:
¿Cómo funcionan las ciclodextrinas? https://www.youtube.com/watch?v=UaEes6cJu7k (¿Cómo funcionan las ciclodextrinas? (1980). Cyclolab.)
Específicamente, es un oligómero cíclico de a-D-glucopiranosa que se mantiene unido por enlaces glicosídicos muy parecido a lo que se ve en todos los polisacáridos. Fue descubierto en 1891 por Villiers quienes sintetizaron por la conversión enzimática de amilosa seguida de una precipitación selectiva. La precipitación se puede hacer con varios solventes, aunque de naturaleza orgánica y no sustentable, pero con diversos grados de rendimiento. Tenga en cuenta que observamos tres formas de los CDs como se muestra en la gráfica a continuación:
| Agente precipitante | Rendimiento (%) | |
| a- CD | 1-decanol | 40 |
| b- CD | tolueno | 50-60 |
| g -CD | Ciclohexadec-8-en-1-ol | 40-50 |
Lo que es notable de los CD es su capacidad para formar complejos de inclusión de huésped/huésped debido a sus criterios únicos de HLB (Balance Lipófilo Hidrofílico). Estos son literalmente reactores a escala molecular que pueden hacer muchas cosas. En el contexto de las aplicaciones biomédicas, el foco para nuestra discusión particular, se encuentran entre sus beneficios los siguientes.
- Incrementar la solubilidad acuosa de fármacos
- Para aumentar la estabilidad química de los fármacos
- Para mejorar la administración de fármacos a y a través de membranas biológicas
- Para aumentar la estabilidad física de las drogas
- Para convertir medicamentos líquidos en polvos microcristalinos
- Prevenir las interacciones fármaco-fármaco y fármaco-excipiente
- Para reducir la irritación local después de la administración tópica u oral
- Para prevenir la absorción del fármaco en la piel o después de la administración oral
Los nanorreactores tienen una capacidad increíble para encapsular y/o hacer química con una serie de químicos que son hidrófobos o de baja polaridad. En la Figura 5-9 se muestra una caricatura que representa la acción hidrolítica de la CD con una molécula de fosfato.
Figura\(\PageIndex{6}\): Una representación simplificada del comportamiento de encapsulación y reactividad química de una macromolécula de CD para la hidrólisis de fosfato. https://commons.wikimedia.org/wiki/F...ease_Mimic.png
La CD puede, en virtud de las variedades en sus tamaños, acomodar moléculas huésped relativamente pequeñas a grandes. A continuación, en la Figura 5-10 se muestra una descripción pictórica de un complejo 1:2 invitado:anfitrión que se involucra en el comportamiento fotofísico.
El sistema está realizando una transferencia de energía desde las moléculas periféricas que contienen boro a las moléculas de porfirina encapsuladas que liberan un fotón de luz tras la transferencia de energía resonante (645 nm) de las moléculas periféricas.
Diagramas de Solubilidad
Los estudios de solubilidad de fase se llevan a cabo en sistemas acuosos a diferentes temperaturas para calcular constantes de estabilidad (equilibrio), (K c) y valores termodinámicos para la formación de complejos de inclusión. Se sabe que si los diagramas de solubilidad de fase muestran que la solubilidad de una molécula huésped aumenta linealmente junto con la concentración de CD, entonces pueden considerarse como diagramas de fase tipo Al [1], sugiriendo la formación de complejos 1:1, que son los más comunes y mejor entendidos de este tipo de interacciones. Cuando los datos de solubilidad de fase se recogen a diferentes temperaturas, podemos obtener información adicional valiosa como los parámetros termodinámicos para la formación del complejo.
La forma integrada de la Ecuación de Van 't Hoff permite el cálculo de los cambios de entalpía (DH) y entropía (DS) dependiendo de las variaciones de las constantes de estabilidad con la temperatura [2]:
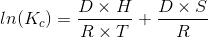
La K c también se puede expresar como la siguiente relación:
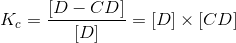
que pueden describirse pictóricamente como:
en el que existe una complejación con D (el sustrato o fármaco en este caso) y la CD. Lo anterior representa un complejo tipo Al que es de primer orden con respecto a la EC y al fármaco (D).
Los perfiles de solubilidad en fase de tipo A se definen por la solubilidad del sustrato (fármaco) aumentando con el aumento de la concentración de ligando (ciclodextrina). Cuando el complejo es de primer orden con respecto al ligando y de primer orden o superior con respecto al sustrato, se obtienen perfiles de solubilidad en fase de tipo A L. Si el complejo es de primer orden con respecto al sustrato pero de segundo o superior orden con respecto al ligando, se obtienen los tipos A P. Los perfiles de solubilidad de fase tipo N son difíciles de interpretar. Los perfiles de solubilidad en fase tipo B indican la formación de complejos con solubilidad limitada en el medio acuoso. Los derivados de ciclodextrina solubles en agua forman perfiles de solubilidad en fase de tipo A, mientras que las ciclodextrinas menos solubles forman perfiles de tipo B. Varios complejos fármaco/ciclodextrina forman complejos de inclusión, las butciclodextrinas forman complejos de no inclusión y agregados que disuelven fármacos a través de estructuras similares a micelas. Los perfiles de solubilidad en fase no verifican complejos de inclusión, sino que solo describen cómo la concentración creciente de ciclodextrina influye en la solubilidad del fármaco. Como ya comentamos, el tipo más común de complejos de ciclodextrina son los 1:1 donde una molécula de fármaco (D) forma un complejo con una molécula de ciclodextrina (CD). En un diagrama de fasesolubilidad de tipo Al donde la pendiente es menor que la unidad, la constante de estabilidad (K 1:1) del complejo se puede calcular a partir de la pendiente y la solubilidad intrínseca (S0) del fármaco en el medio acuoso (es decir, solubilidad del fármaco cuando no hay ciclodextrina presente):
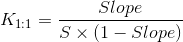
El valor de K 1:1 es típicamente 50 < 2000 M -1 con un valor medio de 129, 490 y 355 M -1 para α-, β- y γ- ciclodextrina, respectivamente [3].

