4.7: Predicción de fórmulas de compuestos unidos covalentemente
- Page ID
- 69904
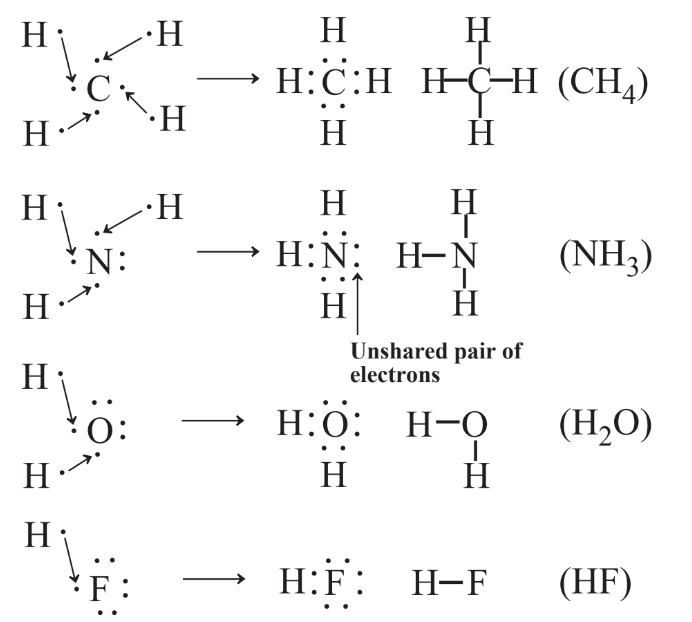
A menudo es posible predecir las fórmulas de moléculas usando los símbolos de Lewis de los elementos en el compuesto con la regla del octeto para la unión química. Esto se muestra en la Figura 4.8 para los compuestos de hidrógeno de varios elementos en el segundo periodo de la tabla periódica.
La predicción de enlaces químicos en compuestos en los que H está unido a otro átomo es muy simple porque cada átomo de H tiene que estar involucrado en compartir dos electrones y el otro tipo de átomo normalmente tiene que tener un total de 8 electrones en su octeto de vaina de valencia; estos pueden ser compartidos en enlaces o presentes como no compartidos pares. Como ejemplo, considere un compuesto bien conocido de carbono, dióxido de carbono, fórmula química CO 2. El símbolo de Lewis de C y los de los dos átomos de O pueden usarse para deducir la fórmula de Lewis de CO 2 como se muestra en la Figura 4.9.
Como otro ejemplo de la aplicación de la regla del octeto, considere el peróxido de hidrógeno, H 2 O 2. La fórmula de este compuesto se parece mucho a la del agua, pero es muy diferente del agua. El peróxido de hidrógeno se descompone para liberar oxígeno:
\[\ce{2H2O2 (liquid) \rightarrow O2(gas) + 2H2O(liquid)}\]
Como líquido en forma de solución acuosa concentrada, el peróxido de hidrógeno proporciona una fuente de oxígeno tan potente que se ha utilizado en cohetes. Fue el traicionero oxidante utilizado junto con el combustible de hidrazina (N 2 H 4) en el avión cohete Messerschmidt 163 de la Luftwaffe alemana al final de la Segunda Guerra Mundial. Tras un escape de gas letal NO 2, este minúsculo misil tripulado (en las raras ocasiones en que funcionaba de acuerdo al plan) fue impulsado rápidamente hacia la estratosfera inferior, luego se deslizó hacia abajo a través de oleadas de bombarderos aliados, intentando cortarlos con ametralladoras mientras se desplomaba de nuevo a Tierra. Pocos bombarderos resultaron dañados pero muchos pilotos del Me-163 murieron en el intento, algunos como resultado de explosiones, incendios y derrames del oxidante de peróxido de hidrógeno. El peróxido de hidrógeno descompuesto sobre un catalizador también se utilizó como fuente de oxígeno para los motores diesel en varios submarinos alemanes cerca del final de la Segunda Guerra Mundial. Antes de fechar a los submarinos nucleares, estas embarcaciones potencialmente mortales fueron los primeros verdaderos sumergibles.
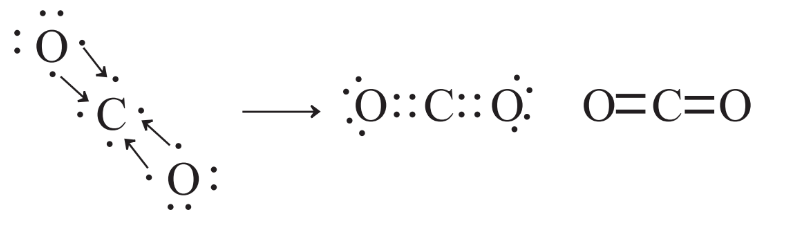
Al ensamblar la estructura de la molécula de peróxido de hidrógeno, uno simplemente tiene que trabajar con dos átomos de O cada uno aportando 6 electrones de valencia y dos átomos de H cada uno con 1 electrón de valencia. La fórmula de Lewis de la molécula H 2 O 2 es

mostrando que todos los 14 electrones de valencia total están involucrados en enlaces químicos y ambos oxígenos tienen octetos de electrones de capa exterior.
A pesar de la naturaleza maligna de las soluciones concentradas de peróxido de hidrógeno, puede considerarse como un compuesto verde en soluciones más diluidas, como el peróxido de hidrógeno al 3% que se usa comúnmente para matar bacterias en el tratamiento de heridas. Entre sus aplicaciones verdes, el peróxido de hidrógeno diluido hace un agente blanqueador efectivo y seguro que es mucho más seguro de manejar que el cloro elemental comúnmente utilizado para blanquear y que no produce los subproductos potencialmente tóxicos que genera el cloro. Y aunque mata bacterias, el peróxido de hidrógeno se puede bombear bajo tierra para servir como oxidante para las bacterias aclimatadas que atacan los desechos que se han colocado o filtrados en ubicaciones subterráneas
Moléculas que no obedecen a la regla del octeto
En algunos casos no se obedece la regla del octeto. Esto ocurre cuando una molécula tiene un número desigual de electrones por lo que es imposible que cada átomo tenga un octeto (un número par) de electrones. Un ejemplo sencillo de esto es el óxido nítrico, NO, hecho de un átomo de N con 5 electrones de valencia y uno de O con 6 electrones de valencia. La molécula resultante se muestra en la Figura 4.10. Dado que el número desigual de 11 electrones de valencia no puede proporcionar octetos completos de electrones alrededor de ambos átomos de N y O simultáneamente, la molécula de NO se muestra en dos formas en las que un átomo tiene 8 electrones de valencia y el otro tiene 7. Estas se conocen como estructuras de resonancia.
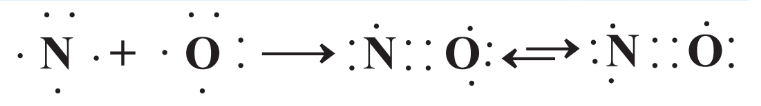
Distribución desigual de electrones
La fórmula de Lewis para el agua,
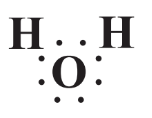
indica que la molécula no es simétrica y los dos átomos de H están localizados en un lado de la molécula y el átomo de O en el otro lado. Se podría pensar que los electrones compartidos entre la Mano O se comparten por igual. Pero tal no es el caso porque el núcleo del átomo de O relativamente más grande con sus 8 protones tiene una atracción más fuerte por los electrones que los dos núcleos de átomos de H, cada uno con solo 1 protón. Así que los electrones compartidos pasan relativamente más tiempo alrededor del átomo O y menos alrededor de los átomos H. Esto le da a cada átomo de H una carga positiva parcial y al átomo de O una carga negativa parcial. Una distribución desigual de carga como la que hace que un cuerpo sea polar y los enlaces O-H son enlaces covalentes polares. Debido a este fenómeno, toda la molécula de agua es polar y puede representarse como la siguiente, donde las pequeñas esferas representan átomos de H y la grande para el átomo de O:
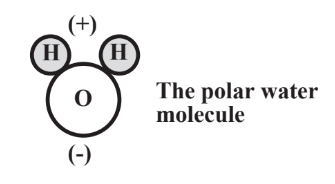
La naturaleza polar de la molécula de agua tiene mucho que ver con el agua como solvente y cómo se comporta en el medio ambiente y en los sistemas vivos. Estos aspectos se discuten con más detalle en el Capítulo 8.
Cuando solo un átomo contribuye a un enlace covalente
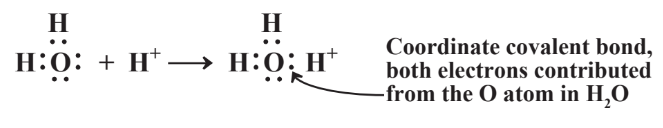
En algunos casos solo uno de los dos átomos unidos por un enlace covalente aporta ambos electrones en el enlace. Esto ocurre con amoníaco, NH 3, disuelto en agua. El agua contiene cationes H + disueltos, y cuanto más ácida es el agua, mayor es la concentración de H +. El catión H +, sería estabilizado por dos electrones que puede obtener al unirse con NH 3 disuelto como se muestra en la Reacción 4.7.2. Ambos electrones compartidos entre N y el catión H + ahora unidos a él como parte de una nueva especie, el ion amonio, NH 4 +, fueron aportados por el átomo de N. Tal enlace covalente se denomina enlace covalente coordinado o enlace dativo. En el caso de NH 4 +, una vez formado el enlace N-H covalente coordinado, es indistinguible de todos los demás enlaces N-H.
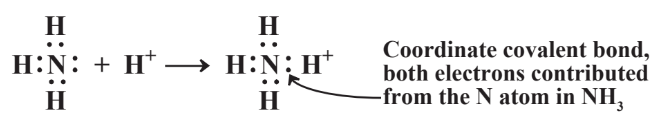
La formación del enlace covalente coordinado en NH 4 + es muy útil cuando el suelo es fertilizado con nitrógeno. La forma más económica de aplicar fertilizante nitrogenado es inyectando NH 3 en el suelo, pero NH 3 es un gas que se esperaría que se evaporara rápidamente del suelo. En cambio, se adhiere al ion H + del agua en el suelo y se une al suelo como el ion NH 4 +.
Otro ejemplo importante de un enlace covalente coordinado ocurre en el agua. Como se discute en la Sección 4.9, los ácidos, que son materiales muy importantes comúnmente disueltos en agua, producen el ión hidrógeno, H +, en agua. Este ion no existe simplemente dispersado en agua. En cambio, se une fuertemente a una molécula de agua para producir el ion hidronio, H 3 O +: