Preguntas y problemas
- Page ID
- 69929
El acceso y uso de Internet se asume al responder a todas las preguntas, incluida la información general, las estadísticas, las constantes y las fórmulas matemáticas necesarias para resolver problemas. Estas preguntas están diseñadas para promover la indagación y el pensamiento en lugar de simplemente encontrar material en el texto. Entonces en algunos casos puede haber varias respuestas “correctas”. Por lo tanto, si tu respuesta refleja un esfuerzo intelectual y una búsqueda de información de fuentes disponibles, tu respuesta puede considerarse “correcta”.
1. ¿Qué distingue a las moléculas de los compuestos químicos de las de elementos, como el N 2?
2. Al inicio de este capítulo se mencionaron varias “características de compuestos que cumplen con los criterios de ser verdes”. Cerca del final del capítulo, el ácido acético fue mencionado como un “ácido verde”. ¿En qué aspectos cumple con los criterios de los compuestos verdes?
3. ¿Qué es el estearato de sodio? ¿Por qué se le considera verde?
4. ¿Cuál de los siguientes no suele considerarse una característica de los compuestos químicos verdes? ¿Por qué no se considera así?
A. Preparación a partir de recursos renovables
B. Baja tendencia a sufrir reacciones repentinas, violentas e impredecibles
C. Facilmente biodegradable
D. Estabilidad extremadamente alta
5. ¿Qué son los electrones de valencia? ¿Por qué son particularmente importantes?
6. ¿Cuál es la regla del octeto? ¿Por qué es particularmente importante en química?
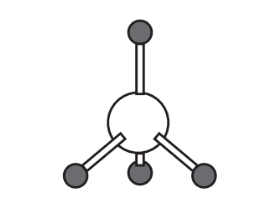
7. ¿Qué dice la estructura que representa CH 4 a continuación sobre la unión y los octetos de electrones alrededor del átomo central de C?
8. Considerando que el átomo central de nitrógeno en amoníaco, NH 3, tiene un par no compartido de electrones de valencia y 3 pares compartidos entre N y H, proponen una estructura para la molécula de amoníaco basada en la estructura de la molécula de metano en la pregunta anterior. Use un par de puntos para representar el par de electrones no compartidos.
9. ¿Qué es un enlace iónico? ¿Por qué no se considera que está entre un catión específico y un anión específico en un compuesto iónico?
10. ¿Los compuestos iónicos como el NaCl obedecen a la regla del octeto? Explique.
11. ¿Por qué se refiere al NaCl como una unidad de fórmula del compuesto iónico en lugar de una molécula de cloruro de sodio?
12. La energía está involucrada en varias etapas del proceso por las cuales un metal elemental y un no metal elemental se convierten en un compuesto iónico (sal). De estos, ¿cuál tiene la mayor energía?
13. Colocar los siguientes iones en orden decreciente de tamaño: Na +, Cl -, Al 3 +, K +
14. ¿Cuál es una desventaja importante del cloruro de calcio como agente deshielo vial? ¿Por qué el acetato de calcio es un buen sustituto?
15. Enumerar algunas características importantes de un enlace covalente.
16. ¿Cuál es la principal característica de los iones en los líquidos iónicos que permiten que estos materiales sean líquidos alrededor de la temperatura ambiente?
17. ¿Pueden los átomos en el NO 2 obedecer la regla del octeto? Sugerir la fórmula estructural para esta molécula en la que los 2 átomos de O están unidos a un átomo de N.
18. Los enlaces covalentes coordinados normalmente se consideran aquellos en los que cada uno de los dos átomos contribuye a que los electrones se compartan en el enlace. ¿Hay alguna circunstancia en la que esto no sea cierto? Si es así, dar un ejemplo.
19. ¿Cuáles son las tres formas principales en las que se caracterizan los enlaces covalentes?
20. ¿Cuáles son algunas de las formas en que las características de los enlaces covalentes se relacionan con la química verde?
21. ¿Por qué los elementos en la mitad de los períodos de la tabla periódica son menos propensos a formar compuestos iónicos y más propensos a formar compuestos covalentes que aquellos cerca de cada extremo de cada período?
22. Predecir la fórmula del compuesto formado cuando H reacciona con P y explica.
23. Aunque el cloruro de hidrógeno, HCl, existe como gas, la competencia por los dos electrones compartidos en el enlace entre H y Cl es desigual, teniendo el núcleo de Cl la mayor atracción. Sugerir la naturaleza del enlace H-Cl y sugerir lo que puede suceder cuando el gas HCl se disuelve en agua para producir ácido clorhídrico.
24. Usando fórmulas de Lewis, se muestra el enlace en la molécula SO 2 en la que dos átomos de O están unidos a un átomo central de O. ¿Se puede dibujar otra estructura equivalente? Considerando la vinculación en NO discutida en este capítulo, cómo se llaman estas estructuras.
25. Resumir la información mostrada en la fórmula Ca 3 (PO 4) 2.


