4.10: Ácidos, Bases y Sales
- Page ID
- 69880
Aparte de los compuestos moleculares binarios, la mayoría de los compuestos inorgánicos pueden clasificarse como ácidos, bases o sales. Estas tres categorías de compuestos y sus nombres se abordan brevemente aquí.
Ácidos
Los ácidos se caracterizan por el ion H +, cuya presencia en el agua, hace que el agua sea ácida. Un ácido o bien contiene este ion o lo produce cuando se disuelve en agua. El ácido sulfúrico, H 2 SO 4, es un ejemplo de un compuesto que contiene ion H +. Disolvida en agua, existe una molécula de ácido sulfúrico como 2 iones H + y 1 SO 4 2- ion. Un ejemplo de un compuesto que se clasifica como ácido porque produce iones H + cuando se disuelve en agua es el dióxido de carbono, que experimenta la siguiente reacción en solución acuosa:
\[CO_{2} + H_{2}O \rightarrow H^{+} + HCO_{3}^{-}\]
En este caso, solo una pequeña fracción de las moléculas de CO 2 disueltas en agua experimentan la reacción anterior para producir H + por lo que las soluciones acuosas de CO 2 son débilmente ácidas y el dióxido de carbono se clasifica como un ácido débil. Es la presencia de CO 2 disuelto del dióxido de carbono presente naturalmente en el aire lo que hace que las precipitaciones provenientes incluso de atmósferas no contaminadas sean ligeramente ácidas y, como se discute en el Capítulo 9, las propiedades débilmente ácidas del CO 2 son muy importantes en las aguas naturales del ambiente. Otros ácidos, como el ácido clorhídrico, HCl, se disocian completamente a H + y un anión (en el caso de HCl el anión Cl -) cuando se disuelven en agua; dichos ácidos son ácidos fuertes.
La denominación de los ácidos sigue ciertas reglas. En el caso de un ácido que contiene solo H y otro elemento, el ácido es un ácido hidro-ico. Por lo que el HCl se llama ácido hidro clor ic. Se aplican reglas algo diferentes cuando un ácido contiene oxígeno. Algunos elementos forman ácidos en los que el anión tiene diferentes cantidades de oxígeno; ejemplos son H 2 SO 4 y H 2 SO 3. El ácido con más oxígeno es un ácido “-ic”, por lo que H 2 SO 4 es ácido sulfúrico. El ácido con menor cantidad de oxígeno es un ácido “-oso”, por lo que H 2 SO 3 es ácido sulfuroso. Una mayor cantidad de oxígeno que incluso el ácido “-ic” se denota con el prefijo “per-”, y una cantidad menor de oxígeno que incluso el ácido “-ous” se denota con el prefijo “hipo-”. Estos nombres se muestran muy bien por los nombres de los oxiácidos del cloro. Entonces los nombres de HClO 4, HClO 3, HClO 2 y HClO son, respectivamente, ácido perclórico, ácido cloroso y ácido hipocloroso.
Los ácidos son extremadamente importantes como químicos industriales, en el medio ambiente y con respecto a la química verde. Alrededor de 40 millones de toneladas métricas (40 mil millones de kilogramos) de ácido sulfúrico se producen en Estados Unidos cada año. Es el químico sintético número 1, en gran parte por su aplicación para tratar minerales de fosfato para hacer fertilizantes fosfatados para cultivos. El ácido sulfúrico también se utiliza en grandes cantidades para eliminar la corrosión del acero, un proceso llamado decapado de acero. Otros usos importantes incluyen síntesis de detergentes, refinación de petróleo, fabricación de baterías de almacenamiento de plomo y síntesis de alcohol. Alrededor de 7-8 millones de toneladas de ácido nítrico, HNO 3, se producen en Estados Unidos cada año, lo que le da un rango de 10, y el ácido clorhídrico ocupa aproximadamente el 25 con una producción anual de alrededor de 3 millones de toneladas métricas.
Los ácidos son importantes en el medio ambiente. El ácido desechado incorrectamente ha causado problemas importantes alrededor de los sitios de desechos peligrosos. El ácido sulfúrico junto con cantidades menores de ácido clorhídrico y nítrico son los principales constituyentes de la lluvia ácida (ver Capítulo 10). Los ácidos ocupan un lugar destacado en la práctica de la química verde. La recuperación y el reciclaje de ácidos se realizan comúnmente en la práctica de la ecología industrial. Como se señaló anteriormente, gran parte del ácido sulfúrico que ahora se fabrica utiliza un potencial de desecho y contaminante, sulfuro de hidrógeno, H 2 S, retirado de fuentes de gas natural agrio como fuente de azufre.
En los casos en que se puede utilizar un ácido relativamente débil, el ácido acético elaborado por la fermentación de carbohidratos es una excelente alternativa verde a los ácidos más fuertes, como el ácido sulfúrico. Las levaduras pueden convertir los carbohidratos en etanol (alcohol etílico, que está presente en las bebidas alcohólicas) y otros microorganismos en presencia de aire convierten el etanol en ácido acético por el mismo proceso que el vinagre, una solución diluida de ácido acético, se elabora a partir de sidra o vino. La fórmula estructural del ácido acético es
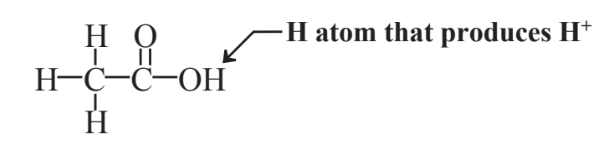
en el que solo uno de los 4 átomos de H es ionizable para producir iones H+. La producción de ácido acético es un proceso verde que utiliza reacciones biológicas que actúan sobre materias primas de biomasa renovable. Como ácido débil, el ácido acético es relativamente seguro de usar, y el contacto con los humanos no suele ser muy peligroso (ingerimos ácido acético diluido como vinagre, pero el ácido acético puro ataca la carne y se usa para eliminar las verrugas de la piel). Otra ventaja del ácido acético es que es biodegradable, por lo que cualquiera de él liberado al medio ambiente no persiste.
Bases
Una base contiene ion hidróxido, OH -, o reacciona con agua para producir hidróxido. La mayoría de las bases que contienen hidróxido consisten en cationes metálicos e hidróxido; ejemplos son hidróxido de sodio, NaOH e hidróxido de calcio, Ca (OH) 2. La sustancia básica más común que produce hidróxido en el agua es el amoníaco, NH 3, que reacciona con el agua de la siguiente manera:
\[NH_{3} + H_{2}O \rightarrow NH_{4}^{+} + OH^{-}\]
Solo una pequeña fracción de las moléculas de amoníaco experimenta esta reacción en agua, por lo que el amoníaco no produce mucho OH-in agua y se le conoce como una base débil. Los hidróxidos metálicos, como el KOH, que se disocian completamente en agua son bases fuertes. Los hidróxidos metálicos son nombrados por el metal seguido por “hidróxido”. Por lo tanto, Mg (OH) 2 es hidróxido de magnesio.
Sales
Los ácidos y bases reaccionan para formar una sal, un compuesto iónico que tiene un catión distinto de H+ y un anión distinto de OH -. Este tipo de reacción siempre produce agua y se conoce como reacción de neutralización. La sal más conocida es el cloruro de sodio, NaCl. Aunque comúnmente es lo que uno quiere decir al referirse a “sal”, también hay muchas otras sales. Estos incluyen cloruro de calcio, CaCl 2, utilizado para derretir hielo de carretera, carbonato de sodio, Na 2 CO 3, utilizado en formulaciones de limpieza y cloruro de potasio, KCl, una fuente de fertilizante de potasio para cultivos. Una reacción de neutralización típica es la que se encuentra entre NaOH y ácido clorhídrico, HCl, para producir cloruro de sodio:
\[\underbrace{NaOH}_{\textrm{Base}} + \underbrace{HCl}_{\textrm{acid}} \rightarrow \underbrace{NaCl}_{\textrm{a salt, sodium chloride}} + \underbrace{H_{2}O}_{\textrm{water}}\]
Las sales se nombran de manera muy simple con solo el nombre del catión seguido del del anión. Las cargas de los iones determinan las fórmulas de las sales, por lo que no es necesario agregar prefijos para denotar los números relativos de cada ion. Por lo tanto, CaCl 2 es simplemente cloruro de calcio, no dicloruro de calcio. Como se señaló anteriormente en este capítulo, se agregan prefijos en nombres de sales que contienen más de 1 tipo de catión o más de 1 tipo de anión para mostrar los números relativos de iones. Como ejemplo, KH 2 PO 4 se llama dihidrogenofosfato de potasio.


