5.1: Describiendo lo que sucede con las ecuaciones químicas
- Page ID
- 69876
¿Hasta dónde tendría que llegar para encontrar una fábrica química diversa que lleve a cabo cientos de procesos químicos complejos? No muy lejos, porque su propio cuerpo es simplemente una fábrica tan notablemente sofisticada que no podría ser duplicada por los esfuerzos de miles de químicos e ingenieros químicos y el gasto de miles de millones de dólares. Como ejemplo de un proceso que nuestros cuerpos llevan a cabo consideramos la utilización del azúcar de glucosa, fórmula química C 6 H 12 O 6, que está presente en nuestra sangre y genera energía que el cuerpo humano utiliza por la siguiente reacción bioquímica metabólica:
\[C_{6}H_{12}O_{6} + 6O_{2} \rightarrow 6CO_{2} + 6H_{2}O\]
Esta es una ecuación química que representa una reacción química, algo que realmente ocurre con los químicos. Afirma que la glucosa reacciona con el oxígeno molecular para producir dióxido de carbono y agua. La reacción química también produce energía y es por eso que el cuerpo la lleva a cabo para obtener la energía necesaria para moverse, trabajar y crecer. La producción de energía a veces se denota en la ecuación al agregar “+ energía” al lado derecho.
Así como una fórmula química contiene mucha información sobre un compuesto químico, una ecuación química contiene mucha información sobre un proceso químico. Una ecuación química se divide en dos partes por la flecha, que se lee “rendimientos”. A la izquierda de la flecha están los reactivos y a la derecha están los productos. Un aspecto clave de una ecuación química correctamente escrita es que está equilibrada, con el mismo número de átomos de cada elemento a la izquierda que a la derecha. Considera la ecuación química anterior. La molécula única de C 6 H 12 O 6 contiene 6 átomos de C, 12 átomos de H y 6 átomos de O. Las moléculas de 6 O 2 contienen 12 átomos de O, dando un total de 18 átomos de O entre los reactivos. Sumando todos los átomos de la izquierda da 6 átomos de C, 12 átomos de H y 18 átomos de O entre los reactivos. A la derecha, los productos contienen 6 átomos de C en las 6 moléculas de CO 2, átomos de 12H en las moléculas de 6 H 2 O, y 12 átomos de O en las 6 moléculas de CO 2, así como 6 átomos de O en las moléculas de 6 H 2 O, un total de 18 átomos de O. Entonces hay 6 átomos de C, 12 átomos de H, y 18 átomos de O entre los productos, lo mismo que en los reactivos. Por lo tanto, la ecuación está equilibrada.
Un ejercicio importante es el proceso de equilibrar una ecuación química. Esto consiste en poner los números correctos antes de cada uno de los reactivos y productos para que números iguales de cada tipo de átomo estén tanto en los lados izquierdo como derecho de la ecuación. El procedimiento para equilibrar una ecuación química se aborda en la sección 5.2.
Aprender química es en gran parte un ejercicio de aprendizaje del lenguaje químico. En el lenguaje químico los símbolos de los elementos son el alfabeto. Las fórmulas de los compuestos son las palabras. Y las ecuaciones químicas son las frases que cuentan lo que realmente sucede.
A menudo es importante conocer los estados físicos de los reactivos y productos en las reacciones químicas. Supongamos, por ejemplo, que un geólogo probó una muestra de roca para ver si se trataba de piedra caliza agregando algo de ácido clorhídrico líquido a la roca y observando el gas CO 2 que sale. La ecuación para la reacción química que ocurrió es
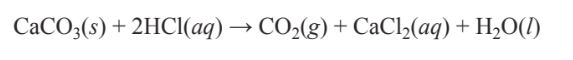
\[\ce{CaCO3(s) + 2HCl(aq) \rightarrow CO2(g) + CaCl2(aq) + H2O(l)}\]
Aquí se utilizan abreviaturas entre paréntesis para representar el estado físico de cada participante de la reacción — (s) para sólido, (ac) para una sustancia en solución, (g) para gas y (l) para líquido. La ecuación anterior establece que el carbonato de calcio sólido reacciona con una solución acuosa de ácido clorhídrico para producir gas dióxido de carbono, una solución de cloruro de calcio y agua líquida.
Las reacciones químicas a menudo son reversibles, es decir, pueden ir hacia adelante o hacia atrás. Se muestra una reacción reversible con una doble flecha, ← →. Ejemplo de Asan, considere la reacción del amoníaco disuelto, NH 3, con agua para producir ión amonio, NH4 +, e ion hidróxido, OH -.
\[\ce{NH3(aq) + H2O(l) \rightleftharpoons NH4^{+} (aq) + OH^{-} (aq)}\]
En realidad, solo una pequeña fracción de las moléculas de NH 3 experimentan esta reacción en un momento dado, y las que se convierten en NH 4 + se convierten rápidamente de nuevo en NH 3. La doble flecha en la ecuación química muestra que ocurren tanto los procesos hacia adelante como hacia atrás. Otro símbolo que a veces se utiliza en las ecuaciones químicas es el de. Este símbolo denota que se aplica calor para hacer que la reacción química ocurra a un ritmo más rápido. Normalmente se coloca sobre la flecha en la reacción química. Las ecuaciones químicas se utilizan para calcular las cantidades de sustancias químicas involucradas en una reacción química, ya sea como reactivos o como productos. Esta es una importante área de la química que es abordada por el tema de la estequiometría discutido más adelante en este capítulo en la Sección 5.8.


