9.1: H2o - Fórmula simple, Molécula notable
- Page ID
- 70217
El agua compone la hidrosfera, la cual se describe y discute en la Sección 8.2. Este capítulo amplía esa discusión y el papel crucial del agua en el medio ambiente. En este capítulo y en otras partes del libro se emplea el término agua natural en referencia al agua que ocurre en el medio ambiente en comparación con el agua en la antrosfera, como el agua en los sistemas municipales de distribución de agua. El agua tiene un lugar especial en los organismos vivos y el medio ambiente. La calidad y disponibilidad del agua son de suma importancia para los humanos y el medio ambiente. Aunque escasa y muy contaminada en muchas partes del mundo, el agua es posiblemente la más reciclable de las sustancias que componen el capital verde de la Tierra y se la describe con precisión como la sustancia verde definitiva.
Este capítulo aborda aspectos importantes de la sustentabilidad del agua. El primero de ellos es la contaminación del agua, que degrada la calidad del agua y puede hacer que no sea apta para su uso o para soportar la vida. La segunda área importante abordada es cómo se puede mantener y mejorar la calidad del agua, en gran parte a través de diversos procesos de tratamiento de agua. Una tercera área importante es la prevención de la contaminación del agua y una cuarta es el reciclaje del recurso hídrico, que podría decirse que es el material más reciclable de la naturaleza.
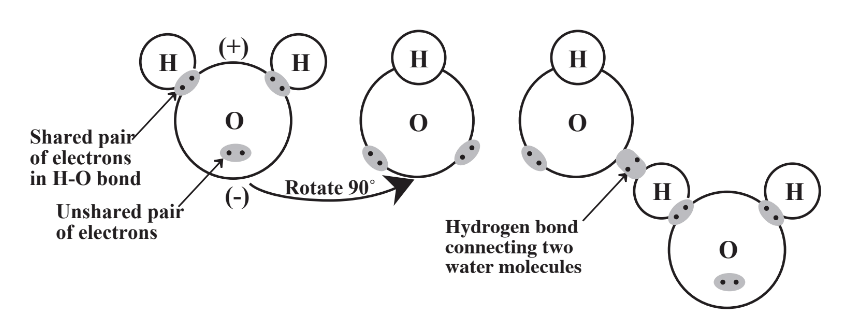
La fórmula química del agua, H 2 O, es probablemente la más conocida de todos los compuestos. Esta fórmula simple representa una sustancia que es única y compleja en su comportamiento. Estas propiedades especiales se deben a la estructura molecular de la molécula H 2 O representada en la Figura 9.1. Hay cuatro pares de electrones en la capa externa de electrones del átomo O en la molécula H 2 O, dos de los cuales componen los enlaces entre los átomos H y O y dos de los cuales son pares solitarios. La distribución de estos pares lo más separados posible alrededor de una esfera imaginaria que representa la capa externa de electrones de los átomos de O da como resultado que los dos enlaces H-O estén ubicados en un ángulo y no en una línea recta. El lado de la molécula con los dos átomos de H tiene una carga positiva parcial y el lado con los dos pares no ligantes tiene una carga negativa parcial, por lo que la molécula es polar. Esta polaridad y la capacidad de los átomos de H en una molécula para formar enlaces de hidrógeno a átomos de O en otras moléculas determinan la notable diversidad química y física del agua.
Especialmente debido a su capacidad de enlace de hidrógeno, las moléculas de agua se sienten fuertemente atraídas entre sí. Esto significa que se debe poner una gran cantidad de energía térmica en una masa de agua para permitir que las moléculas se muevan más rápidamente a medida que aumenta la temperatura. Esto le da al agua una capacidad calorífica muy alta. Se debe poner una cantidad muy grande de energía en una masa de hielo para romper los enlaces de hidrógeno que mantienen las moléculas en su lugar en el sólido a medida que se derrite y se libera una cantidad igualmente grande de energía térmica cuando el agua líquida se congela. Así, el agua tiene un calor latente de fusión muy alto. Se requiere aún más energía por unidad de masa para convertir el agua líquida en vapor (vapor) y se libera una cantidad igual de energía cuando el vapor de agua se condensa en líquido. Esto significa que el agua tiene un calor de vaporización muy alto.
La capacidad del agua para absorber, liberar y almacenar calor es crucial para su papel en el medio ambiente y sus usos prácticos. 1 La alta capacidad calorífica del agua estabiliza las temperaturas de los organismos y áreas geográficas. El vapor producido en una caldera puede transferirse a través de tuberías aisladas a ubicaciones remotas y condensarse para liberar calor. El calor liberado cuando el agua atmosférica se condensa calienta el aire circundante y es la fuerza impulsora detrás de las tormentas tropicales. Europa debe su clima relativamente suave a pesar de sus latitudes septentrionales al calor transportado por el agua a través del Océano Atlántico Norte desde el Golfo de México. A medida que el agua libera calor y se enfría a lo largo de las costas europeas, su densidad aumenta y fluye a profundidades oceánicas más bajas de regreso al Golfo de México para repetir el ciclo. El alto calor latente de fusión del agua estabiliza las temperaturas de los cuerpos de agua en el punto de congelación del agua (0° C).
Además de las enumeradas anteriormente, existen otras cualidades únicas y ambientalmente importantes del agua. Es un excelente solvente, especialmente para sustancias iónicas, por lo que es importante en el transporte de nutrientes y desechos en la biosfera y en la disolución, transporte y deposición de minerales en la geosfera. El agua tiene una tensión superficial muy alta, un factor controlador en fisiología y una propiedad involucrada en la formación de gotas en la lluvia. La relación temperatura/densidad del agua provoca que los cuerpos de agua se estratificen (ver Figura 9.4), una propiedad que afecta fuertemente el comportamiento químico del agua en cuerpos de agua estratificados. El hecho de que la densidad máxima del agua se presente como un líquido a 4° C significa que el hielo sólido flota. Si ese no fuera el caso, los cuerpos de agua en climas del norte se convertirían en sólidos congelados con solo una capa superficial que se descongelaba durante el verano. El agua es en gran parte transparente a la luz visible, lo que puede penetrar el líquido a cierta profundidad y permitir que el fitoplancton fotosintético y algunas plantas de raíces inferiores en regiones de aguas poco profundas realicen la fotosíntesis y produzcan la biomasa que es la base de las cadenas alimentarias acuáticas (ver Sección 8.5).


