9.3: Química del Agua
- Page ID
- 70249
Algunos de los fenómenos químicos y bioquímicos que ocurren en el agua se ilustran en la Figura 9.4. 2 Físicamente, el cuerpo de agua que se muestra se estratifica durante los meses de verano con un epilimnion más cálido y menos denso flotando sobre un hipolimnión más frío y denso, con poca mezcla entre ambos. El epilimnion está en contacto con la atmósfera y tiene un contenido significativo de oxígeno disuelto. Por lo tanto, las especies inorgánicas oxidadas predominan en el epilimnion. El hipolimnión es anóxico porque los microorganismos consumen todo el O 2 disuelto en él y no está en contacto con la atmósfera. Las especies inorgánicas reducidas predominan en el hipolimnión. Un factor importante en la química de este sistema es la producción bioquímica fotosintética de materia orgánica representada {CH 2 O}. La materia orgánica es un agente reductor bioquímico y cuando se hunde en el hipolimnión se oxida por procesos mediados por microorganismos que, por ejemplo, reducen NO 3 - y SO 4 2- a NH 4 + y H 2 S, respectivamente. Dos importantes reacciones de oxidación-reducción mediadas microbialmente de {CH 2 O} son la reacción con O 2 disuelto,
\[\ce{(CH2O) + O_{2} \rightarrow CO2 + H2O}\]
que agota el oxígeno disuelto en el agua haciendo que la hipolimnión sea anóxica y la fermentación del metano,
\[\ce{2(CH2O) \rightarrow CH4 + CO2}\]
que produce gas metano combustible. La capacidad de {CH 2 O} para reaccionar con O 2 disuelto es una medida del potencial del agua para agotarse en el oxígeno que necesitan los peces y otros organismos acuáticos y se expresa como la demanda bioquímica de oxígeno, DBO, una importante calidad del agua parámetro.
La producción bioquímica fotosintética de biomasa da como resultado algunas reacciones químicas importantes. Como se ilustra en la Figura 9.4, las algas utilizan el ion HCO 3 disuelto como fuente de carbono y al hacerlo producen ion carbonato, CO 3 2-. Dos reacciones adicionales de ion carbonato se muestran en la Figura 9.4. Una es su reacción de hidrólisis con moléculas de H 2 O de nuevo a HCO 3, con producción de iones OH. Esto hace que el agua sea básica, una importante reacción acuática ácido-base. Una segunda reacción del carbonato es aquella con Ca 2 + disuelto para producir CaCo 3 sólido, una importante reacción de precipitación en agua que ha sido responsable de la formación de grandes yacimientos de piedra caliza.
Todas las principales reacciones de oxidación-reducción en el agua natural son llevadas a cabo por microorganismos que actúan como catalizadores y extraen la energía liberada por las reacciones. Un ejemplo mostrado en la Figura 9.4 es la reducción bioquímica de SO 4 2- a H 2 S. en la que el sulfato actúa como agente oxidante para oxidar biomasa ({CH 2 O}) en ausencia de O 2 molecular. Teniendo lugar en el hipolimnión y sedimentos, esta reacción es responsable del mal olor a sulfuro de hidrógeno en algunos cuerpos de agua y pantanos.
Otro fenómeno importante en el agua natural y las aguas residuales es la formación de quelatos metálicos en los que los iones metálicos se unen en dos o más lugares por sustancias orgánicas. Las sustancias húmicas producidas por la biodegradación parcial de la biomasa son moléculas orgánicas grandes complejas con numerosas estructuras de anillos aromáticos que contienen oxígeno en grupos funcionales incluyendo carboxilo (-CO2H) e hidroxilo fenólico (-OH). Estos grupos pueden perder H+ para producir grupos cargados negativamente capaces de unirse con iones metálicos como se muestra a continuación para la quelación del ion Fe 2 +:
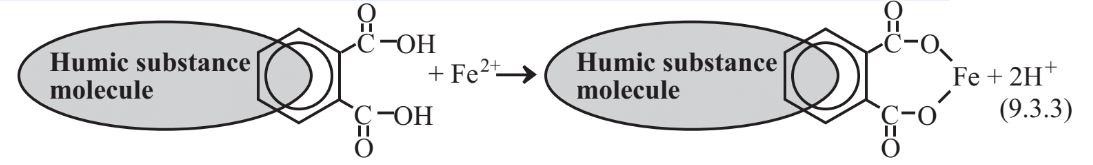
Las sustancias húmicas más importantes en el agua son los ácidos fúlvicos de menor masa molecular. Estas especies tienden a quelar el ion Fe 2 + produciendo un material amarillo llamado gelbstoffe (en alemán para “material amarillo)”. Los iones metálicos unidos con ácido fúlvico son difíciles de eliminar del agua y, dado que el hierro es una impureza de agua muy indeseable, pueden requerirse medidas drásticas como la destrucción del ácido fúlvico con cloro para eliminar el hierro quelatado.
Interacciones de fase en química acuática
La Figura 9.4 ilustra el proceso de intercambio de solutos disueltos en agua con sedimentos. Las interacciones entre el agua y las fases sólidas, gaseosas y otras líquidas son muy importantes en la química acuática. Los procesos bioquímicos acuáticos implican el intercambio de materiales entre la solución acuosa y las células de microorganismos. Por ejemplo, cuando la fotosíntesis ocurre en agua (Figura 9.4), el ion HCO 3 disuelto se transfiere a una célula de fitoplancton fotosintético flotante para su conversión a biomasa. Como producto de esta reacción se libera O 2 gaseoso de la celda, parte de ella disolviéndose en agua y algunos flotando hacia la parte superior como burbujas de O 2. Como se señaló anteriormente, el ion CO 3 2- generado como subproducto de la fotosíntesis reacciona con el ion Ca 2 + disuelto para producir CaCo 3 sólido. El proceso inverso ocurre cuando el dióxido de carbono disuelto producido por bacterias reacciona con el carbonato de calcio sólido.
\[\ce{CO2(aq) + H2O + CaCO3 (s) \rightarrow Ca^{2+} (aq) + 2HCO3^{-} (aq)}\]
para poner en solución el ion calcio y el ion bicarbonato. Ambas especies son importantes en el agua. El ion Ca 2 + es responsable de la dureza del agua, llamado así por una tendencia a formar precipitados con aniones de jabón que son inútiles para la limpieza, y HCO 3 - es la alcalinidad del agua, la capacidad de neutralizar los ácidos.
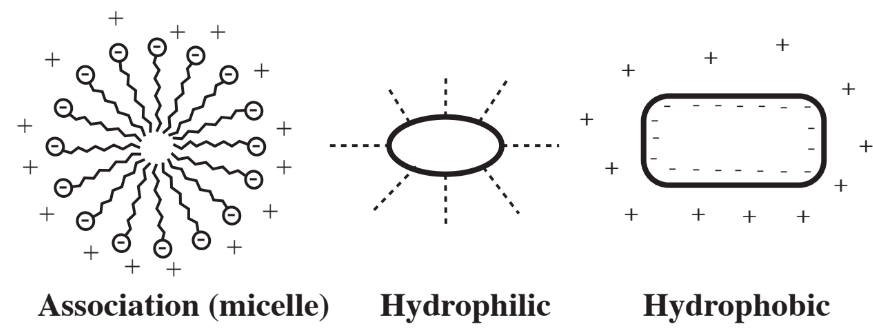
Un tipo particular de fase que interactúa con el agua consiste en partículas coloidales, que son partículas muy pequeñas del orden de un micrómetro de tamaño que se suspenden en agua. Existen tres tipos de partículas coloidales como se muestra en la Figura 9.5. Existen muchos materiales importantes como partículas coloidales en el agua, incluyendo células bacterianas y de algas, minerales de arcilla, jabón y una variedad de contaminantes. El comportamiento de los coloides es intermedio entre el de las soluciones verdaderas y los materiales a granel como los de los sedimentos. Este comportamiento está fuertemente influenciado por la muy alta relación superficie-volumen de los coloides. La agregación de partículas coloidales es un aspecto importante y a menudo desafiante del tratamiento del agua, por ejemplo en la sedimentación y separación de microorganismos involucrados en el tratamiento biológico de aguas residuales.
Fenómenos ácido-base en el agua
El agua natural casi siempre contiene ácidos capaces de liberar iones H + y puede contener solutos que pueden aceptar iones H + y así actuar como bases. La sustancia ácida más común en el agua es el CO 2 disuelto, que puede ingresar al agua desde la atmósfera o en concentraciones más altas como producto de la descomposición microbiana de la materia orgánica. El dióxido de carbono disuelto produce iones H + mediante la siguiente reacción con agua:
\[\ce{CO2 (aq) + H2O \leftrightarrows H+ + HCO3^{-}}\]
Las flechas dobles denotan que la reacción es reversible. Dado que el dióxido de carbono es un ácido débil, el equilibrio de la reacción se encuentra a la izquierda expresado por la siguiente constante de disociación ácida en la que pK a1 = -logK a1:
\[\K_{a1} = \frac{[H^{+}][HCO_{3}^{-}]}{[CO_{2}]} = 4.45 \times 10^{-7} \: \: \: pK_{a1} = 6.35\]
El ion HCO 3 también puede perder H +:
\[\ce{HCO3^{-} \leftrightarrows H+ + CO3^{2-}}\]
\[K_{a2} = \frac{[H^{+}][CO_{3}^{2-}]}{[HCO_{3}^{-}]} = 4.69 \times 10^{-11} \: \: \: pK_{a2} = 10.33\]
De lo contrario, el agua pura en equilibrio con el aire contiene algo de CO 2 disuelto de la atmósfera, que es de 390 partes por millón de CO 2 en volumen. Los cálculos de solubilidad se pueden utilizar para mostrar que la concentración de dióxido de carbono disuelto en agua, [CO 2 (aq)], en equilibrio con el aire es de 1.276×10 -5 M (moles/litro). Cuando cada CO 2 reacciona con H 2 O, se producen un H + y un HCO 3. Sustitución en la expresión constante de equilibrio Ecuación 9.3.6 conduce a [H +] =2.38×10 -6 M, pH = 5.62, ligeramente más ácido que pH neutro 7. Por lo tanto, el agua de lluvia es naturalmente ligeramente ácida. El agua natural con un pH inferior a 5.62 probablemente contenga ácido fuerte contaminante, más comúnmente H 2 SO 4 de lluvia ácida.
La mayor parte del agua que ha estado en contacto con la geosfera contiene alcalinidad, la capacidad de reaccionar con el ion H + y neutralizar la acidez. Generalmente, la alcalinidad se debe a la presencia del ion HCO 3, el cual experimenta la siguiente reacción con el ion H +:
\[\ce{HCO3^{-} + H^{+} \rightarrow CO2 + H2O}\]
La alcalinidad se introduce normalmente en agua mediante la reacción del CO 2 disuelto con el mineral CaCo 3 como se muestra en la Reacción 9.3.4. Debido a la presencia de alcalinidad, la mayoría de las aguas naturales como las que se utilizan para abastecer a los sistemas de agua municipales son ligeramente básicas con un pH alrededor de 8 en lugar de ser ligeramente ácidas como el agua de lluvia.


