10.11: Smog fotoquímico
- Page ID
- 69725
Uno de los problemas más comunes de contaminación del aire urbano es la producción de smog fotoquímico. Esta condición ocurre en masas de aire secas y estancadas, generalmente estabilizadas por una inversión de temperatura (ver Figura 8.1), que son sometidas a luz solar intensa. Una atmósfera ahumada contiene ozono, O 3, oxidantes orgánicos, óxidos de nitrógeno, aldehídos y otras especies nocivas. En las últimas etapas de formación de smog, la visibilidad en la atmósfera se reduce por la presencia de una neblina de partículas finas formadas por la oxidación de compuestos orgánicos en el smog.
Los ingredientes químicos del smog son los óxidos de nitrógeno y los compuestos orgánicos, ambos liberados del automóvil, así como de otras fuentes. La fuerza de energía impulsora detrás de la formación de smog es la radiación electromagnética con una longitud de onda de alrededor de 400 nm o menos, en la región ultravioleta, justo más corta que el límite inferior para la luz visible. La energía absorbida por una molécula a partir de esta radiación puede dar lugar a la formación de especies activas, iniciando así reacciones fotoquímicas.
Si bien el metano, CH 4, es uno de los hidrocarburos menos activos en términos de formación de smog, se utilizará aquí para mostrar el proceso de formación de smog porque es la molécula de hidrocarburo más simple. El smog se produce en una serie de reacciones en cadena. El primero de estos ocurre cuando un fotón de radiación electromagnética con una longitud de onda inferior a 398 nm es absorbido por una molécula de dióxido de nitrógeno.
\[\ce{NO2 } h \nu \rightarrow \ce{NO + O}\]
para producir un átomo de oxígeno, O. El átomo de oxígeno es una especie muy reactiva que puede extraer un átomo de hidrógeno del metano,
\[\ce{CH4 + O \rightarrow HO \cdot + H3C \cdot}\]
para producir un radical metilo, H3C•, y un radical hidroxilo, HO•. En estas fórmulas, el punto muestra un solo electrón desapareado. Una especie química con tal electrón único es un radical libre. El radical hidroxilo es especialmente importante en la formación de smog y en una amplia variedad de otros tipos de reacciones fotoquímicas. El radical metilo puede reaccionar con una molécula de oxígeno,
\[\ce{H3C \cdot + O2 \rightarrow H3COO \cdot}\]
para producir un radical metilperoxilo, H3COO•. Se trata de una especie fuertemente oxidante y reactiva. Una de las reacciones muy importantes de los radicales peroxilo es su reacción con NO, producida en la disociación fotoquímica del NO 2 (ver Reacción 8.10.1 anterior),
\[\ce{NO + H3COO \cdot \rightarrow NO2 + H3COO \cdot}\]
Regenerar NO 2, que puede sufrir fotodisociación, reiniciando la serie de reacciones en cadena por las que se forma el smog. Literalmente pueden ocurrir cientos de otras reacciones, conduciendo eventualmente a materia orgánica oxidada que produce la pequeña materia particulada característica del smog.
A medida que se produce el proceso de formación de smog, se generan numerosos intermedios nocivos. Una de las principales es el ozono, O 3, y es la especie única más característica del smog. Mientras que el ozono es una especie esencial en la estratosfera, donde filtra la radiación ultravioleta indeseable, es una especie tóxica en la troposfera que es mala tanto para animales como para plantas. Otra clase de materiales formados con smog consiste en compuestos orgánicos ricos en oxígeno que contienen nitrógeno de los cuales nitrato de peroxiacetilo, PAN,
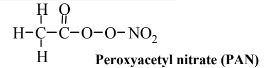
es el ejemplo más común. Este compuesto y otros similares a él son potentes oxidantes y altamente irritantes para los ojos y las membranas mucosas de las vías respiratorias. También se asocian con el smog los aldehídos, que son irritantes para los ojos y las vías respiratorias. El aldehído más simple, y uno que se encuentra comúnmente en atmósferas ahumadas, es el formaldehído:

Efectos nocivos del smog
El smog afecta negativamente la salud y el confort humanos, las plantas, los materiales y la calidad atmosférica. Cada uno de estos aspectos se aborda brevemente aquí. El ozono es el constituyente de smog que generalmente se considera más dañino para los humanos, las plantas y los materiales, aunque otros oxidantes y algunos de los materiales orgánicos nocivos, como los aldehídos, también lo son. Las personas expuestas a 0.15 partes por millón de ozono en el aire experimentan irritación en los tejidos mucosos respiratorios acompañada de tos, sibilancias y constricción bronquial. Estos efectos pueden ser especialmente pronunciados para individuos que se someten a ejercicio vigoroso debido a las grandes cantidades de aire que inhalan. En días de niebla, las alertas de contaminación del aire pueden desaconsejar el ejercicio y las actividades al aire libre Debido a estos efectos, la Agencia de Protección Ambiental de Estados Unidos recomienda un límite estándar de 8 horas para el ozono de 0.075 ppm y está considerando reducir aún más el estándar. En una atmósfera de humo, los efectos adversos del ozono se ven agravados por la exposición a otros oxidantes y aldehídos.
Las plantas son dañadas por la exposición a óxidos de nitrógeno, ozono y nitrato de peroxiacetilo (PAN, ver arriba), todos los oxidantes presentes en una atmósfera ahumada. El PAN es el más dañino de estos constituyentes, dañando especialmente las hojas de las plantas más jóvenes. La exposición al ozono provoca la formación de manchas amarillas en las hojas, una condición llamada punteado clorótico. Algunas especies de plantas, como la lechuga de hoja de espada, la solana negra, la almidera y el tomate de doble fortuna, son extremadamente susceptibles al daño por especies oxidantes en el smog y se utilizan como bioindicadores de la presencia de smog. Los costos de daños en cultivos y huertos por smog alcanzan millones de dólares al año en áreas propensas a este tipo de contaminación del aire, como el sur de California.
Los materiales que se ven afectados negativamente por el smog son generalmente aquellos que son atacados por oxidantes. El mejor ejemplo de tal material es el caucho, especialmente el caucho natural, que es atacado por el ozono. De hecho, el endurecimiento y agrietamiento del caucho natural se ha utilizado como prueba para el ozono atmosférico.
Las partículas de aerosol atmosféricas que reducen la visibilidad son la manifestación más común del daño causado a la calidad atmosférica por el smog. El proceso de formación de smog ocurre por la oxidación de materiales orgánicos en la atmósfera, y los materiales orgánicos que contienen carbono son los constituyentes más comunes de las partículas de aerosol en una atmósfera afectada por el smog. Los árboles de coníferas (pino y ciprés) y los cítricos son los principales contribuyentes a los hidrocarburos orgánicos que son precursores de la formación de partículas orgánicas en el smog.
Prevenir el smog con química verde
El smog es básicamente un problema químico, lo que indicaría que debería ser susceptible de soluciones químicas. En efecto, la práctica de la química verde y la aplicación de los principios de la ecología industrial pueden ayudar a reducir el smog. Esto se debe en gran parte a que una premisa básica de la química verde es evitar la generación y liberación de especies químicas con el potencial de dañar el medio ambiente. La mejor manera de prevenir la formación de smog es evitar la liberación de óxidos de nitrógeno y vapores orgánicos que permiten la formación de smog. A un nivel aún más fundamental, se pueden tomar medidas para evitar el uso de tecnologías susceptibles de liberar tales sustancias, por ejemplo, mediante el uso de alternativas a los automóviles contaminantes para el transporte.
La evolución de los dispositivos de control de contaminación automotriz para reducir el smog proporciona un ejemplo de cómo se puede usar la química verde para reducir la contaminación. Las primeras medidas tomadas para reducir las emisiones de hidrocarburos y óxidos de nitrógeno de los automóviles fueron en gran medida medidas de mando y control y de “fin de tubería”. Estas medidas primitivas implementadas a principios de los 70 sí redujeron las emisiones, pero con una fuerte penalización en el consumo de combustible y en el rendimiento de conducción de los vehículos. Sin embargo, en las últimas tres décadas, el motor del automóvil de combustión interna se ha convertido en una máquina altamente sofisticada controlada por computadora que generalmente funciona bien, emite pocos contaminantes del aire y es altamente eficiente. (Y sería mucho más eficiente si aquellos conductores que sienten que deben conducir a los “utilitarios deportivos”, cambiaran a vehículos de un tamaño más sensato). Este cambio ha requerido un enfoque integrado que implica la reformulación de la gasolina. El primer cambio importante fue la eliminación de la gasolina del tetraetilplomo, un compuesto organometálico que envenenó los catalizadores de escape automotriz (y ciertamente no fue bueno para las personas). La gasolina también se reformuló para eliminar hidrocarburos excesivamente volátiles e hidrocarburos insaturados (aquellos con dobles enlaces entre átomos de carbono) que son especialmente reactivos en la formación de smog fotoquímico.
Un enfoque aún más drástico para eliminar las emisiones formadoras de smog es el uso de automóviles eléctricos que no queman gasolina. Estos vehículos ciertamente no contaminan ya que están siendo conducidos, pero sufren el problema probablemente irresoluble de un rango muy limitado entre cargas y la necesidad de baterías relativamente pesadas. Sin embargo, los automóviles híbridos que utilizan un pequeño motor de gasolina o diesel que proporciona electricidad para impulsar motores eléctricos que impulsan el automóvil y para recargar baterías relativamente más pequeñas pueden remediar en gran medida los problemas de emisión y economía de combustible con los automóviles. El motor de combustión interna de estos vehículos funciona sólo cuando es necesario para proporcionar potencia y, al hacerlo, puede funcionar a una velocidad relativamente uniforme que proporciona la máxima economía con emisiones mínimas.
Otro enfoque que se está utilizando en vehículos tan grandes como los autobuses que tienen acceso conveniente y frecuente a las estaciones de servicio es el uso de celdas de combustible que pueden generar electricidad directamente a partir de la combinación catalítica de hidrógeno elemental y oxígeno, produciendo solo agua inofensiva como producto (ver Capítulo 16). También hay procesos catalíticos que pueden generar hidrógeno a partir de combustibles líquidos, como el metanol, de manera que los vehículos que transportan dicho combustible puedan ser alimentados por electricidad generada en celdas de combustible.
La química ecológica se puede aplicar a dispositivos y procesos distintos de los automóviles para reducir las emisiones de formación de humo. Esto es especialmente cierto en el área de solventes orgánicos utilizados para la limpieza de piezas y otras operaciones industriales, cuyos vapores a menudo se liberan a la atmósfera. La sustitución del agua con aditivos adecuados o incluso el uso de fluido de dióxido de carbono supercrítico puede eliminar tales emisiones.


