15.9: Secuestro de Carbono para Utilización de Combustibles Fósiles
- Page ID
- 70164
Los combustibles fósiles se pueden utilizar de manera sostenible mediante el empleo de secuestro de carbono para retener el dióxido de carbono de gases de efecto invernadero producido en la combustión de combustibles o la conversión de carbón, lo que al evitar que el dióxido de carbono generado por los combustibles fósiles ingrese a la atmósfera, promete permitiendo la utilización de combustibles fósiles sin contribuir al calentamiento del invernadero. El dióxido de carbono puede capturarse y secuestrarse profundamente en el océano o bombearse a formaciones porosas bajo tierra. Una preocupación importante con la eliminación oceánica del dióxido de carbono es la tendencia de este gas a disminuir el pH, lo que resulta en conchas más delgadas en los mariscos.
El enfoque más prometedor para el secuestro de carbono es bombear gas dióxido de carbono a formaciones subterráneas a profundidades superiores a 1000 metros. Si las formaciones se superponen con capas impermeables de roca que no son violadas por pozos petroleros abandonados indebidamente, el dióxido de carbono permanecerá en su lugar indefinidamente. El secuestro es ayudado por la presencia de agua subterránea salina y por la reacción química con minerales.
El dióxido de carbono del gas natural que contiene un alto contenido de CO 2 ha sido secuestrado desde 1996 en el yacimiento de petróleo y gas de Sleipner a unos 240 km de la costa noruega. El gas se bombea a la formación de arenisca Utsira de 200 m de espesor ubicada a unos 1000 km por debajo del fondo marino. Una mezcla de dióxido de carbono y sulfuro de hidrógeno tóxico ahora se está desechando bajo tierra en Alberta, Canadá.
El dióxido de carbono es mejor capturado y secuestrado en procesos como la fermentación de azúcares para hacer etanol que produce el gas en altas concentraciones. Debido al alto contenido de nitrógeno, los gases de escape de la combustión no son adecuados para el secuestro de dióxido de carbono. El uso de oxígeno puro en lugar de aire para la combustión produce un producto de dióxido de carbono relativamente puro y ahora se planea una planta de energía comercial que utiliza carbón quemado en oxígeno puro con el apoyo del Departamento de Energía de Estados Unidos.
El enfoque más prometedor para el secuestro de dióxido de carbono a gran escala es a través de la gasificación de carbón (ver Sección 15.8). Hay dos fuentes principales de dióxido de carbono de la gasificación del carbón. El primero de ellos es la combustión de carbón con oxidante de oxígeno puro,
\[\ce{C(coal) + O2 \rightarrow CO2 + heat}\]
que genera el calor requerido para la gasificación del residuo de carbón caliente del carbón con vapor:
\[\ce{C(coal) + H2O \rightarrow CO + H2}\]
La segunda reacción que produce dióxido de carbono es la reacción de vapor con CO para aumentar la relación de H2 a CO en el producto de gas de síntesis:
\[\ce{CO + H2O \rightarrow H2 + CO2}\]
El mayor proceso de secuestro de dióxido de carbono que ahora opera en Estados Unidos es la planta de sincombustibles Great Plains cerca de Beulah, Dakota del Norte. Esta planta gasifica 16,000 toneladas diarias de carbón lignito y envía aproximadamente 4.3 millones de metros cúbicos de dióxido de carbono por día (3 millones de toneladas al año) a través de un oleoducto de 330 km a los campos petrolíferos de Weyburn y Midale en Saskatchewan, Canadá, para su secuestro y recuperación de petróleo.
En la Figura 15.12 se muestra una planta integrada de gasificación de carbón con secuestro de dióxido de carbono. Esta planta utiliza la reacción de vapor con carbono caliente del carbón para producir hidrógeno elemental (reacción 15.9.2) y reacciona el producto de CO con vapor para producir más H 2; ambos de
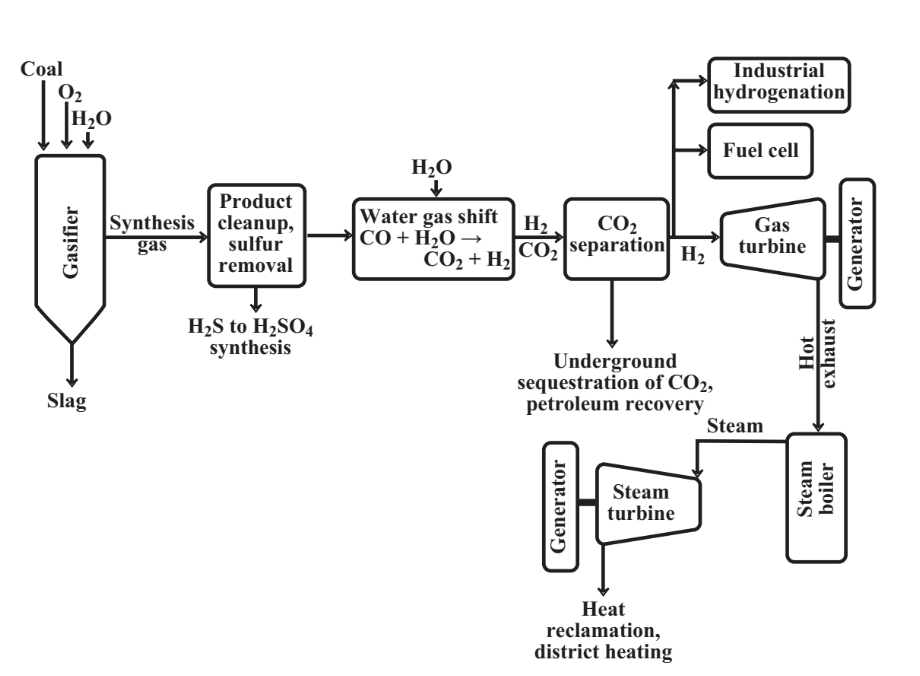
estas reacciones producen CO 2. Una turbina de gas alimentada con H 2 acoplada a un generador produce electricidad. El gas de escape caliente de la turbina de gas se utiliza para elevar el vapor en una caldera y este vapor alimenta una turbina de vapor que también está acoplada a un generador. Esta combinación da como resultado una generación de energía eléctrica muy eficiente. El elemental H 2 generado puede ser utilizado en celdas de combustible, como reactivo químico para producir combustibles hidrocarbonados sintéticos, o para sintetizar amoníaco, NH 3. Algo de amoníaco también se produce a partir del nitrógeno en el carbón durante la gasificación y se recupera como producto. El azufre, que se encuentra esencialmente en todos los carbones, se libera durante la gasificación como subproducto sulfuro de hidrógeno utilizado para elaborar ácido sulfúrico o se dispone con el subproducto de dióxido de carbono. El CO 2 se separa del gas y se bombea a alta presión hacia formaciones minerales a profundidades de hasta alrededor de 2000 m. Si estas formaciones son petroleras, el dióxido de carbono permite la recuperación de petróleo. El calor del subproducto de la planta se puede utilizar para la calefacción de distrito. Particularmente cuando se integra con recuperación de subproductos, síntesis química de NH 3 y H 2 SO 4, y calefacción de distrito, una planta integrada de este tipo es un excelente ejemplo de un sistema de ecología industrial.
Combustible de dióxido de carbono
Un interesante uso potencial del dióxido de carbono es usarlo como fuente de carbono para la síntesis de combustibles hidrocarbonados y otros compuestos orgánicos incluyendo alcoholes. El requisito para hacerlo es una fuente abundante y económica de hidrógeno elemental, H 2, que puede reaccionar con CO 2 a través de la reacción inversa de desplazamiento agua-gas: 3
\[\ce{CO2 + H2 \rightarrow CO + H2O}\]
El CO producido se puede hacer reaccionar con H 2 adicional para producir gas metano (metanación), líquidos hidrocarbonados (síntesis de Fischer-Tropsch) o alcoholes. El proceso general es el reverso de la combustión de combustibles hidrocarbonados que producen energía, por lo que consume mucha energía y requiere de una fuente de energía barata para ser práctico. La fuente de energía más probable es la energía eólica “libre” que genera electricidad que puede producir gas H 2 por electrólisis del agua (ver Reacción 15.11.1). En esta aplicación la característica intermitente de la energía eólica no es un problema y el hidrógeno producido en abundancia durante tiempos de viento fuerte puede ser bombeado bajo tierra para ser retirado para su posterior reacción con CO 2 y CO.


