3.3: Vías y procesos determinantes del destino químico
- Page ID
- 70515
3.3. Vías y procesos que determinan el destino químico
Autores: Dik van de Meent, Michael Matthies
Revisor: John Parsons
Objetivos de Inclinación:
Deberías ser capaz de
- explicar cómo la emisión de sustancias químicas al medio ambiente conduce a la exposición de ecosistemas, poblaciones y organismos, incluido el hombre.
- comprender cómo el conocimiento cuantitativo de la cinética de procesos es de utilidad en la modelización matemática del destino ambiental
- comprender el concepto de caracterización de los procesos del destino en términos de constantes de tasa y semividas
- dar ejemplos de procesos de destino relevantes y describirlos brevemente
Palabras clave: procesos del destino, degradación, transporte, partición
Caracterizando el 'destino'
Los productos químicos pueden escapar durante todas las etapas de su ciclo de vida, por ejemplo, fabricación, procesamiento, uso o eliminación. La liberación de sustancias químicas en el medio ambiente necesariamente conduce a la exposición de ecosistemas, poblaciones y organismos, incluido el hombre. La ciencia de evaluación de la exposición busca analizar, caracterizar, comprender y (cuantitativamente) describir las vías y procesos que vinculan las liberaciones con la exposición. Los químicos en el ambiente se someten a diversos procesos de transporte, transferencia y degradación, los cuales pueden describirse y cuantificarse en términos de tasas de pérdida, es decir, las tasas a las que los químicos se pierden del compartimento ambiental al que se emiten o se transfieren desde los compartimentos adyacentes. La ciencia de la evaluación de la exposición tiene como objetivo capturar el 'destino ambiental' de los químicos en descripciones de procesos que pueden ser utilizadas en el modelado de balance de masas, utilizando expresiones matemáticas tomadas de leyes termodinámicas y cinéticas de reacción química (Trapp y Matthies, 1998).
El 'destino' de una sustancia química en el medio ambiente puede considerarse como el resultado neto de un conjunto de procesos de transporte, transferencia y degradación (ver Sección 3.4 sobre constantes de partición y partición, Sección 3.6 sobre disponibilidad y biodisponibilidad, Sección 3.7 sobre degradación ) que comiencen a actuar sobre el químico directamente después de su emisión (ver Sección 3.2 sobre fuentes de emisión) y durante la posterior distribución ambiental. El modelado del destino ambiental (ver Sección 3.8 sobre modelización de balance de masas multimedia) se basa en este conocimiento mediante la implementación de los diversos procesos de degradación, transferencia y transporte derivados en la ciencia de evaluación de la exposición en modelos matemáticos que simulan 'destino de los químicos en el ambiente'
Cinética de primer orden
En la cinética de reacción química, la cantidad de sustancia química en un 'sistema' (por ejemplo, un volumen de agua superficial) se describe mediante ecuaciones de balance de masas del tipo:
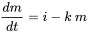 (eq. 1)
(eq. 1)
donde 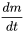 es la velocidad de cambio (kg.s -1) de la masa (kg) de químico en el sistema a lo largo del tiempo t (s), i es la velocidad de entrada (kg.s -1) y k (s -1) es la constante de velocidad de reacción. Matemáticamente, esta ecuación es una ecuación diferencial de primer orden en m, lo que significa que la tasa de pérdida de masa del sistema es proporcional a la primera potencia de m. La Ecuación 1 se aplica ampliamente en la descripción y caracterización de procesos de destino ambiental: los procesos de destino ambiental generalmente obedecen a la cinética de primer orden, y generalmente se pueden caracterizar por una constante de velocidad de reacción de primer orden k 1st:
es la velocidad de cambio (kg.s -1) de la masa (kg) de químico en el sistema a lo largo del tiempo t (s), i es la velocidad de entrada (kg.s -1) y k (s -1) es la constante de velocidad de reacción. Matemáticamente, esta ecuación es una ecuación diferencial de primer orden en m, lo que significa que la tasa de pérdida de masa del sistema es proporcional a la primera potencia de m. La Ecuación 1 se aplica ampliamente en la descripción y caracterización de procesos de destino ambiental: los procesos de destino ambiental generalmente obedecen a la cinética de primer orden, y generalmente se pueden caracterizar por una constante de velocidad de reacción de primer orden k 1st:
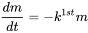 (eq. 2)
(eq. 2)
Dichas ecuaciones con clasificación de pérdida también se pueden formular en formato integral, el cual se obtiene mediante la integración de la ecuación (2) a lo largo del tiempo t con la masa inicial m 0 = m (0):
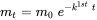 (eq. 3)
(eq. 3)
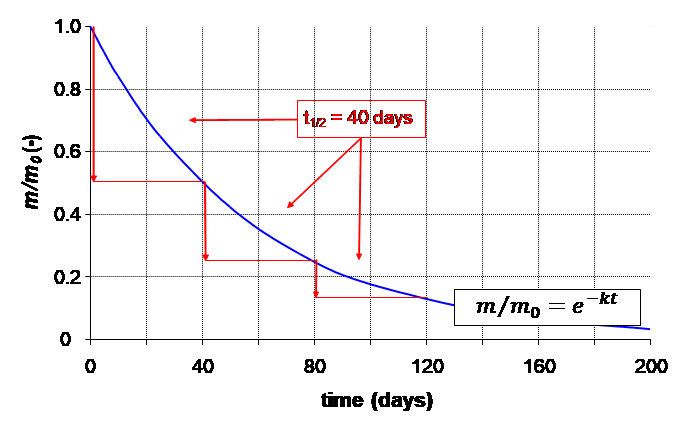
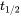 =40 días).
=40 días). Como se muestra en la Figura 1, se espera que los procesos de pérdida de primer orden den como resultado una disminución exponencial de la masa a partir de la cual se puede calcular la concentración dividiendo m con el volumen del compartimento. Usando el valor 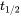 para t en la ecuación 3, se deduce directamente que el valor de
para t en la ecuación 3, se deduce directamente que el valor de 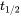 es inversamente proporcional a la constante de tasa de pérdida de primer orden
es inversamente proporcional a la constante de tasa de pérdida de primer orden 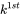 :
:
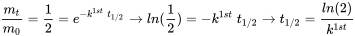 (eq. 4)
(eq. 4)
lo que muestra esa constante de tiempo de semivida, es decir, independiente de la concentración del químico considerado. Este es el caso de todos los procesos de pérdida ambiental que obedecen a la cinética de primer orden. Por lo tanto, los procesos de pérdida de primer orden pueden caracterizarse suficientemente por el tiempo requerido para la desaparición del 50% de la cantidad originalmente presente.
El tiempo de desaparición DT50 se utiliza a menudo en la regulación ambiental, pero solo es idéntica a la vida media si el proceso de pérdida es de primer orden. Nótese que la suposición silenciosa de la constancia de la vida media implica que se supone que el proceso considerado obedece a la cinética de primer orden.
Reacciones químicas abióticas
La ocurrencia de una verdadera cinética de reacción de primer orden en la química es rara (ver Sección 3.7 sobre degradación). Ocurre sólo cuando las sustancias se degradan espontáneamente, sin interacción con otros químicos. Un buen ejemplo es la desintegración radiactiva de los elementos, con una velocidad de reacción proporcional a la (primera potencia de) la concentración (masa) del elemento en descomposición, como en la ecuación 3.
La mayoría de las reacciones químicas entre dos sustancias son de segundo orden:
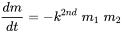 (eq. 5)
(eq. 5)
o, cuando un químico reacciona consigo mismo:
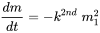 (eq. 6)
(eq. 6)
porque la velocidad de reacción es proporcional a las concentraciones (masas) de ambos reactivos. Se desprende directamente de la ecuación 2. A medida que las concentraciones (masas) de ambos reactivos disminuyen como resultado de la reacción, la velocidad de reacción disminuye durante la reacción, más rápidamente por lo que a altas concentraciones iniciales. Cuando se aplica cinética de segundo orden, la vida media no es constante, sino que aumenta con la reacción en curso, cuando las concentraciones disminuyen. En principio, este es el caso de la mayoría de las reacciones químicas, en las que el químico considerado se transforma en otra cosa por reacción con un agente químico transformante.
En el ambiente, la disponibilidad del segundo reactivo (agente transformante) suele estar en exceso, por lo que su concentración permanece casi inafectada por la reacción de transformación en curso. Este es el caso, para la oxidación (reacción con oxígeno) y la hidrólisis (reacción con agua). En estos casos, la velocidad de reacción disminuye con la concentración decreciente del primer químico solamente:
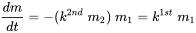 (eq. 7)
(eq. 7)
y la cinética de reacción se vuelve prácticamente de primer orden: la llamada cinética de pseudo primer orden. La pseudo cinética de primer orden de los procesos de transformación química es muy común en el ambiente.
Reacción química biótica
Las reacciones químicas en la biosfera suelen ser catalizadas por enzimas. Este tipo de reacción es saturable y la cinética puede ser descrita por el modelo cinético de Michael-Menten para reacciones de sustrato único. A bajas concentraciones, no hay efecto de saturación de la enzima y se puede suponer que la reacción sigue la cinética (pseudo) de primer orden. A concentraciones lo suficientemente altas como para saturar la enzima, la velocidad de reacción es independiente de las concentraciones (masas) de los reactivos, por lo tanto constante en el tiempo durante la reacción, y la reacción obedece a la cinética de orden cero. Esto es cierto para la catálisis, donde la velocidad de reacción depende solo de la disponibilidad del catalizador (generalmente la superficie reactiva):
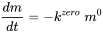 = constante. (eq. 8)
= constante. (eq. 8)
Se podría decir que la tasa es proporcional a la potencia de orden cero de la masa de reactivo presente. En caso de cinética de orden cero, los tiempos de vida media son más largos para mayores concentraciones iniciales de sustancia química.
Un ejemplo de cinética de reacción de orden cero es la transformación del alcohol (etanol) en el hígado. Se ha trabajado teórica y experimentalmente que los hígados humanos eliminan el alcohol de la sangre a un ritmo constante, independientemente de la cantidad de alcohol consumido.
Degradación microbiana
La degradación microbiana (a menudo denominada biodegradación) es un caso especial de cinética de transformación biótica. Aunque se trata de un proceso enzimáticamente catalizado, el proceso de transformación microbiana puede considerarse como el resultado del encuentro de moléculas de sustancia química con células microbianas, lo que debería dar como resultado una cinética aparente de segundo orden (primer orden con respecto al número de células microbianas presentes, y primer orden con respecto a la masa de sustancia química presente):
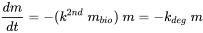 (eq. 9)
(eq. 9)
donde m bio representa la concentración (masa) de bacterias activas presentes en las aguas superficiales naturales, y k grados representa una constante de velocidad de degradación de pseudo-primer orden.
Transporte advectivo y dispersivo
Los químicos pueden ser trasladados de un punto local a otro por las corrientes de viento y agua. Advección significa transporte a lo largo del eje de corriente, mientras que la dispersión es el proceso de mezcla turbulenta en todas las direcciones. Los procesos de avance son impulsados por fuerzas externas como el viento y la velocidad del agua, o la gravedad como la caída de lluvia y la lixiviación en el suelo. En la mayoría de los modelos de exposición, estos procesos se describen de manera simplificada, por ejemplo, el modelo de penacho de aire dispersivo. Un ejemplo de un proceso de pérdida advectiva de primer orden es la salida de un químico de un lago:
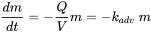 (eq. 10)
(eq. 10)
donde Q representa el caudal de agua del lago [m³/s] y V es el volumen del lago [m³]. Q/V se conoce como la constante de tasa de renovación k adv del medio de transporte, aquí agua. Los modelos hidrológicos, atmosféricos o de lixiviación de suelos más sofisticados consideran una resolución espacial y temporal detallada, que requieren muchos más datos y un mayor esfuerzo de computación matemática (ver secciones 3.1.2 y 3.8.2).
Transferencia y partición
Debido a la primera ley de Fick, la velocidad de transferencia a través de una interfaz entre dos medios (por ejemplo, agua y aire, o agua y sedimento) es proporcional a la diferencia de concentración del químico en los dos medios (ver sección 3.4 sobre partición, y Schwarzenbach et al., 2017 para mayor lectura). Mientras la concentración en un medio sea mayor que en el otro, es probable que más moléculas pasen a través de la interfaz. Ejemplos son la volatilización de productos químicos del agua (al aire) y la absorción de gas del aire (al agua o al suelo), la adsorción del agua (a los sedimentos, los sólidos suspendidos y la biota) y la desorción de sedimentos y otras superficies sólidas.
Cuando dos medios ambientales están en contacto directo, la transferencia (de primer orden) puede realizarse en dos direcciones, en el caso de agua y aire por volatilización y absorción de gas: Cada uno a una velocidad proporcional a la concentración de sustancia química en el medio de origen y cada uno con una constante de velocidad (de primer orden) característica de las propiedades físicas de la sustancia química y de la naturaleza de la interfaz (área, rugosidad). Esto se conoce como partición intermedia física (ver sección 3.4 sobre partición), generalmente representada por una fórmula de reacción química:
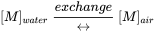 (eq. 11)
(eq. 11)
donde [M] representa una concentración (masa) (unidad de masa por unidad de volumen) y la flecha doble representa el transporte hacia adelante y hacia atrás. La partición intermedia procede espontáneamente hasta que los dos medios han llegado al equilibrio termodinámico. En el estado de equilibrio, las tasas hacia adelante y hacia atrás (aquí: volatilización de agua a aire y absorción de gas de aire a agua) se han vuelto iguales. En equilibrio, la energía total (libre de Gibbs) del sistema ha alcanzado un mínimo: el sistema ha llegado a descansar, de manera que
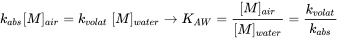 (eq. 12)
(eq. 12)
y la relación de concentraciones del químico en los dos medios ha alcanzado su valor de equilibrio (termodinámico), denominado constante de equilibrio o coeficiente de partición (ver sección 3.4 sobre partición).
Desafío
El reto para los químicos ambientales es describir y caracterizar los diversos procesos de degradación y transformación química y microbiana, de las constantes de transporte intra-media y de velocidad de transferencia intermedia y de las constantes de equilibrio, en términos de (i) propiedades físicas y químicas de los químicos considerados y ii) de las propiedades de los medios ambientales.
Referencias
Schwarzenbach, R.P., Gschwend, P.M., Imboden, D.M. (2017). Química Orgánica Ambiental, Tercera Edición, Wiley, ISBN 978-1-118-76723-8.
Trapp, S., Matthies, M. (1998). Quimiodinámica y Modelado Ambiental. Una introducción. Springer, Heidelberg, ISBN 3-540-63096-1.
Nombra y explica con tus propias palabras la propiedad esencial ambientalmente relevante de la cinética (pseudo) de primer orden.
Dar ejemplos de procesos de transformación o transporte que obedecen a cinéticas de orden cero, primer orden, segundo orden y pseudo primer orden.
¿Por qué es útil formular procesos de destino ambiental en términos de tasas de proceso y constantes de tasa y constantes de equilibrio?


