3.5: Especiación de metales
- Page ID
- 70521
Deberías ser capaz de:
- describir las reacciones involucradas en la especiación de metales en los ambientes acuáticos y de suelo.
- explicar el enfoque de equilibrio para modelar especiación de metales.
- identificar qué propiedades del agua y el suelo impactan en el destino de los metales
- describir cómo procesos como la competencia y la sorción impactan en la biodisponibilidad del metal
- explicar por qué el destino ambiental de los metales es dinámico
Palabras clave: complejación de metales, reacciones redox, reacciones de equilibrio, química del agua, propiedades del suelo.
Introducción
Los metales se presentan en diferentes formas físicas y químicas en el medio ambiente, por ejemplo como el elemento (muy raro en el ambiente), como componentes de minerales, como cationes libres disueltos en agua (por ejemplo, Cd 2+), o unidos a moléculas inorgánicas u orgánicas en la fase sólida o disuelta (e.g. HgCh 3 + o AgCl 2+) (Allen 1993). La distribución de un metal sobre estas diferentes formas se conoce como especiación metálica. Los procesos físicos también pueden afectar la movilidad y biodisponibilidad de los metales, por ejemplo, la atracción electrostática de cationes metálicos a superficies minerales cargadas negativamente. Estos procesos en general no son referidos como especiación de metales en sentido estricto, sino que se discuten aquí.
Reacciones de especiación de metales
La especiación de los metales está controlada tanto por las propiedades de los metales (ver la sección Metales y metaloides) como por las propiedades del ambiente en el que están presentes, como el pH, el potencial redox y la presencia y concentraciones y propiedades de las moléculas que podrían formar complejos con los metales. Estas moléculas formadoras de complejos a menudo se denominan ligandos y estos pueden variar desde aniones relativamente simples en solución, como sulfato o aniones de ácidos orgánicos solubles, hasta macromoléculas más complejas como proteínas y otras biomoléculas. La adsorción de metales por formación de enlaces covalentes a superficies de óxido e hidróxido de minerales, y grupos funcionales que contienen oxígeno o nitrógeno de materia orgánica sólida, también se conoce como complejación. Dado que estos grupos funcionales de unión a metales son a menudo ácidos o básicos, el pH es un parámetro ambiental importante que controla las reacciones de complejación.
En los sistemas naturales la especiación de metales es de gran complejidad y determina su movilidad en el ambiente y su biodisponibilidad (es decir, cuán fácilmente son absorbidos por los organismos). Por lo tanto, la especiación de metales juega un papel clave en la determinación de la bioacumulación potencial y toxicidad de los metales y, por lo tanto, debe considerarse al evaluar sus riesgos ecológicos. La biodisponibilidad y el transporte de metales están en particular fuertemente relacionados con la distribución en fases sólida y líquida de la matriz ambiental.
Las cuatro principales reacciones químicas que determinan la especiación de metales, por lo que la unión de iones metálicos a ligandos y su presencia en fases sólida y líquida, son (Bourg, 1995):
- procesos de adsorción y desorción
- reacciones de intercambio iónico y disolución
- precipitación y coprecipitación
- complejación con ligandos inorgánicos y orgánicos
La complejidad de estas reacciones se ilustra en la Figura 1.
Figura en preparación
Figura 1. La especiación de metales (M) en el ambiente está determinada por una serie de reacciones, incluyendo complejación, precipitación y sorción. Estas reacciones afectan la partición de los metales a través de las fases sólida y líquida, de ahí su movilidad y su biodisponibilidad.
Los procesos de adsorción, desorción e intercambio iónico se llevan a cabo con los componentes reactivos presentes en suelos, sedimentos y en menor medida en el agua. Estos incluyen:
- minerales arcillosos
- hidróxidos (por ejemplo, FeOH 3) y/o carbonatos (por ejemplo, CaCO 3)
- materia orgánica
Los iones metálicos reaccionan con estos componentes reactivos de diferentes maneras. En suelos y sedimentos, los metales catiónicos se unen reversiblemente a los minerales arcillosos a través de procesos de intercambio catiónico (ver sección Suelo). Los iones metálicos también forman complejos con los llamados grupos funcionales (principalmente grupos carboxílicos y fenólicos) presentes en la materia orgánica (ver sección Suelo). En sistemas acuáticos ocurren procesos de unión similares, en los que la materia orgánica disuelta (o carbono) (DOM o DOC) juega un papel importante. La fracción “disuelta” de materia orgánica se define operacionalmente como la fracción que pasa por un filtro de 0.45 µm y a menudo se refiere a los ácidos fúlvico y húmico.
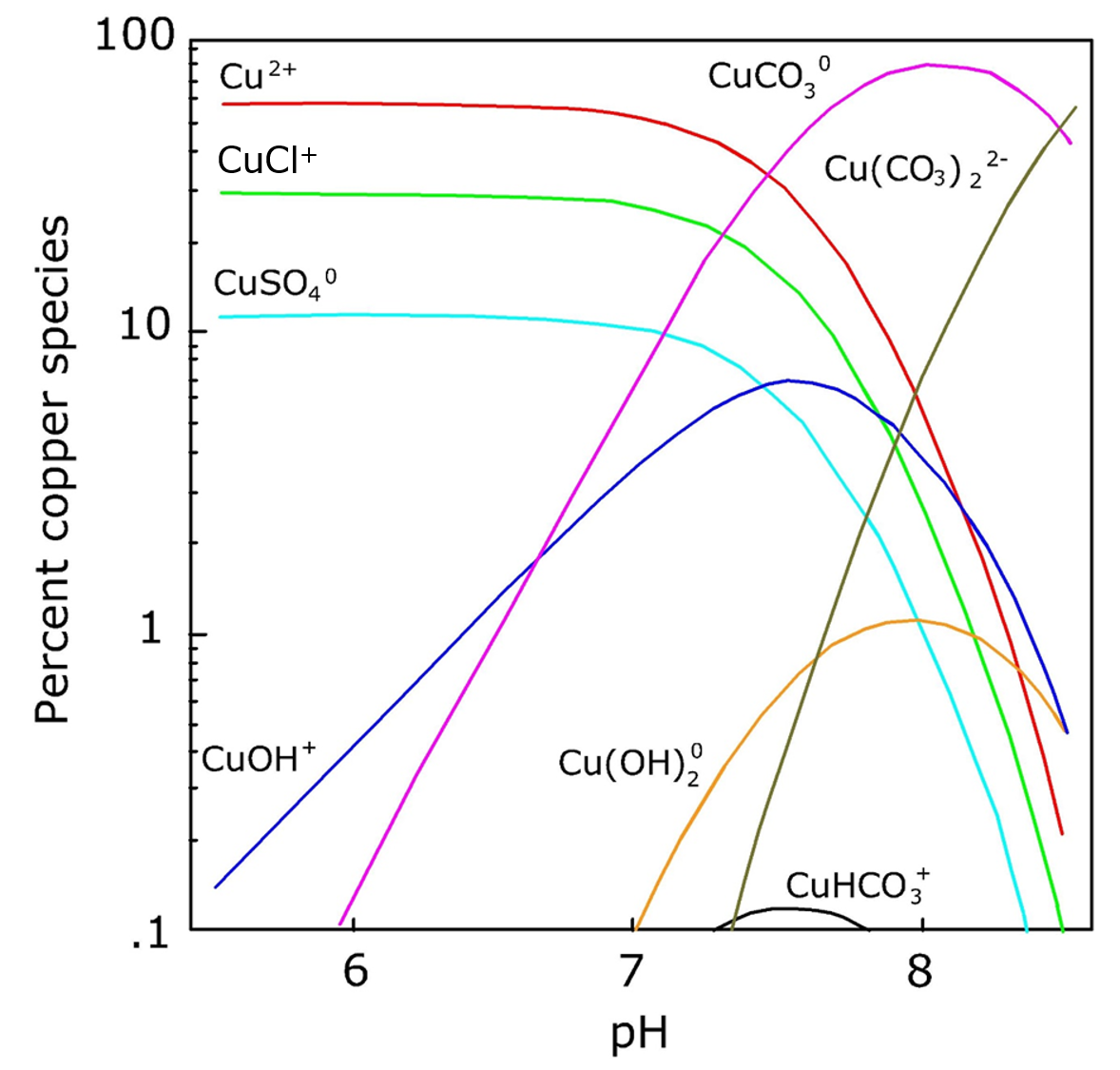
Como se mencionó anteriormente y en la sección sobre S https: //maken.wikiwijs.nl/147644/Environmental_toxicology__an_open_online_textbook#! page-5415168 el aceite, las superficies cargadas negativamente de los componentes minerales reactivos y orgánicos presentes en el suelo, los sedimentos o el agua atraen átomos o moléculas cargadas positivamente (cationes, por ejemplo Cd 2+), y permiten que estos cationes se intercambien con otros iones cargados positivamente. La competencia entre los cationes por los sitios de unión está impulsada por la afinidad de unión de cada especie metálica, así como la concentración de cada especie metálica. La capacidad de intercambio catiónico (CEC) es una propiedad del sorbente, y se define como la densidad de sitios con carga negativa disponibles por masa de matriz ambiental (suelo, sedimento). De hecho, es una medida de cuántos cationes se pueden retener en superficies sólidas. La CEC generalmente se expresa en cmol c/kg de suelo (ver sección Suelo). Al aumentar el pH (es decir, disminuir la concentración de iones H +) se aumenta la carga variable de la mayoría de los sorbentes (más tipos de grupos protonados en las superficies sorbentes liberan su H +), especialmente para la materia orgánica, y por lo tanto también aumenta la capacidad de intercambio catiónico. Los protones (H +) también compiten con iones metálicos por los mismos sitios de unión. Por el contrario, a pH decreciente (concentraciones crecientes de H +), la mayoría de los sorbentes disminuyen su CEC.
Modelado de especiación de metales
La especiación de metales se puede modelar si tenemos suficiente conocimiento de las reacciones más importantes involucradas y las condiciones ambientales que controlan estas reacciones. Este conocimiento se expresa en forma de equilibrios que expresan las reacciones de complejación y/o redox más importantes. Por ejemplo, en el caso general de una reacción de complejación entre el metal M y el ligando L descrita por el equilibrio:
aM m+ (aq) + bL n- (aq) ↔ M a L b q+ (aq) (donde q = am-bn)
La relación entre las concentraciones (o más exactamente las actividades) de la especie viene dada por:
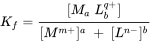
Si las reacciones redox están involucradas en la especiación, podemos usar la ecuación de Nernst para describir el equilibrio entre los estados reducidos y oxidados del metal:
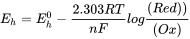
Donde E h es el potencial redox, E h 0 el potencial estándar del par redox (relativo al electrodo de hidrógeno), R la constante molar de gas, T la temperatura, n el número de electrones transferidos, F la constante de Faraday y {Rojo/Buey} la relación de actividad (o concentración) de las especies reducidas y oxidadas. Dado que muchas reacciones redox implican la transferencia de H +, el valor de {Rojo/Ox} para estos equilibrios dependerá del pH. Tenga en cuenta que el potencial redox a menudo se expresa como p e que se define como el logaritmo negativo de la actividad electrónica (p e = - log {e -}).
Usando estas ecuaciones comparativamente simples para todas las reacciones relevantes involucradas, es posible construir modelos para describir la especiación metálica en función de las concentraciones de ligandos, pH y potencial redox. Como ejemplo, el Cuadro 1 presenta los equilibrios relevantes para la especiación de hierro en el agua.
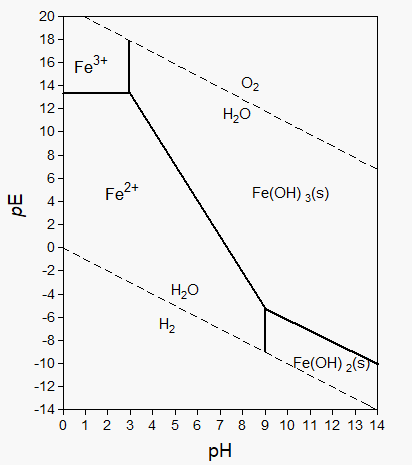
Cuadro 1. Reacciones de equilibrio relevantes para Fe en agua (adaptado de Essinton, 2003)
|
Límite |
Reacción de equilibrio |
|
|
(1) |
Fe 3+ + e - D Fe 2+ |
pE θ = 13.05 |
|
(2) |
Fe (OH) 3 (s) + 3H + D Fe 3+ + 3H 2 O |
K sp = 9.1 x 10 3 L 2 mol -2 |
|
(3) |
Fe (OH) 2 (s) + 2H + D Fe 2+ + 2H 2 O |
K * sp = 8.0 x 10 12 L mol -1 |
|
(4) |
Fe (OH) 3 (s) + H + + e - D Fe (OH) 2 (s) + H 2 O |
|
|
(5) |
Fe (OH) 3 (s) + 3H + + e - D Fe 2+ + 3H 2 O |
Usando estos podemos derivar ecuaciones que definen las condiciones de pH y p e en las que la relación de actividad o concentración es una para cada equilibrio. Estas se muestran como las líneas de límite continuas en la Fig. 3. En este diagrama Pourbaix o p e-Ph (o PE-Ph), los campos separados por las líneas limítrofes se etiquetan con las especies dominantes presentes bajo las condiciones que definen los campos. (NB. Las líneas punteadas definen las condiciones de p e y pH bajo las cuales el agua es estable.)
Efectos ambientales sobre la especiación
En el ambiente no hay, sin embargo, en general ningún equilibrio. Esto significa que la especiación y por ende también el destino de los metales es altamente dinámica. Las alteraciones a gran escala ocurren cuando el uso del suelo cambia, por ejemplo, cuando las tierras agrícolas son abandonadas y se convierten en Mientras que el suelo agrícola a menudo está 'encalado' (adición de CaCo 3) para mantener un pH casi neutro y el cultivo se elimina mediante la cosecha, en los ecosistemas naturales toda la materia orgánica producida permanece en el sistema. Por lo tanto, los suelos naturales muestran un incremento en el contenido de materia orgánica del suelo, mientras que debido a los procesos de descomposición microbiana el pH del suelo tiende Como resultado, la concentración de DOC en el agua de los poros del suelo aumentará, mientras que la movilidad de los metales también se incrementa por la disminución del pH del suelo (Cu 2+ es más móvil que CuCo 3). Esto puede hacer que la contaminación histórica por metales esté disponible repentinamente (el efecto “bomba de tiempo química”). La reconstrucción a gran escala de ríos o la excavación profunda del suelo para la planificación y el desarrollo de la tierra también pueden afectar las condiciones ambientales de tal manera que la especiación de metales puede cambiar. Un ejemplo de ello es el cambio en la especiación de arsénico en las aguas subterráneas debido a la perforación de pozos en países como Bangladesh; la introducción de oxígeno y materia orgánica en las aguas subterráneas más profundas provocó un cambio de especiación de arsénico, potenciando su solubilidad en el agua y por lo tanto incrementando exposición (ver sección sobre Metales y metaloides).
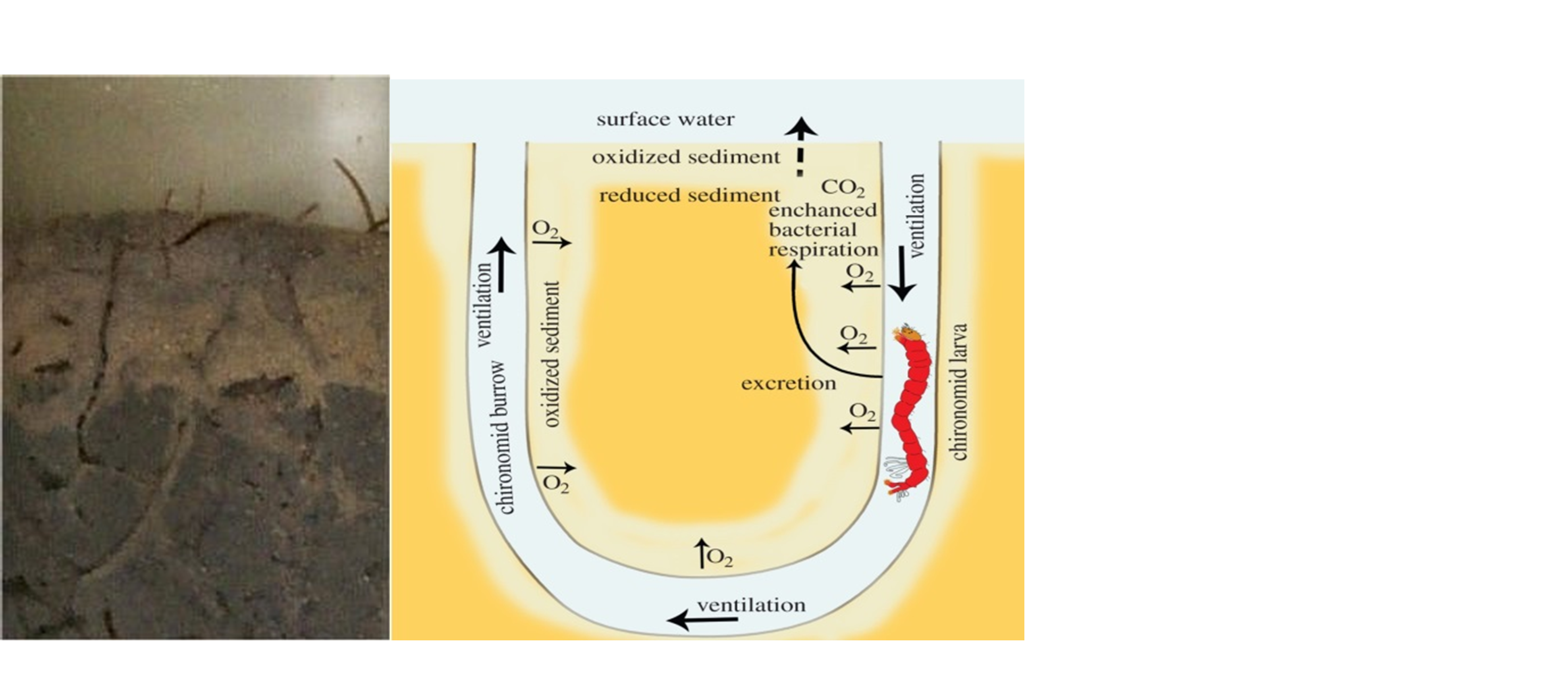
Las condiciones dinámicas no solo ocurren en grandes escalas espaciales y temporales, la naturaleza también es dinámica en escalas más pequeñas. Los factores abióticos como los eventos de lluvia e inundaciones, las condiciones climáticas y el estado redox pueden alterar la especiación de metales. Además, los factores bióticos pueden afectar la especiación de metales. Un ejemplo de esto último es la bioturbación por organismos que habitan sedimentos que resuspenden partículas en el agua, o lombrices de tierra que por sus actividades de excavación airean el suelo y excretan moco que puede estimular la actividad microbiana (ver Figura 4A). Estas actividades de los organismos de suelo y sedimentos alteran las condiciones ambientales y, por lo tanto, afectan la especiación de metales (ver Figura 4B). La producción de exudados ácidos radiculares por parte de las plantas también puede tener efectos similares sobre la especiación de metales. Otro proceso que altera la especiación de metales es la captación de metales. Dado que la forma metálica iónica parece más propensa a la absorción de raíces o a la ingesta activa sobre las membranas celulares, este proceso puede afectar la partición del metal en diferentes especies.
Referencias
Allen, S.E. (1993). La importancia de la especiación de metales traza para los criterios y estándares de calidad del agua, los sedimentos y el suelo. Ciencia del Medio Ambiente Total 134, 23-45.
Andrews, J.E., Brimblecombe, P., Jickells, T.D., Liss P.S., Reid, B. (2004) An Introduction to Environmental Chemistry, 2ª Edición, Blackwell, ISBN 0-632-05905-2 (capítulo 6).
Bourg, A.C.M. (1995) Especiación de metales pesados en suelos y aguas subterráneas e implicaciones para su movilidad natural y provocada. En: Salomons, W., Förstner, U., Mader, P. (Eds.). Metales Pesados. Springer, Berlín. p. 19-31.
Blust, R., Fontaine, A., Decleir, W. (1991) Efecto de iones hidrógeno y complejación inorgánica sobre la captación de cobre por el camarón de salmuera Artemia franciscana. Ecología Marina Progreso Serie 76, 273-282.
Esington, M.E. (2003) Química de Suelos y Aguas, CRC Press, ISBN 0-8493-1258-2 (capítulos 5, 7 y 9).
Sposito, G. (2008) La química de los suelos, 2ª edición, prensa de la Universidad de Oxford, ISBN 978-0-19-531369-7 (capítulo 4).
Sparks, D.L. (2003) Química Ambiental del Suelo, 2ª Edición, Prensa Académica, ISBN 0-12-656446-9 (capítulos 5, 6 y 8).
¿Cuáles son las reacciones más importantes involucradas en la especiación de metales en los ambientes acuáticos y de suelo?
¿Cuáles son los parámetros ambientales más importantes que controlan estas reacciones?
En el enfoque de equilibrio para modelar especiación metálica, se utilizan diagramas de dominancia o p e -pH como representación visual de la especiación. ¿Qué representan las líneas y campos en dichos diagramas?
Colaboradores
-
Autor (es): Martina Vijver, John Parsons
- Revisores: Kees van Gestel, Ronny Blust, Steven Droge


