4.7: Modelado de exposición
- Page ID
- 70469
3.8. Modelado de exposición
3.8.1. ¿Cómo estimar la emisión?
En preparación
3.8.2. Modelado multicompartimental
Autores: Dik van de Meent y Michael Matthies
Revisor: John Parsons
Objetivos de aprendizaje:
Deberías ser capaz de
- explicar qué es una ecuación de balance de masas
- describir cómo se utilizan las ecuaciones de balance de masa en el modelado de destino multimedia
- explicar los conceptos de equilibrio termodinámico y estado estacionario
- dar algunos ejemplos del uso del modelado de balance de masas multimedia
Palabras clave: ecuación de balance de masas, modelo de destino ambiental
La ecuación del balance de masas
El modelado de balance de masa multicompartimental (o multimedia) parte del principio de conservación universal, formulado como ecuación de equilibrio. El principio rector es que la tasa de cambio (de cualquier entidad, en cualquier sistema) es igual a la diferencia entre la suma de todas las entradas (de esa entidad) al sistema y la suma de todas las salidas del mismo. Los modeladores ambientales utilizan la ecuación de balance para predecir las concentraciones de exposición de productos químicos en el ambiente mediante la deducción del conocimiento de las tasas de los procesos de entrada y salida, lo que se puede entender más fácil a partir de considerar la ecuación de balance de masas para un solo compartimento ambiental (Figura 1) :
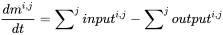 (eq. 1)
(eq. 1)
donde d m i, j /d t representa el cambio de masa del químico i en el compartimento j (kg) a lo largo del tiempo (s), y la entrada i, j y la salida i, j denotan las velocidades de entrada y salida del químico hacia y desde el compartimento j, respectivamente.
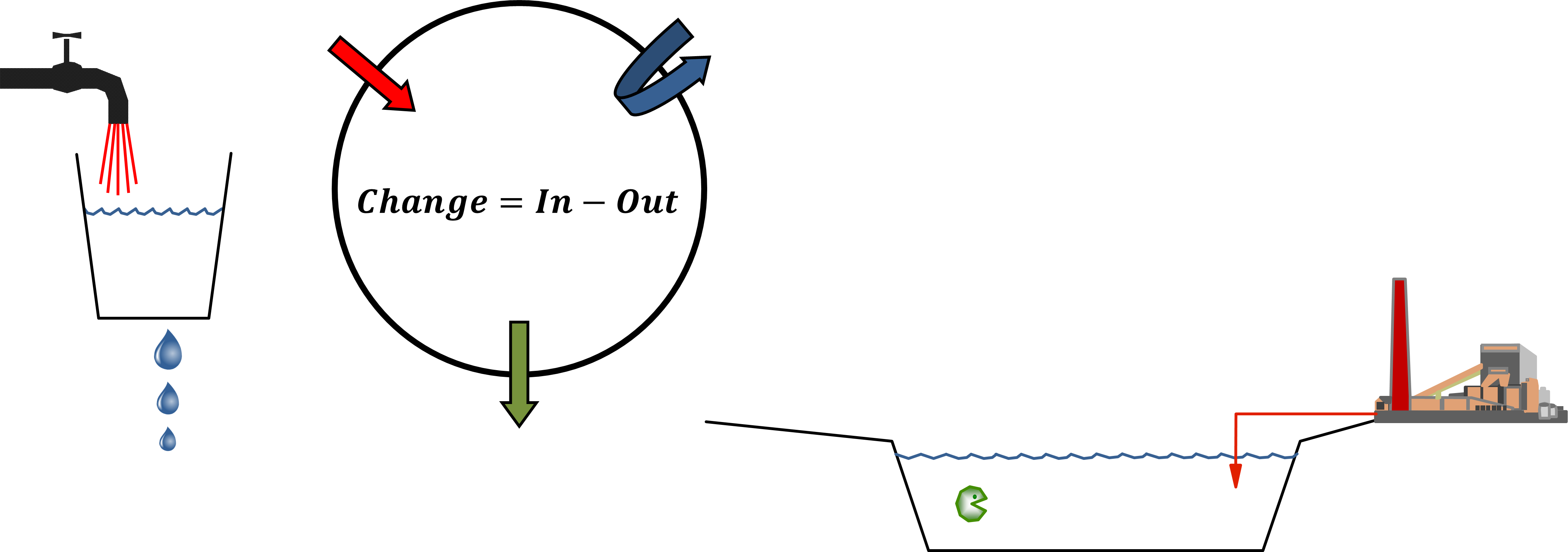
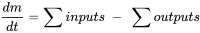 .
.Modelo de un compartimento
En el modelado de balance de masas multimedia, se formulan ecuaciones de balance de masa (del tipo mostrado en la ecuación 1) para cada compartimento ambiental. Las salidas de productos químicos de los compartimentos suelen ser proporcionales a las cantidades de sustancia química presentes en los compartimentos, mientras que las entradas externas (emisiones) a menudo se pueden suponer constantes. En tales casos, es decir, cuando se aplica cinética de primer orden (ver sección 3.3 sobre el destino ambiental de los productos químicos), las ecuaciones de balance de masas toman la forma de la ecuación 1 en la sección 3.3. Solo para un compartimento (por ejemplo, un lago, como en la Figura 1):
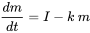 (eq. 2)
(eq. 2)
en el que d m /d t (kg.s -1) es la tasa de cambio de la masa (kg) de químico en el lago, I (kg.s -1) es la tasa de emisión (constante), y el producto k. m (kg.s -1) denota la tasa de pérdida de primer orden del químico del lago. Es obvio que eventualmente se debe desarrollar un estado estacionario, en el que la masa de químico en el lago alcanza un máximo predecible
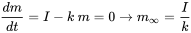 (eq. 2a)
(eq. 2a)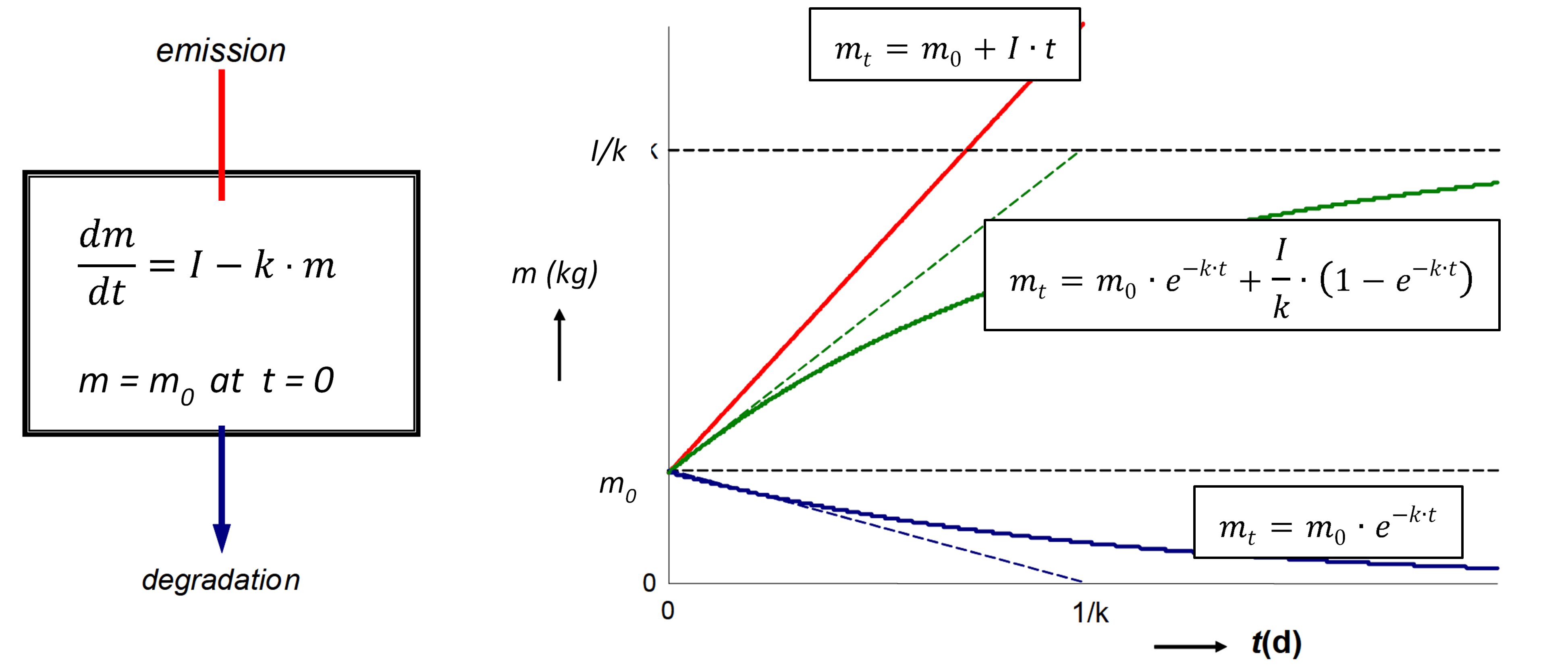
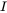 , que se alcanzará en tiempo ininito
, que se alcanzará en tiempo ininito 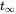 . Después de Van de Meent et al. (2011).
. Después de Van de Meent et al. (2011). 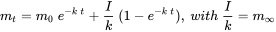 (eq. 3)
(eq. 3)
Cuando la tasa de entrada (emisión) es constante, es decir, que no varía con el tiempo, y es independiente de la masa de sustancia química presente, se espera que la masa de la sustancia química en los sistemas aumente exponencialmente, desde su valor inicial en
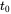 , hasta un nivel constante a
, hasta un nivel constante a 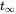 . De acuerdo con la ecuación 3,
. De acuerdo con la ecuación 3, 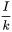 se espera un nivel de masa final igual a.
se espera un nivel de masa final igual a.
Modelo de múltiples compartimentos
El prefijo 'multi' indica que generalmente (muchos) se considera más de un compartimento ambiental. El Mundo Unidad (ver abajo) contiene aire, agua, biota, sedimentos y suelo; los sistemas de modelado global más avanzados pueden usar cientos de compartimentos. El caso de tres compartimentos (típicamente un aire, un agua, un suelo) se elabora esquemáticamente en la Figura 3.
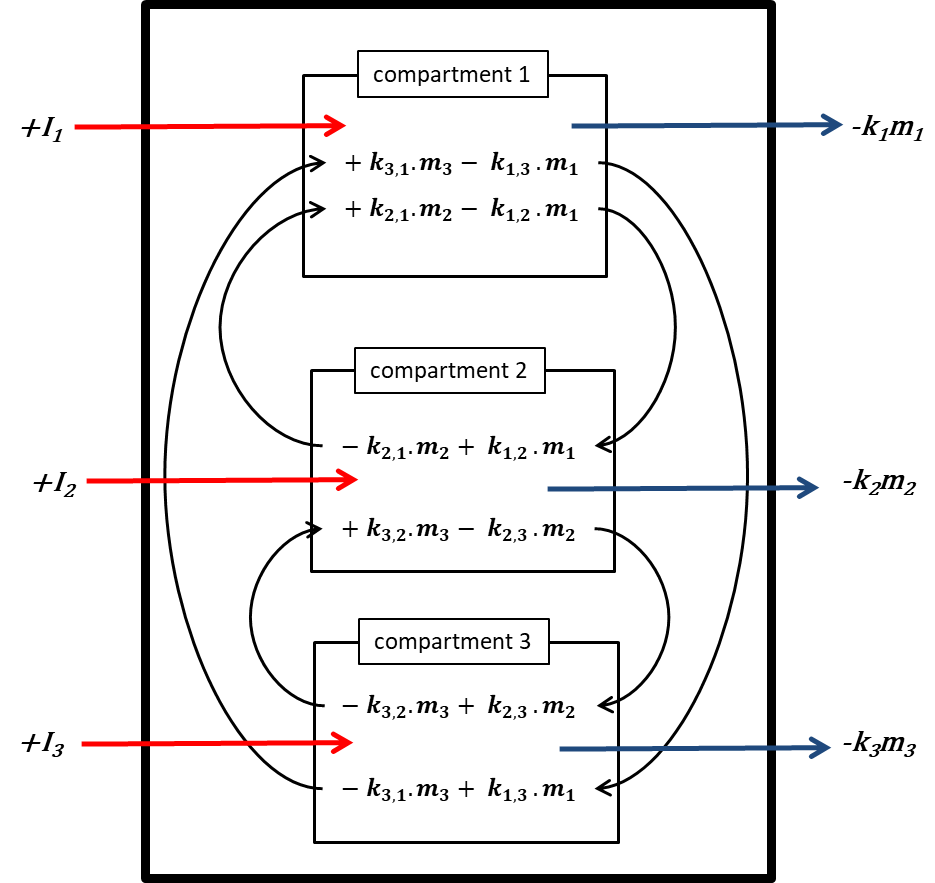
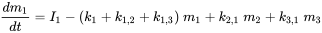
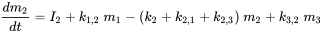
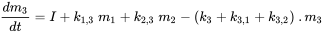
Cada compartimento puede recibir insumos constantes (emisiones, importaciones), y los productos químicos pueden exportarse desde cada compartimento por degradación o flujo de salida advectiva, como en el modelo de un compartimento. Además, los químicos pueden transportarse entre compartimentos (importación-exportación simultánea). Todos los flujos de masa se caracterizan por constantes de velocidad (pseudo) de primer orden (ver sección 3.3 sobre Procesos de destino ambiental). Las tres ecuaciones de balance de masa eventualmente se equilibran a cero en un tiempo infinito:
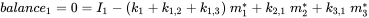
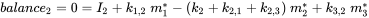
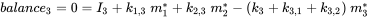 (eq. 4)
(eq. 4)
donde los símbolos 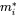 denotan masa en compartimentos i en estado estacionario. Conjuntos de n ecuaciones lineales con n incógnitas se pueden resolver algebraicamente, manipulando manualmente las ecuaciones 4, hasta que se obtengan expresiones limpias para cada uno de los tres valores m i, lo que inevitablemente se vuelve tedioso tan pronto como se van a resolver más de dos ecuaciones de balance de masas - esto ¡no le impidió a uno de los estudiantes de doctorado más famosos del profesor Mackay resolver con éxito un conjunto de 14 ecuaciones! Una manera más fácil de resolver conjuntos de n ecuaciones lineales con n incógnitas es mediante álgebra lineal. Usando cálculo vector-matriz algebraico lineal, las ecuaciones 4 se pueden reescribir en una ecuación lineal-algebraica:
denotan masa en compartimentos i en estado estacionario. Conjuntos de n ecuaciones lineales con n incógnitas se pueden resolver algebraicamente, manipulando manualmente las ecuaciones 4, hasta que se obtengan expresiones limpias para cada uno de los tres valores m i, lo que inevitablemente se vuelve tedioso tan pronto como se van a resolver más de dos ecuaciones de balance de masas - esto ¡no le impidió a uno de los estudiantes de doctorado más famosos del profesor Mackay resolver con éxito un conjunto de 14 ecuaciones! Una manera más fácil de resolver conjuntos de n ecuaciones lineales con n incógnitas es mediante álgebra lineal. Usando cálculo vector-matriz algebraico lineal, las ecuaciones 4 se pueden reescribir en una ecuación lineal-algebraica:
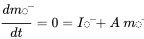 (eq. 5)
(eq. 5)
en el que 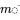 se encuentra el vector de masas en los tres compartimentos,
se encuentra el vector de masas en los tres compartimentos, 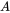 es la matriz modelo de constantes de velocidad conocidas y
es la matriz modelo de constantes de velocidad conocidas y 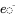 es el vector de tasas de emisión conocidas:
es el vector de tasas de emisión conocidas:
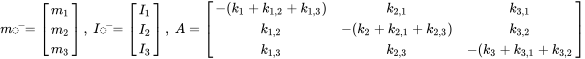
La solución de la ecuación 5 es
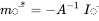
en el que 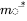 es el vector de masas en estado estacionario y
es el vector de masas en estado estacionario y 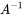 es el inverso de la matriz modelo
es el inverso de la matriz modelo 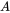 . El método algebraico lineal para resolver ecuaciones de balance de masa lineal se lleva fácilmente con software de hojas de cálculo (como MS Excel, LibreOffice Calc o Google Sheets), que contienen funciones de matriz integradas para invertir matrices y multiplicarlas por vectores.
. El método algebraico lineal para resolver ecuaciones de balance de masa lineal se lleva fácilmente con software de hojas de cálculo (como MS Excel, LibreOffice Calc o Google Sheets), que contienen funciones de matriz integradas para invertir matrices y multiplicarlas por vectores.
Modelado de Unit World
A finales de la década de 1970, científicos ambientalistas pioneros en el Laboratorio de Investigación Ambiental de la USEPA en Atenas GA, reconocieron que la ecuación de equilibrio universal (masa), aplicada a compartimentos de medios ambientales (aire, agua, biota, sedimento, suelo) podría servir como un medio para analizar y comprender las diferencias en el comportamiento ambiental y destino de los químicos. Su 'Modelado Mundial de Unidad evaluativa' (Baughman y Lassiter, 1978; Neely y Blau, 1985) fue el inicio de lo que ahora se conoce como modelado de balance de masas multimedia. El concepto Unit World fue desarrollado y pulido por Mackay y sus compañeros de trabajo (Neely y Mackay, 1982; Mackay y Paterson, 1982; Mackay et al., 1985; Paterson y Mackay, 1985, 1989). En el modelado Unit World, el ambiente es visto como un conjunto de reactores químicos bien mezclados, cada uno representando un medio ambiental (compartimento), hacia y desde el cual fluye la sustancia química, impulsados por la 'desviación del equilibrio'; esta es la jerga de la tecnología química para expresar el grado en que la termodinámica propiedades de equilibrio como 'potencial químico' o 'fugacidad' difieren (Figura 4). Mackay y sus compañeros de trabajo utilizaron la fugacidad en el modelado de balance de masas como variable de estado central. Poco después de la publicación de este 'enfoque de fugacidad' (Mackay, 1991), el término 'modelo de fugacidad' llegó a ser ampliamente utilizado para nombrar a todos los modelos del 'tipo Mackay', que aplicó 'Unit World mass balance modeling', aunque la mayoría de estos modelos siguieron utilizando la masa química más tradicional como variable de estado.
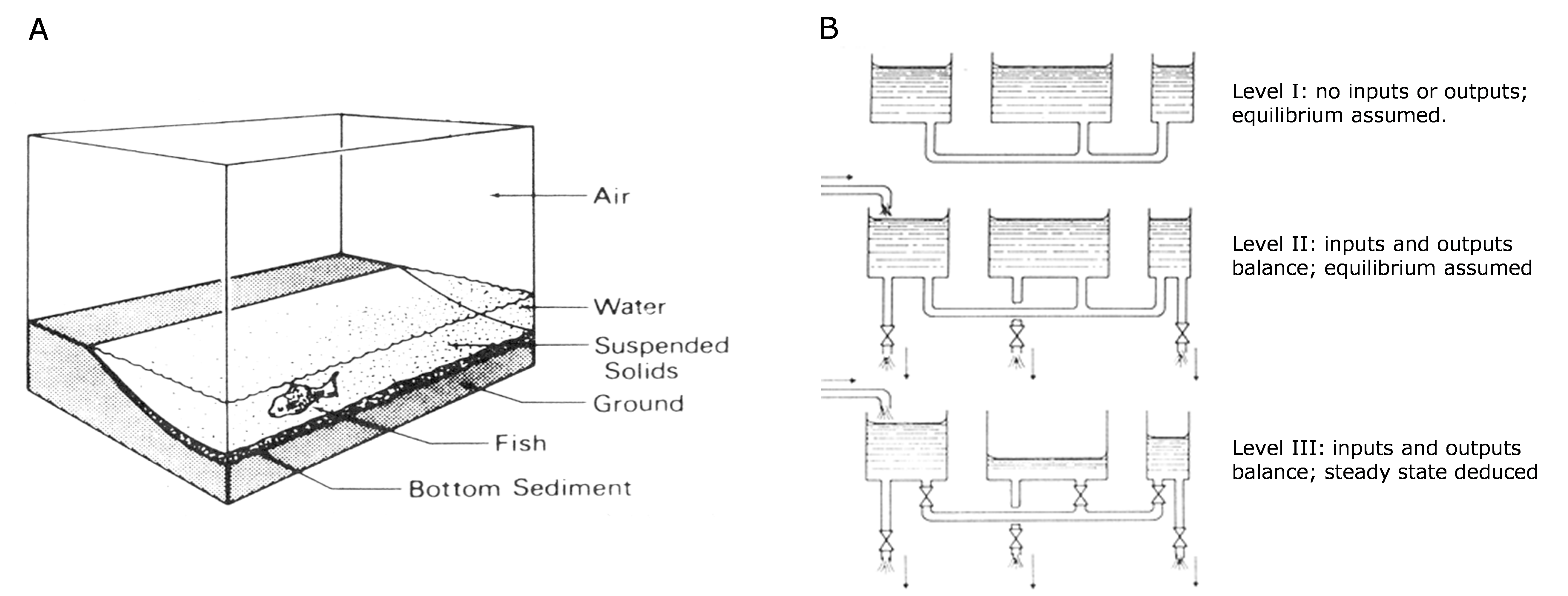
Niveles de complejidad
Si bien conceptualmente simple (el destino ambiental es como un balde con fugas, en el sentido de que su altura de agua en estado estacionario es predecible a partir de la cinética de primer orden), el carácter dinámico del modelado de balance de masas a menudo no es tan intuitivo. La perspectiva matemática abstracta puede ser más adecuada para explicar el modelado de balance de masas, pero esto puede no ser práctico para todos los estudiantes. En su libro sobre el modelado de balance de masas multimedia, Mackay optó por enseñar a sus alumnos el enfoque intuitivo, por medio de su famosa analogía de tanques de agua (Figura 4B).
De acuerdo con este enfoque intuitivo, el modelado de balance de masas se puede hacer en niveles de complejidad creciente, donde el nivel más bajo, más simple, que sirva para el propósito debe considerarse como el más adecuado. El menos complejo es el nivel I asumiendo que no hay entrada y salida. Un químico puede fluir libremente (es decir, sin restricción) de un compartimento ambiental a otro, hasta alcanzar su estado de menor energía: el estado de equilibrio termodinámico. En este estado, el químico tiene igual potencial químico y fugacidad en todos los medios ambientales. El sistema está en reposo; en la analogía hidráulica, el agua tiene niveles iguales en todos los tanques. Este es el nivel más bajo de complejidad del modelo, ya que este modelo solo requiere el conocimiento de unas pocas constantes de equilibrio termodinámico, las cuales pueden ser razonadas a partir de las propiedades básicas de la sustancia física.
El nivel de modelado más complejo III describe un ambiente en el que el flujo de químicos entre compartimentos experimenta resistencia al flujo, de manera que se alcanza un estado estacionario de equilibrio entre salidas e insumos solo a costa de una 'desviación permanente del equilibrio'. También se considera la degradación en todos los compartimentos y flujos advectivos, por ejemplo, caída de lluvia o corrientes de viento y agua. El estado estacionario del nivel III es aquel en el que las fugacidades de químicos en los compartimentos son desiguales (sin equilibrio termodinámico); en la analogía hidráulica, el agua en los tanques descansa a diferentes alturas. Naturalmente, resolver el nivel de modelado III requiere un conocimiento detallado de los insumos (¿en qué compartimento (es) se emite el químico?) , las salidas (¿a qué velocidades se degrada el químico en los diversos compartimentos?) y las resistencias de transferencia (¿qué tan rápida o lenta es la transferencia de masa entre los diversos compartimentos?). Los modeladores de nivel III son recompensados por esto al obtener resultados de modelos más realistas.
El cuarto nivel complejo de modelado de balance de masas multimedia (nivel IV, no mostrado en la Figura 4B) produce soluciones transitorias (dependientes del tiempo). Las simulaciones de modelos comienzan (t = 0) con cero químicos (m = 0; tanques de agua vacíos). Compartimentos (tanques), se llenan gradualmente hasta que el sistema llega a un estado estacionario, en el que generalmente uno o más compartimentos parten del equilibrio, como en el modelado de nivel III. El nivel IV es la representación más realista del destino ambiental de los productos químicos, pero requiere un conocimiento más detallado de los flujos de masa y las resistencias de transferencia de masa. Además, los estados variables en el tiempo son menos fáciles de interpretar y no siempre son los más informativos del destino químico. La información más importante que se obtiene del modelado de nivel IV es la indicación del tiempo hasta el estado estacionario: ¿cuánto tiempo se tarda en limpiar el ambiente de los químicos persistentes que ya no se utilizan?
Mackay describe un nivel intermedio de complejidad (nivel II), en el que las salidas (degradación, salidas advectivas) equilibran los insumos (como en el nivel III), y se permite que el químico fluya libremente entre compartimentos (como en el nivel I). Se desarrolla un estado estacionario en el nivel II y existe equilibrio termodinámico en todo momento. El modelado en el nivel II no requiere conocimiento de las resistencias de transferencia de masa (¡aparte de que las resistencias son insignificantes!) , pero las tasas de degradación y salida aumentan la complejidad del modelo en comparación con la del nivel I. En muchas situaciones, el modelado de nivel II arroja resultados sorprendentemente realistas.
Uso de modelos multimedia de balance de masa
Poco después de la publicación del primer uso del 'modelado evaluativo de Unit Mundo' (Mackay y Paterson, 1982), comenzaron a aparecer aplicaciones específicas del 'enfoque Mackay' al modelado de balance de masas multimedia. El grupo Mackay publicó varios modelos para la evaluación de químicos en Canadá, de los cuales ChemCan (Mackay et al., 1995) es mejor conocido. Incluso antes de ChemCan, salieron el modelo californiano CalToX (Mckone, 1993) y el modelo holandés SimpleBox (Van de Meent, 1993), seguido de la publicación del modelo HAZCHEM por parte del Centro Europeo de Ecotoxicología y Toxicología de Químicos (ECETOC, 1994) y el modelo ELPOS del alemán Umwelt Bundesamt (Beyer y Matthies, 2002). Esencialmente, todos estos modelos tienen el mismo propósito que el modelo original de Unit World, es decir, proporcionar plataformas de modelado estandarizadas para evaluar los posibles riesgos ambientales derivados del uso social de sustancias químicas.
Los modelos multimedia de balance de masas se convirtieron en herramientas esenciales en la toma de decisiones ambientales regulatorias sobre sustancias químicas En Europa, las sustancias químicas pueden registrarse para su comercialización bajo la regulación REACH solo cuando se demuestra que el químico puede usarse de manera segura. El modelado de balance de masas multimedia con SimpleBox (Hollander et al., 2014) y SimpleTreat (Struijs et al, 2016) juega un papel importante en el registro.
Mientras que los primeros modelos multimedia de balance de masas siguieron los pasos del concepto Unit World de Mackay (tomando el enfoque de estado estacionario y usando un compartimento por medio ambiental), los modelos posteriores se hicieron más grandes y explícitos espacial y temporalmente, y se utilizaron para el análisis en profundidad del destino químico.
A finales de la década de 1990, Wania y sus colaboradores desarrollaron un Modelo de Distribución Global de Contaminantes Orgánicos Persistentes (GloboPop). Utilizaron su modelo global de balance de masas multimedia para explorar el llamado efecto de condensación fría, mediante el cual explicaron la ocurrencia de cantidades relativamente grandes de químicos orgánicos persistentes en el Ártico, donde nadie los había usado nunca (Wania, 1999). Scheringer y sus colaboradores utilizaron su modelo ClimoChem para investigar el transporte a largo plazo de químicos persistentes a regiones alpinas (Scheringer, 1996; Wegmann et al., 2005). MacLeod y sus compañeros de trabajo (Toose et al., 2004) construyeron un modelo global de balance de masas multimedia (BETR World) para estudiar el transporte global de contaminantes a largo plazo.
Referencias
Baughman, G.L., Lassiter, R. (1978). Predicciones de concentraciones de contaminantes ambientales. En: Estimación del Peligro de Sustancias Químicas para la Vida Acuática. ASTM STP 657, pp. 35-54.
Beyer, A., Matthies, M. (2002). Criterios de Potencial de Transporte Atmosférico de Largo Alcance y Persistencia de Plaguicidas Umweltbundesamt Berichte 7/2002, E. Schmidt-Verlag, Berlín. ISBN 3-503-06685-3.
ECETOC (1994). HAZCHEM, Un modelo matemático para su uso en la evaluación de riesgos de sustancias. Centro Europeo de Ecotoxicología y Toxicología de Químicos, Bruselas.
Hollander, A., Schoorl, M., Van de Meent, D. (2016). SimpleBox 4.0: Mejorando el modelo, a la vez que lo mantiene simple... Quimosfera 148, 99-107.
Mackay, D. (1991). Modelos de destino ambiental multimedia: el enfoque de fugacidad. Lewis Publishers, Chelsea, MI.
Mackay, D., Paterson, S. (1982). Cálculo de fugacidad. Ciencia y Tecnología Ambiental 16, 274-278.
Mackay, D., Paterson, S., Cheung, B., Neely, W.B. (1985). Evaluar el comportamiento ambiental de los químicos con un modelo de fugacidad nivel III. Quimosfera 14, 335-374.
Mackay, D., Paterson, S., Tam, D.D., Di Guardo, A., Kane, D. (1995). ChemCan: Un modelo regional de fugacidad de nivel III para evaluar el destino químico en Canadá. Toxicología y Química Ambiental 15, 1638-1648.
McKone, T.E. (1993). CALTOX, Un Modelo Multi-media de Exposición Total para Sitios de Residuos Peligrosos. Laboratorio Nacional Lawrence Livermore. Livermore, CA.
Neely, W.B., Blau, G.E. (1985). Introducción a la Exposición de Químicos. En: Neely, W.B., Blau, G.E. (Eds). Exposición Ambiental por Químicos Volumen I, CRC Press, Boca Raton, FL., pp 1-10.
Neely, W.B., Mackay, D. (1982). Modelo evaluativo para estimar el destino ambiental. En: Modelado del Destino de los Químicos en el Medio Acuático. Ann Arbor Science, Ann Arbor, MI, pp. 127-144.
Paterson, S. (1985). Modelos de equilibrio para la integración inicial de propiedades físicas y químicas. En: Neely, W.B., Blau, G.E. (Eds). Exposición Ambiental por Químicos Volumen I, CRC Press, Boca Raton, FL., pp 218-231.
Paterson, S., Mackay, D. (1989). Un modelo que ilustra el destino ambiental, la exposición y la absorción humana de químicos orgánicos persistentes. Modelado Ecológico 47, 85-114.
Scheringer, M. (1996). Persistencia y rango espacial como puntos finales de una evaluación basada en la exposición de químicos orgánicos. Ciencia y Tecnología Ambiental 30, 1652-1659.
Struijs, J., Van de Meent, D., Schowanek, D., Buchholz, H., Patoux, R., Wolf, T., Austin, T., Peajes, J., Van Leeuwen, K., Galay-Burgos, M. (2016). Adaptación de SimpleTreat para simular el comportamiento de sustancias químicas durante el tratamiento de aguas residuales industriales. Quimosfera 159:619-627.
Toose, L., Woodfine, D.G., MacLeod, M., Mackay, D., Gouin, J. (2004). Betr-world: un modelo geográficamente explícito de destino químico: aplicación al transporte de alfa-HCH al Ártico Contaminación Ambiental 128, 223-40.
Van de Meent D. (1993). SimpleBox: un modelo genérico de evaluación del destino multimedia. Instituto Nacional de Salud Pública y Medio Ambiente. Informe RIVM 672720 001. Bilthoven, NL.
Van de Meent, D., McKone, T.E., Parkerton, T., Matthies, M., Scheringer, M., Wania, F., Purdy, R., Bennett, D. (2000). Persistencia y potencial de transporte de químicos en un entorno multimedia. En: Klecka, g. et al. (Eds.) Evaluación de Persistencia y Potencial de Transporte a Largo Alcance de Químicos Orgánicos en el Medio Ambiente. Prensa SETAC, Pensacola FL, Capítulo 5, pp. 169-204.
Van de Meent, D., Hollander, A., Peijnenburg, W., Breure, T. (2011). Destino y transporte de contaminantes. En: Sánches-Bayo, F., Van den Brink, P.J., Mann, R.M. (eds.) , Impactos ecológicos de productos químicos tóxicos, Bentham Science Publishers, pp. 13-42.
Wania, F. (1999). Sobre el origen de niveles elevados de químicos persistentes en el ambiente. Ciencia Ambiental e Investigación en Contaminación 6, 11-19.
Wegmann, F., Scheringer, M., Hungerbühler, K. (2005). Primeras investigaciones de efectos de condensación de frío montañoso con el modelo ClimoChem. Ecotoxicología y Seguridad Ambiental 63, 42-51.
Describa, usando sus propias palabras, las características esenciales de las ecuaciones de balance de masas.
¿Qué es el “estado estacionario”? ¿Qué es el “equilibrio”? Use algunas líneas de texto para describir lo esencial, indicando diferencias y puntos en común.
Las ecuaciones de balance de masas se utilizan en modelos para calcular concentraciones de sustancias en el ambiente, dado el conocimiento de las tasas de emisión. Dé un ejemplo resuelto para una situación de un compartimento, por ejemplo, un lago de agua dulce.
Nombra y describe uno (o más) ejemplo (s) de modelado de balance de masas multimedia.
3.8.3. Modelos de especiación de metales
Autores: Wilko Verweij
Revisores: John Parsons, Stephen Lofts
Objetivos de aprendizaje:
Deberías ser capaz de
- Comprender los conceptos básicos del modelado de especiaciones
- Comprender los factores que determinan la especiación y cómo calcularlos
- Entender en qué tipos de situaciones puede ser útil el modelado de especiación
Palabras clave: modelado de especiación, solubilidad, complejación orgánica
Introducción
Los modelos de especiación permiten a los usuarios calcular la especiación de una solución en lugar de medirla de manera química o evaluarla indirectamente mediante bioensayos (ver sección 3.5). Como regla general, los modelos de especiación toman las concentraciones totales como entrada y calculan las concentraciones de especies.
Los modelos de especiación utilizan datos termodinámicos sobre equilibrios químicos para calcular la especiación. Estos datos, expresados en energía libre o como constantes de equilibrio, se pueden encontrar en la literatura. El término 'constante' es ligeramente engañoso ya que las constantes de equilibrio dependen de la temperatura y la fuerza iónica de la solución. La fuerza iónica se calcula a partir de las concentraciones (C) y cargas (Z) de iones en solución usando la ecuación:
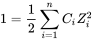
Para muchos equilibrios, no hay información disponible para corregir la temperatura. Para corregir la fuerza iónica, hay muchos métodos semiempíricos disponibles, ninguno de los cuales es perfecto.
Cómo funcionan estos modelos
Para cada reacción de equilibrio, se puede definir una constante de equilibrio. Por ejemplo, para la reacción
Cu 2+ + 4 Cl - CuCl 4 2-
la constante de equilibrio puede definirse como
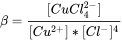
En consecuencia, cuando se conocen las concentraciones de Cu 2+ libre y Cl libre, la concentración de CuCl 4 2- se puede calcular fácilmente como:
[CuCl 4 2-] = β * [Cu 2+] * [Cl -] 4
β * [Cu 2+] * [Cl -] 4
De hecho, las concentraciones de Cu 2+ libre y Cl libre - a menudo NO se conocen, pero lo que se conoce son las concentraciones totales de Cu y Cl en el sistema. Para encontrar la especiación, necesitamos establecer un conjunto de ecuaciones de balance de masas que hay que configurar, por ejemplo:
[Cu total] = [Cu libre 2+] + [CuOH +] + [Cu (OH) 2] + [Cu (OH) 3 -] (..) + [CuCl +] + [CuCl 2] (..) etc.
[Cl total] = (..)
Cada concentración de un complejo es función de las concentraciones libres de los iones que lo componen. Entonces podemos decir que si conocemos las concentraciones de todos los iones libres, podemos calcular las concentraciones de todos los complejos, y luego podemos calcular las concentraciones totales. No se puede encontrar una solución al problema reordenando las ecuaciones de balance de masas, porque son no lineales. Lo que hace un modelo de especiación es estimar repetidamente las concentraciones de iones libres, ajustándolas en cada bucle para que las concentraciones totales calculadas coincidan más estrechamente con los totales conocidos. Cuando todas las concentraciones totales calculadas y conocidas concuerdan dentro de una precisión definida, se ha calculado la especiación. La parte crítica del cálculo es ajustar las concentraciones de iones libres de una manera sensata y eficiente para encontrar la solución lo más rápido posible. Varios métodos más o menos sofisticados están disponibles para resolver esto, pero generalmente se aplica un método Newton-Raphson.
Influencia de la temperatura y fuerza iónica
De hecho la explicación anterior es demasiado sencilla. Las constantes de equilbrio son válidas bajo condiciones específicas de temperatura y fuerza iónica (por ejemplo las condiciones estándar de 25 o C y [endif] —> y necesitan ser convertidas a la temperatura y fuerza iónica del sistema para el cual se está calculando especiado. Es posible adaptar las constantes de equilibrio para temperaturas no estándar, pero esto requiere el conocimiento de los datos de capacidad calorífica (ΔH) de cada equilibrio. Ese conocimiento muchas veces no está disponible. Las constantes se pueden convertir de 25°C a otras temperaturas usando la ecuación Van-'t Hoff:
[endif] —> y necesitan ser convertidas a la temperatura y fuerza iónica del sistema para el cual se está calculando especiado. Es posible adaptar las constantes de equilibrio para temperaturas no estándar, pero esto requiere el conocimiento de los datos de capacidad calorífica (ΔH) de cada equilibrio. Ese conocimiento muchas veces no está disponible. Las constantes se pueden convertir de 25°C a otras temperaturas usando la ecuación Van-'t Hoff:
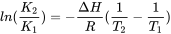
donde K 1 y K 2 son las constantes, T1 y T2 las temperaturas, Δ H es la entalpía de una reacción y R es la constante de gas.
Las constantes de equilbrio también son válidas para un valor específico de fuerza iónica. Para la conversión de un valor de fuerza iónica a otro, se pueden usar muchos enfoques diferentes. Esta conversión es bastante importante, porque ya a fuerzas iónicas relativamente bajas, las desviaciones de la idealidad se vuelven significativas, y la actividad de una especie comienza a desviarse de su concentración. Por lo tanto, las constantes de equilibrio intrínsecas o termodinámicas (es decir, constantes a una fuerza iónica hipotética de cero) ya no son válidas y la actividad a de iones a una fuerza iónica distinta de cero debe calcularse a partir de la concentración y el coeficiente de actividad:
a = γ * c
donde γ es el coeficiente de actividad (adimensional; a veces también llamado f) y c es la concentración; a y c están en mol/litro.
La primera solución para calcular los coeficientes de actividad para la fuerza iónica distinta de cero fue propuesta por Debye y Hückel en 1923. La teoría de Debye-Hückel asume que los iones son cargas puntuales por lo que no toma en cuenta el volumen que estos iones ocupan ni el volumen de la capa de ligandos y/o moléculas de agua a su alrededor. El Debye-Hückel da buenas aproximaciones, hasta alrededor de 0.01 M para un electrolito 1:1, pero solo hasta alrededor de 0.001 M para un electrolito 2:2. Cuando la fuerza iónica excede estos valores, los coeficientes de actividad que predice la aproximación de Debye-Hückel se desvían significativamente de los valores experimentales. Muchas aplicaciones ambientales requieren conversiones para mayores fuerzas iónicas, lo que hace que la ecuación de Debie-Hückel sea insuficiente. Para superar este problema, muchos investigadores han sugerido otros métodos, como la ecuación de Debie-Hückel extendida, la ecuación de Güntelberg y la ecuación de Davies, pero también la ecuación de Bromley, la ecuación de Pitzer y la Teoría de Interacción Iónica Específica (SIT).
Muchos programas utilizan la ecuación Davies, que calcula los coeficientes de actividad γ de la siguiente manera:
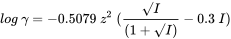
donde z es la carga de la especie y I la fuerza iónica. A veces se usa 0.2 en lugar de 0.3. Básicamente, todos estos enfoques toman la ecuación de Debie-Hückel como punto de partida, y agregan uno o más términos para corregir desviaciones a mayores fuerzas iónicas. Aunque muchos de estos métodos son capaces de predecir bastante bien la actividad de los iones, de hecho son principalmente extensiones empíricas sin una base teórica sólida.
Solubilidad
La mayoría de las sales tienen una solubilidad limitada; en varios casos la solubilidad también es importante en condiciones que ocurren en el ambiente. Por ejemplo, para CaCo 3 el producto de solubilidad es 10 -8.48, lo que significa que cuando [Ca 2+] * [CO 3 2-] > 10 -8.48, CaCo 3 precipitará, hasta [Ca 2+] * [CO 3 2-] = 10 -8 .48. Pero también funciona al revés: si el CaCo 3 sólido está presente en una solución donde [Ca 2+] * [CO 3 2-] < 10 -8.48 (tenga en cuenta el signo '<'-), el CaCO sólido 3 se disolverá, hasta [Ca 2+] * [CO 3 2-] = 10 -8.48. Tenga en cuenta que el Ca y el CO 3 en la fórmula aquí se refieren a iones libres. Por ejemplo, una solución 10 -13 M de Ag 2 S conducirá a la precipitación de Ag 2 S. Las concentraciones libres de Ag y S son 6.5*10 -15 M y 1.8*10-22 M resp. (lo que corresponde con el producto de solubilidad de 10 -50.12, pero las concentraciones disueltas de Ag y S son 7.1*10 -15 M y 3.6*10 -15 M resp., así para S orden de magnitud siete mayores. Esto es causado por la formación de complejos S con protones (HS - y H 2 S (aq)) y en menor medida con Ag.
Complexión por materia orgánica
La complejación con carbono orgánico disuelto (DOC) es diferente de la complejación inorgánica o complejación con compuestos bien definidos como acetato o NTA. Las razones de esa diferencia son las siguientes.
- El DOC es muy heterogéneo; el DOC aislado en dos sitios puede ser muy diferente (sin mencionar la dificultad de seleccionar procedimientos de aislamiento).
- La complejación con DOC generalmente muestra un rango continuo de constantes de equilibrio, debido a diferencias químicas y estéricas en grupos vecinos.
- El aumento de la unión catiónica y/o la fuerza iónica de la solución cambian las interacciones electrostáticas entre los grupos funcionales en las moléculas DOC, lo que influye en las constantes de equilibrio.
- Además, el cambio de las interacciones electrostáticas puede provocar cambios conformacionales de las moléculas.
Entre los modelos más populares para evaluar la complejación orgánica se encuentran el Modelo V (1992), VI (1998) y VII (2011), también conocido como WHAM, escrito por Tipping y coautores (Tipping & Hurley, 1992; Tipping, 1994, 1998; Tipping, Lofts & Sonke, 2011). Todos estos modelos suponen que se producen dos tipos de unión: unión específica y acumulación en la doble capa difusa. La unión específica es la formación de un enlace químico entre un ion y un grupo (o grupos) funcionales en la molécula orgánica. La acumulación difusa de doble capa es la acumulación de iones de carga eléctrica opuesta adyacentes a la molécula, sin formación de un enlace químico (la carga eléctrica suele ser negativa, por lo que los iones que se acumulan son cationes).
Para la unión específica, todos estos modelos distinguen los ácidos fúlvicos (FA) y los ácidos húmicos (HA) que se tratan por separado. Estas dos clases de DOC son típicamente los componentes más abundantes de la materia orgánica natural en el ambiente; en las aguas dulces superficiales, los ácidos fúlvicos suelen ser los más abundantes. Para cada clase, se utilizan ocho sitios de unión discretos diferentes en el modelo. Los sitios tienen una variedad de propiedades ácido-base. Los metales se unen a estos sitios, ya sea a un sitio solo (monodentado), a dos sitios (bidentado) o, comenzando con el Modelo VI, a tres (tridentados). Se permite que una fracción de los sitios forme complejos bidentados. A partir del Modelo VI, para cada grupo bidentado y tridentado se supone que hay tres subgrupos presentes, lo que aumenta aún más el rango de fuerzas de unión a metales.
Las constantes de unión dependen de la fuerza iónica y las interacciones electrostáticas. Las constantes condicionales se calculan de la misma manera en los Modelos V, VI y VII, de la siguiente manera:
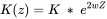
donde:
- Z es la carga del ácido orgánico (en moles por gramo de materia orgánica);
- w se calcula por:
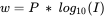
donde:
- P es un término constante (diferente para FA y HA, y diferente para cada modelo);
- I es la fuerza iónica.
Por lo tanto, la constante condicional depende de la carga de los ácidos orgánicos así como de la fuerza iónica. Para la unión de metales, el cálculo de la constante condicional ocurre de manera similar.
La doble capa difusa suele estar cargada negativamente, por lo que suele estar poblada por cationes, con el fin de mantener la neutralidad eléctrica. Los cálculos para la doble capa difusa son los mismos para el Modelo V, Modelo VI y Modelo VII. El volumen de la doble capa difusa se calcula por separado para cada tipo de ácido, de la siguiente manera:
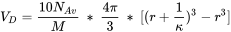
donde:
- N Av es el número de Avogadro;
- M es el peso molecular del ácido;
- r es el radio de la molécula (0.8 nm para los ácidos fúlvicos, 1.72 para los ácidos húmicos);
- κ es el parámetro Debye-Hückel, que depende de la fuerza iónica.
Simplemente aplicar esta fórmula en situaciones de baja fuerza iónica y alto contenido de ácido orgánico conduciría a artefactos (donde el volumen de capa difusa puede calcularse para ser superior a 1 litro/litro). Por lo tanto, se implementan algunos “trucos” para limitar el volumen de la doble capa difusa al 25% del total.
En caso de que el ácido tenga una carga negativa (como lo ha hecho en la mayoría de los casos), se permite que especies positivas y neutras entren en la doble capa difusa, lo suficiente para hacer que la doble capa difusa sea eléctricamente neutra. Cuando el ácido tiene una carga positiva, están presentes especies negativas y neutras.
La concentración de especies en la doble capa difusa se calcula asumiendo que la concentración de esa especie en la doble capa difusa depende de la concentración en la solución a granel y la carga.
En la fórmula:
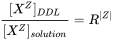
donde R se calcula iterativamente, para asegurar que la doble capa difusa sea eléctricamente neutra.
Aplicaciones
Los modelos de especiación se pueden utilizar para muchos propósitos. Básicamente, se pueden distinguir dos grupos de aplicaciones. El primer grupo consiste en aplicaciones destinadas a comprender el comportamiento químico de cualquier sistema. El segundo grupo se enfoca en la biodisponibilidad.
Comportamiento químico; situaciones de laboratorio
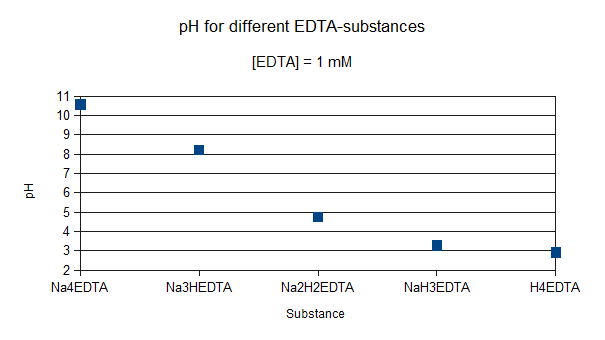
Los modelos de especiación pueden ser útiles para comprender el comportamiento químico tanto en situaciones de laboratorio como en situaciones de campo. Por ejemplo, si desea agregar EDTA a una solución para evitar la precipitación de metales, la elección de la sustancia EDTA también determina el pH de la solución final. La Figura 1 muestra el pH de una solución 1 mM de EDTA para cinco sales de EDTA diferentes. Esto demuestra que si quieres terminar con una solución casi neutra, la mejor opción es agregar EDTA como la sal Hedta Na 3. Agregar una sal diferente requiere agregar ácido o base, o más capacidad tampón, lo que a su vez influirá en el comportamiento químico de la solución.
Si se tienen mediciones de campo del potencial redox, los modelos de especiación pueden ayudar a predecir si el hierro estará presente como Fe (II) o Fe (III), lo cual es importante porque Fe (II) se comporta químicamente bastante diferente a Fe (III) y además tiene una biodisponibilidad bastante diferente. Lo mismo ocurre con otros elementos que experimentan equilibrios redox como N, S, Cu o Mn.
Las reacciones de fase se pueden predecir con modelos de especiación, por ejemplo la disolución de carbonato debido a la reacción en solución gaseosa de CO 2. Otro ejemplo es la especiación en Dutch Standard Water (DSW), un medio de prueba de uso frecuente para experimentos ecotoxicológicos, que está sobresaturado con respecto a CaCo 3 y por lo tanto muestra una parte de Ca como precipitado. La fracción que precipita es muy pequeña (menos del 2% del Ca) por lo que parece poco importante a primera vista, pero el precipitado induce un cambio de pH de 0.22, factor de casi dos en la concentración de H + libre.
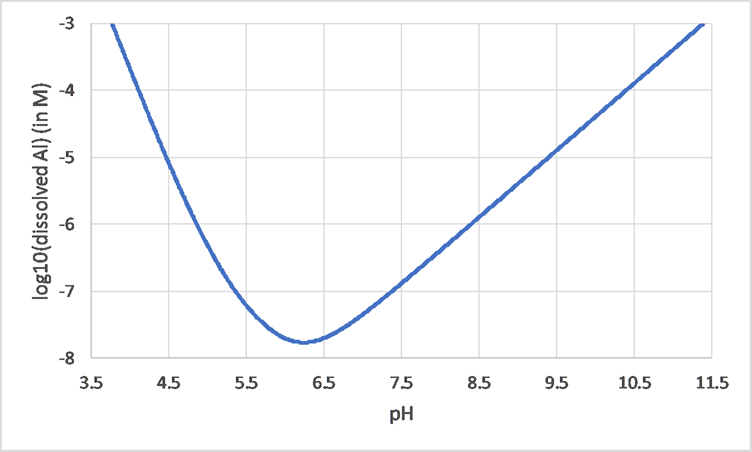
Muchos metales son anfóteros y por lo tanto tienen una solubilidad mínima a un pH moderado, mientras que se disuelven más a valores de pH tanto mayores como menores. Esto se puede ver fácilmente en el caso de Al: La Figura 2 muestra la concentración de Al disuelto en función del pH (nota escala logarítmica para el eje Y). Alrededor del pH de 6.2, la solubilidad está en su mínimo. A valores de pH mayores y menores, la solubilidad es (mucho) mayor.
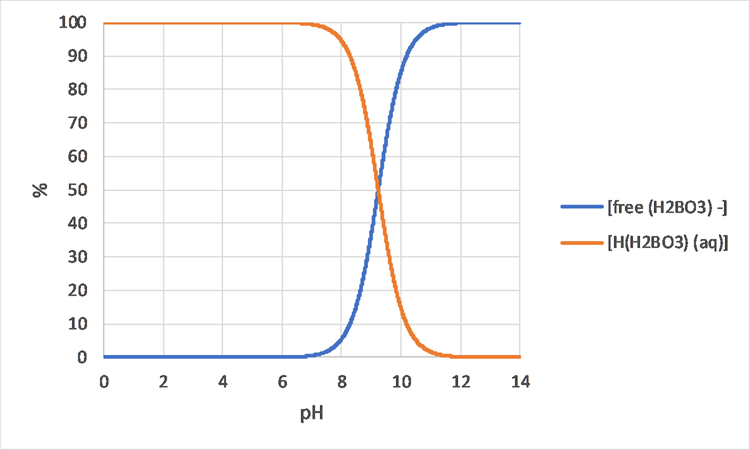
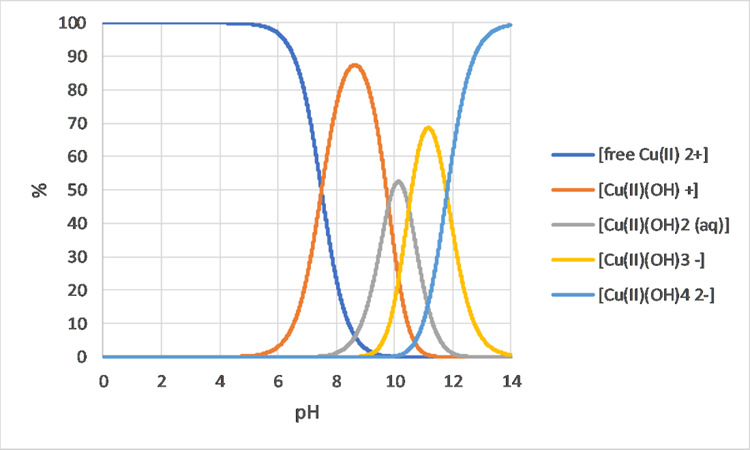
Los modelos de especiación también pueden ayudar a comprender las diferencias en el crecimiento de organismos o los efectos adversos sobre los organismos, en diferentes soluciones químicas. Por ejemplo, la Figura 3 muestra que los cambios en la especiación del boro solo pueden esperarse entre aproximadamente pH 8 y 10.5, por lo que cuando se observa una diferencia biológica entre pH 7 y 8, no es probable que el boro sea la causa. El cobre por otro lado (ver Figura 4) sí muestra diferencias en la especiación entre pH 7 y 8 por lo que es una causa más probable de diferente comportamiento biológico.
Comportamiento químico: situaciones de campo
En situaciones de campo, la química suele ser mucho más compleja que en condiciones de laboratorio. La descomposición de organismos (incluyendo plantas) da como resultado una gran variedad de compuestos orgánicos como ácidos fúlvicos, ácidos húmicos, proteínas, aminoácidos, carbohidratos, etc. Muchos de estos compuestos interactúan fuertemente con cationes, algunos también con aniones o moléculas no cargadas. Además, los metales se adsorben fácilmente a las partículas de arcilla y arena que se encuentran en todas partes de la naturaleza. Para hacerlo más complejo, la materia suspendida puede contener un alto contenido de material orgánico que también es capaz de unir cationes.
Para la complejación por ácidos fúlvico y húmico, Tipping y colaboradores han desarrollado un modelo unificador (Tipping & Hurley, 1992; Tipping, 1994, 1998; Tipping, Lofts & Sonke, 2011). La versión más reciente, WHAM 7 (Tipping, Lofts & Sonke, 2011), es capaz de predecir la complejación catiónica por ácidos fúlvicos y ácidos húmicos en una amplia gama de circunstancias químicas, a pesar de la gran diferencia en la composición de estos ácidos. Este modelo ahora se incorpora en varios programas de especiación.
La materia suspendida puede ser de carácter orgánico o inorgánico. La materia inorgánica generalmente consiste en (hidro) óxidos de metales, como Mn, Fe, Al, Si o Ti, y minerales arcillosos. En la práctica, los (hidro) óxidos y arcillas ocurren juntos, pero las proporciones mutuas pueden diferir drásticamente dependiendo de la fuente. Dado que las propiedades químicas de estas arcillas metálicas (hidro) óxidos son bastante diferentes, existe una gran variación en las propiedades químicas de la materia inorgánica suspendida en diferentes lugares y diferentes épocas. Como consecuencia, modelar las interacciones entre los constituyentes disueltos y la materia inorgánica suspendida es un desafío. Sólo midiendo algunas propiedades de la materia inorgánica suspendida, se puede aplicar con éxito el modelado. Para la materia orgánica suspendida, la variación en las propiedades también es grande y el modelado es un desafío.
Biodisponibilidad
Los modelos de especiación son útiles para comprender y evaluar la biodisponibilidad de metales y otros elementos en los medios de prueba. Los medios de prueba a menudo contienen sustancias como EDTA para mantener los metales en solución. Los complejos EDTA en general no están biodisponibles, por lo que además de mantener los metales en solución también cambian su biodisponibilidad. Los modelos pueden calcular la especiación y ayudarle a evaluar lo que realmente está sucediendo en un medio de prueba. Un aspecto a menudo olvidado es la influencia del CO 2. El CO 2 de la atmósfera ambiente puede entrar en una solución o el carbonato en solución (si está en exceso sobre la concentración de equilibrio) puede escapar a la atmósfera. El grado en que se produce este intercambio, influye en el pH de la solución así como en la cantidad de carbonato que permanece en solución (los carbonatos suelen ser poco solubles).
De igual manera, en situaciones de campo los modelos pueden ayudar a comprender la biodisponibilidad de los elementos. Como se indicó anteriormente, la influencia del DOC puede hoy en día ser evaluada adecuadamente en muchas situaciones, la influencia de la materia suspendida sigue siendo más difícil de evaluar. Sin embargo, los modelos pueden entregar insights en segundos que de otra manera solo se pueden obtener con gran dificultad.
Modelos
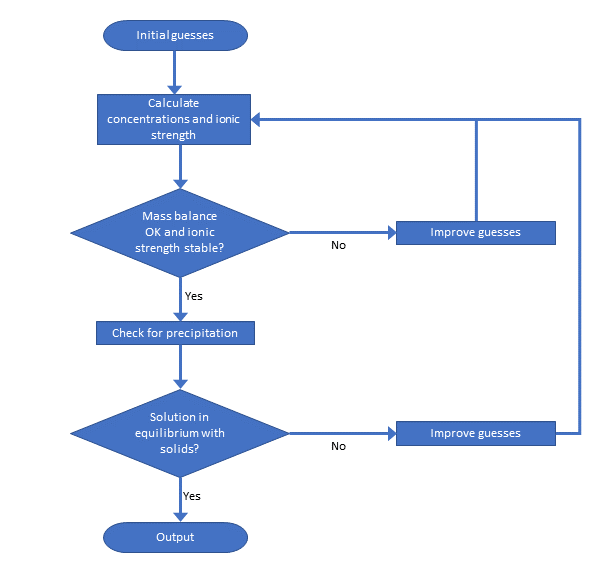
Hay muchos programas de especiación disponibles y varios de ellos están disponibles gratuitamente. Por lo general, toman como entrada un conjunto de concentraciones totales, más información sobre parámetros como pH, redox, concentración de carbono orgánico etc. luego los programas calculan la especiación y las presentan al usuario. Las ecuaciones no se pueden resolver analíticamente, por lo que se requiere un procedimiento iterativo. Aunque se utilizan diferentes enfoques numéricos, la mayoría de los programas construyen un conjunto de ecuaciones de balance de masa no lineales y las resuelven mediante matemáticas simples o avanzadas. Una complicación en este procedimiento es que las constantes de equilibrio dependen de la fuerza iónica de la solución, y que esta fuerza iónica sólo puede calcularse cuando se conoce la especiación. Lo mismo se aplica a la precipitación de sólidos. El procedimiento se muestra en la Figura 5.
Limitaciones
Para modelar la especiación, se necesitan datos termodinámicos para todas las reacciones de equilibrio relevantes. Para muchos equilibrios, esta información está disponible, pero no para todos. Esto entorpece la utilidad del modelado de especiaciones. Además, puede haber grandes variaciones en los valores termodinámicos encontrados en la literatura, resultando en incertidumbre sobre el valor correcto. Un factor de 10 entre los valores más altos y más bajos encontrados no es una excepción. Esto, por supuesto, influye en la confiabilidad de los cálculos de especiación. Para muchos equilibrios, los datos termodinámicos solo están disponibles para la temperatura estándar de 25°C y no hay información disponible para evaluar los datos a otras temperaturas, aunque el efecto de la temperatura puede ser bastante fuerte. También la fuerza iónica tiene un alto impacto en las 'constantes' de equilibrio; hay muchos métodos disponibles para corregir el efecto de la fuerza iónica, pero la mayoría de ellos son en el mejor de los casos semiempíricos. Simonin (2017) propuso recientemente un método con una sólida base teórica; sin embargo, los datos requeridos para su método están disponibles solo para unos pocos complejos hasta el momento.
Más fundamentalmente, debes darte cuenta de que los programas de especiación suelen calcular la situación de equilibrio, mientras que algunas reacciones son muy lentas y, más inportante, la naturaleza es de hecho un sistema muy dinámico y por lo tanto nunca en equilibrio. Si un sistema está cerca del equilibrio, los programas de especiación a menudo pueden hacer una buena evaluación de la situación real, pero cuanto más dinámico sea un sistema, más cuidado debe tener al creer los resultados de los programas. Sin embargo, es bueno darse cuenta de que un sistema químico siempre se moverá hacia la situación de equilibrio, mientras que los organismos pueden alejarlos del equilibrio. Los fototrofos son capaces de alejar un sistema de su situación de equilibrio, mientras que los descomponedores y heterótrofos generalmente ayudan a mover un sistema hacia su estado de equilibrio.
Referencias
Simonin, J.-P. (2017). Consistencia termodinámica en el modelado de especiación en electrolitos autocomplejantes. Ind. Ing. Chem. Res. 56, 9721-9733.
Tipping, E., Hurley, M.A. (1992). Un modelo unificador de unión catiónica por sustancias húmicas. Geochimica et Cosmochimica Acta 56, 3627 - 3641.
Tipping, E. (1994). WHAM - Un modelo de equilibrio químico y código de computadora para aguas, sedimentos y suelos que incorpora un modelo discreto de sitio/electrostático de unión de iones por sustancias húmicas. Computadoras y Geociencias 20, 973 - 1023.
Tipping, E. (1998). Modelo VI de unión a iones húmicos: una descripción mejorada de las interacciones de protones e iones metálicos con sustancias húmicas. Geoquímica Acuática 4, 3 - 48.
Tipping, E., Lofts, S., Sonke, J.E. (2011). Modelo VII de unión a iones húmicos: una parametrización revisada de la unión a cationes por sustancias húmicas. Química Ambiental 8, 228 - 235.
Lectura adicional
Stumm, W., Morgan, J.J. (1981). Química acuática. John Wiley & Sons, Nueva York.
Más, F.M.M., Hering, J.G. (1993). Principios y Aplicaciones de la Química Acuática. John Wiley & Sons, Nueva York.
Describa brevemente qué son los modelos de especiación.
¿Cuáles son los factores que determinan la especiación y cómo se pueden contabilizar?
Dé dos ejemplos de situaciones en las que el modelado de especiaciones puede ser útil.
3.8.4. Modelado de exposición a escalas ecológicas
En preparación


