4.6: Degradación
- Page ID
- 70489
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)3.7. Degradación
3.7.1. Procesos de degradación química y fotoquímica
Autores: John Parsons
Críticos: Steven Droge, Kristopher McNeill
Objetivos de Inclinación:
Deberías ser capaz de:
- comprender el papel de las reacciones químicas y fotoquímicas en la eliminación de químicos orgánicos del medio ambiente
- comprender las reacciones químicas y fotoquímicas más importantes en el ambiente
- comprender el papel de la fotodegradación directa e indirecta
Palabras clave: Reacciones de degradación ambiental, Hidrólisis, Reducción, Deshalogenación, Oxidación, Fotodegradación
Introducción
La transformación de los químicos orgánicos en el ambiente puede ocurrir por una variedad de reacciones. Estas pueden ser reacciones puramente químicas, como hidrolizas o reacciones redox, reacciones fotoquímicas con implicación directa o indirecta de la luz, o reacciones bioquímicas. Tales transformaciones pueden cambiar la actividad biológica (toxicidad) de una molécula; puede cambiar las propiedades fisicoquímicas y así cambiar sus procesos de partición ambiental; puede cambiar su biodisponibilidad, por ejemplo facilitando la biodegradación; o puede contribuir a la eliminación completa ( mineralización) de la sustancia química del ambiente. En muchos casos, los químicos pueden eliminarse mediante combinaciones de estos diferentes procesos y a veces es difícil identificar inequívocamente las contribuciones de los diferentes mecanismos. De hecho, las combinaciones de diferentes mecanismos a veces son importantes, por ejemplo en los casos en que la actividad microbiana es responsable de crear condiciones que favorezcan las reacciones químicas. Aquí nos centraremos en dos tipos de reacciones: reacciones abióticas (oscuras) y reacciones fotoquímicas. Las reacciones de biodegradación están cubiertas en otra parte (ver sección sobre Biodegradación).
Degradación química
Las reacciones hidrolíticas son reacciones químicas importantes que eliminan contaminantes orgánicos y son particularmente importantes para los productos químicos que contienen derivados ácidos como grupos funcionales. Ejemplos comunes de tales químicos son los pesticidas de las clases de organofosfatos y carbamatos tales como paratión, diazinón, aldicarb y carbarilo. Los productos químicos organofosforados también se utilizan como retardantes de llama y se distribuyen ampliamente en el medio ambiente. Algunos ejemplos de reacciones de hidrólisis se muestran en la Figura 1.
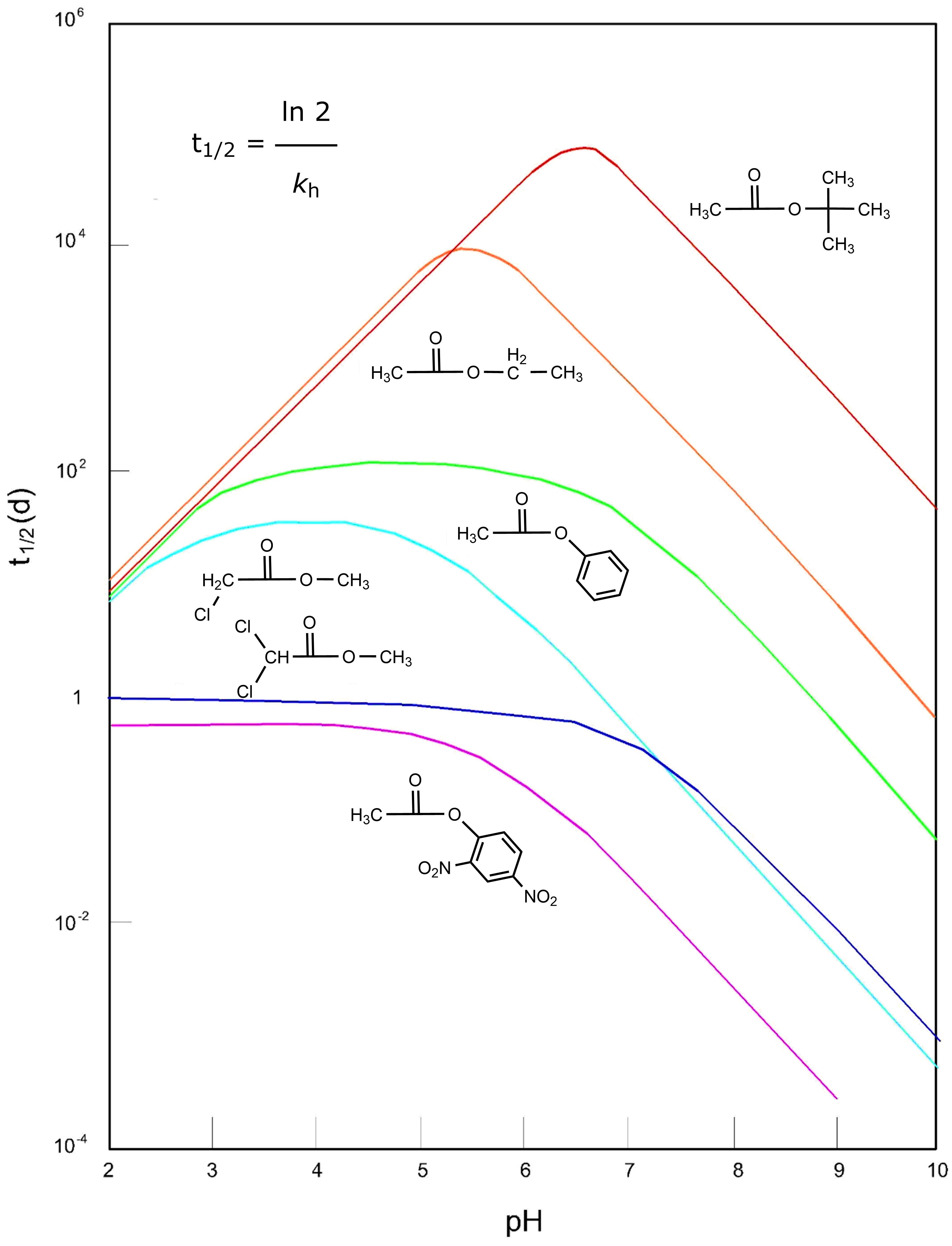
Como su nombre indica, las reacciones de hidrólisis implican usar agua (hidro-) para romper (-lisis) un enlace. Las hidrolizas son reacciones con agua para producir un ácido y ya sea un alcohol o amina como productos. Las hidrolizas pueden ser catalizadas por iones OH - o H + y sus velocidades son, por lo tanto, dependientes del pH. Algunos ejemplos de reacciones de hidrólisis de ésteres dependientes del pH se muestran en la Figura 2.
Las moléculas orgánicas halogenadas también pueden hidrolizarse para formar alcoholes (liberando el halógeno como un ion haluro). Las velocidades de estas reacciones varían fuertemente dependiendo de la estructura de la molécula organohalógena y del sustituyente halógeno (siendo Br e I sustituidos más rápidamente que Cl, y mucho más rápidamente que F) y en general las velocidades de estas reacciones son demasiado lentas para ser de más que menor importancia excepto para organohalógenos terciarios y organohalógenos secundarios con Br e I (Schwarzenbach et al. 2017).
En algunos casos, pueden ser importantes otras reacciones de sustitución que no involucren agua como reactivo. Algunos ejemplos incluyen Cl - en agua de mar que convierte CH 3 I en CH 3 Cl y reacción de tioles con bromo de alquilo en agua subterránea anaeróbica y agua de poros de sedimentos en condiciones reductoras de sulfato (Schwarzenbach et al. 2017)
Las reacciones redox (reducción y oxidación) son otra clase de reacción importante involucrada en la degradación de químicos orgánicos. En presencia de oxígeno, la oxidación de los químicos orgánicos es termodinámicamente favorable pero ocurre a velocidades insignificantes a menos que el oxígeno se active en forma de radicales de oxígeno o peróxidos (siguiendo la absorción de luz, por ejemplo, ver más adelante) o si la reacción es catalizada por metales de transición o enzimas que contienen metales de transición (ver las secciones sobre Biodegradación y Metabolismo Xenobiótico y defensa).
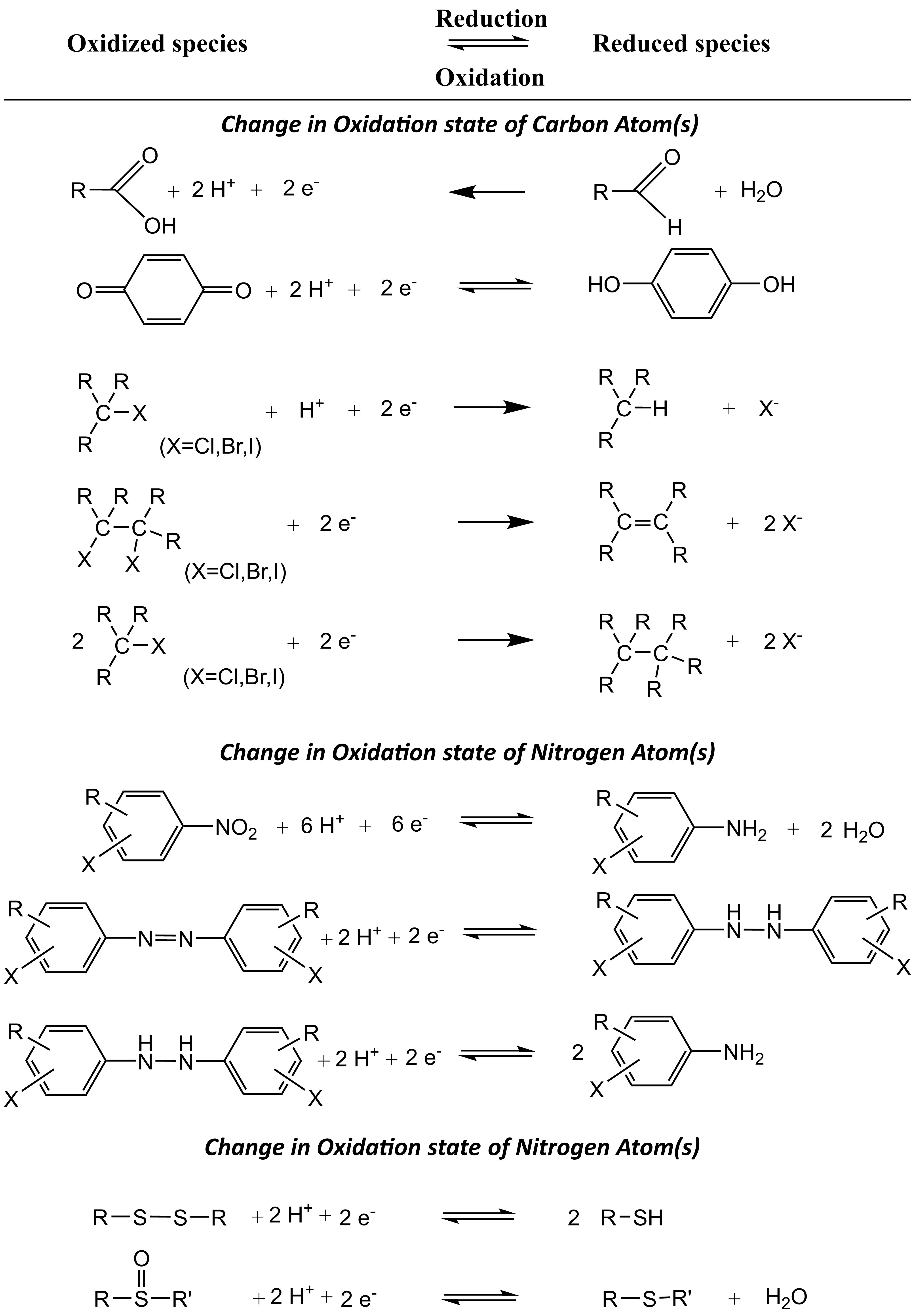
Las reacciones de reducción son reacciones redox importantes para contaminantes ambientales en ambientes anaeróbicos como sedimentos y acuíferos subterráneos. En estas condiciones, los productos químicos orgánicos que contienen grupos funcionales reducibles como ácidos carboxílicos y grupos nitro experimentan reacciones de reducción (Cuadro 1).
Cuadro 1: Ejemplos de reacciones químicas redox que pueden ocurrir en el ambiente (adaptado de Schwarzenbach et al. 2017)
Fotodegradación
La luz solar es una fuente importante de energía para iniciar reacciones químicas y las reacciones fotoquímicas son particularmente importantes en la atmósfera. Los compuestos aromáticos y otros productos químicos que contienen enlaces insaturados que son capaces de absorber la luz en el rango de frecuencia disponible en la luz solar salen (energizados) y esto puede conducir a reacciones químicas. Estas reacciones conducen a la escisión de enlaces entre los átomos de carbono y otros átomos como los halógenos para producir especies radicales. Estos radicales son altamente reactivos y reaccionan adicionalmente para eliminar los radicales hidrógeno u OH del agua para producir enlaces C-H o C-OH o pueden reaccionar consigo mismos para producir moléculas más grandes. Ejemplos bien conocidos de reacciones estratosféricas fotoquímicas atmosféricas de CFC que han tenido un impacto negativo en la llamada capa de ozono y oxidaciones fotoquímicas de hidrocarburos que están involucrados en la generación de smog.
En el ambiente acuático, la penetración de la luz es suficiente para provocar reacciones fotoquímicas de químicos orgánicos en la superficie del agua o en la capa superior de agua clara. La presencia de partículas en un cuerpo de agua reduce la intensidad de la luz a través de la dispersión de la luz, al igual que la materia orgánica disuelta a través La fotodegradación contribuye significativamente a eliminar derrames de petróleo y parece favorecer la degradación de alcanos de cadena más larga en comparación con el ataque preferencial de alcanos lineales y pequeños por biodegradación (Garrett et al., 1998). Los cicloalcanos y los hidrocarburos aromáticos también se eliminan por fotodegradación (D'Auria et al., 2009). Se sabe comparativamente poco sobre el papel de la fotodegradación de otros contaminantes orgánicos en el medio marino aunque hay, por ejemplo, evidencia de que el triclosán es eliminado por fotólisis en la zona de la Bight alemana del Mar del Norte (Xie et al., 2008). En el ambiente del suelo, hay alguna evidencia de que la fotodegradación puede contribuir a la eliminación de una variedad de químicos orgánicos como pesticidas y químicos presentes en los lodos de aguas residuales que se utilizan como enmienda del suelo pero la importancia de este proceso no está clara. De igual manera, los químicos que se han acumulado en el hielo, por ejemplo como resultado del transporte de largo alcance a regiones polares, también parecen ser susceptibles a la fotodegradación. Algunos ejemplos de reacciones de fotodegradación se muestran en la Figura 4.
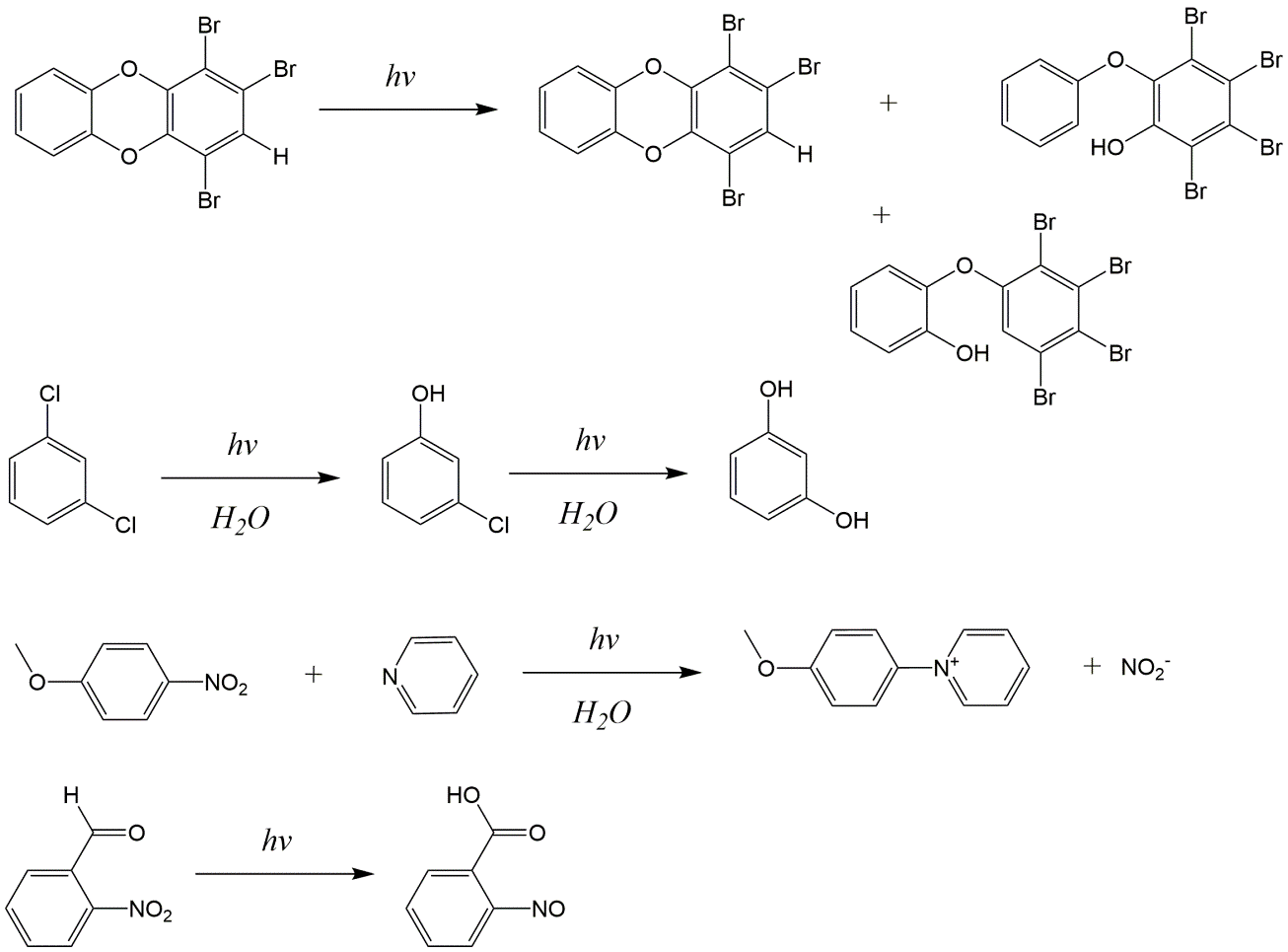
Una categoría importante de reacciones fotoquímicas son las reacciones indirectas en las que los químicos orgánicos reaccionan con radicales producidos fotoquímicamente, en particular con especies reactivas de oxígeno como radicales OH, ozono y oxígeno singlete. Estas especies reactivas están presentes en concentraciones muy bajas pero son tan reactivas que bajo ciertas condiciones pueden contribuir significativamente a la eliminación de químicos orgánicos. Los productos de estas reacciones son una variedad de derivados oxidados que son ellos mismos radicales y por lo tanto reaccionan más. Los radicales OH son los más importantes de estas especies producidas fotoquímicamente y pueden reaccionar con químicos orgánicos eliminando radicales de hidrógeno, reaccionando con enlaces insaturados en alquenos, aromáticos, etc. para producir productos hidroxilados. En el agua, la materia orgánica natural absorbe la luz y puede participar en reacciones indirectas de fotodegradación. Otros constituyentes en las aguas superficiales, como los óxidos de nitrógeno y los complejos de hierro, también pueden estar involucrados en reacciones de fotodegradación indirecta.
Referencias
Schwarzenbach, R.P., Gschwend, P.M., Imboden, D.M. (2017). Química Orgánica Ambiental, Tercera Edición, Wiley, ISBN 978-1-118-76723-8
van Leeuwen, C.J., Vermeire, T.G. (2007). Evaluación de riesgos de productos químicos: una introducción (2a ed.), Springer, ISBN 978-1-4020-6101-1
¿Qué químicos orgánicos esperarías que sufran degradación hidrolítica en el medio ambiente? Explique por qué estas reacciones dependen del pH.
A menudo se observa que las reacciones reductoras de deshalogenación ocurren para compuestos organoclorados en ambientes anaeróbicos. ¿Por qué estas reacciones se llaman deshalogenación reductiva? ¿Qué productos esperarías que se formaran por la deshalogenación reductora del tetracloroeteno (Cl 2 C=CCl 2)? Describir dos formas en que las bacterias están involucradas en estas reacciones.
¿En qué compartimentos ambientales es la transformación fotoquímica o fotodegradación un mecanismo de degradación potencialmente importante para los químicos orgánicos y por qué es este el caso? Explicar con ejemplos las diferencias entre fotodegradación directa e indirecta en el ambiente.
3.7.2. Biodegradación
Autor: John Parsons
Críticos: Steven Droge, Russell Davenport
Objetivos de Inclinación:
Deberías ser capaz de:
- la contribución de las reacciones bioquímicas en la eliminación de químicos del medio ambiente
- explicar las diferencias entre biotransformación, biodegradación primaria y mineralización
- describir las reacciones de biodegradación más importantes en condiciones aeróbicas y anaeróbicas
Palabras clave: Biodegradación primaria, mineralización, químicos fácilmente biodegradables, químicos persistentes, reacciones de oxigenación, reacciones de reducción
Introducción:
Tanto la biodegradación como la biotransformación se refieren a reacciones de degradación que son catalizadas por enzimas. En general, la biodegradación suele utilizarse para describir la degradación que llevan a cabo los microorganismos y la biotransformación a menudo se refiere a reacciones que siguen a la captación de sustancias químicas por organismos superiores. Esta distinción es importante y surge del papel que desempeñan las bacterias y otros microorganismos en los ciclos biogeoquímicos naturales. Como resultado, los microorganismos tienen la capacidad de degradar la mayoría (quizás todos) de los productos químicos orgánicos naturales en la materia orgánica y convertirlos en productos finales inorgánicos. Estas reacciones suministran a los microorganismos los nutrientes y la energía que necesitan para crecer. Esta amplia capacidad degradativa significa que son capaces de degradar muchos productos químicos antropogénicos y potencialmente convertirlos en productos finales inorgánicos, un proceso que se conoce como mineralización.
Aunque los organismos superiores también son capaces de degradar (metabolizar) muchos químicos antropogénicos, estos químicos no son absorbidos como fuente de nutrientes y energía. Muchos químicos antropogénicos pueden perturbar los procesos de funcionamiento celular, y el proceso de biotransformación se ha propuesto como un mecanismo de desintoxicación. Los químicos indeseables que pueden acumularse a niveles potencialmente dañinos se convierten en productos que se excretan más rápidamente. En la mayoría de los casos, una unidad polar y/o ionizable se une al químico en uno o dos pasos, lo que hace que el compuesto sea más soluble en sangre y se elimine más fácilmente a través de los riñones a la orina. Esto también hace que la mayoría de los productos químicos peligrosos sean menos tóxicos que el químico original. Tales etapas de biotransformación siempre cuestan energía (ATP, o mediante el uso de, por ejemplo, NADH o NADPH en las reacciones enzimáticas) del organismo. La biotransformación a veces también se usa para describir la degradación por microorganismos cuando esta se limita a una conversión de un químico en un nuevo producto.
La biodegradación es para muchos contaminantes orgánicos el proceso principal que los elimina del medio ambiente. Por lo tanto, medir las tasas de biodegradación es un aspecto destacado de la evaluación del riesgo químico. Se han desarrollado protocolos estandarizados reconocidos internacionalmente para medir las tasas de biodegradación de los productos químicos. Bien conocido ejemplos de estos son los Lineamientos OCED. Estas pautas incluyen pruebas de cribado diseñadas para identificar productos químicos que pueden considerarse fácilmente (es decir, rápidamente) biodegradables, así como pruebas más complejas para medir las tasas de biodegradación de los productos químicos que se degradan lentamente en una variedad de entornos simulados. Para estudios mecanicistas más complejos, microorganismos capaces de degradar químicos específicos se aíslan de muestras ambientales y se cultivan en sistemas de laboratorio.
En principio, la biodegradación de una sustancia química puede determinarse ya sea siguiendo la concentración del químico durante el ensayo o siguiendo la conversión a productos finales (en la mayoría de los casos midiendo el consumo de oxígeno o la producción de CO 2). Si bien la medición de la concentración proporciona la información más directamente relevante sobre un químico, requiere la disponibilidad o desarrollo de métodos analíticos que no siempre están dentro de la capacidad de los laboratorios de pruebas de rutina. La medición de la conversión a CO 2 es comparativamente sencilla, pero debe contabilizarse la producción de CO 2 a partir de otros productos químicos presentes en el sistema de ensayo (como el suelo o la materia orgánica disuelta). Esto se puede hacer usando 14 productos químicos etiquetados con C en las pruebas pero no todos los laboratorios cuentan con instalaciones para ello. La principal ventaja de este enfoque es que la demostración de la conversión cuantitativa de un químico a CO 2 etc. significa que no hay preocupación por la acumulación de metabolitos potencialmente tóxicos.
Dado que es un proceso enzimáticamente catalizado, las tasas de biodegradación deben modelarse utilizando la cinética de Michaelis Menten, o la cinética de Monod si se toma en cuenta el crecimiento de los microorganismos. En la práctica, sin embargo, a menudo se utilizan cinéticas de primer orden para modelar la biodegradación en ausencia de crecimiento significativo de los microorganismos degradantes. Esto es más conveniente que usando cinética de Michaelis Menten pero hay alguna justificación para esta simplificación ya que las concentraciones de químicos en el ambiente son en general mucho menores que las concentraciones de media saturación de las enzimas degradantes.
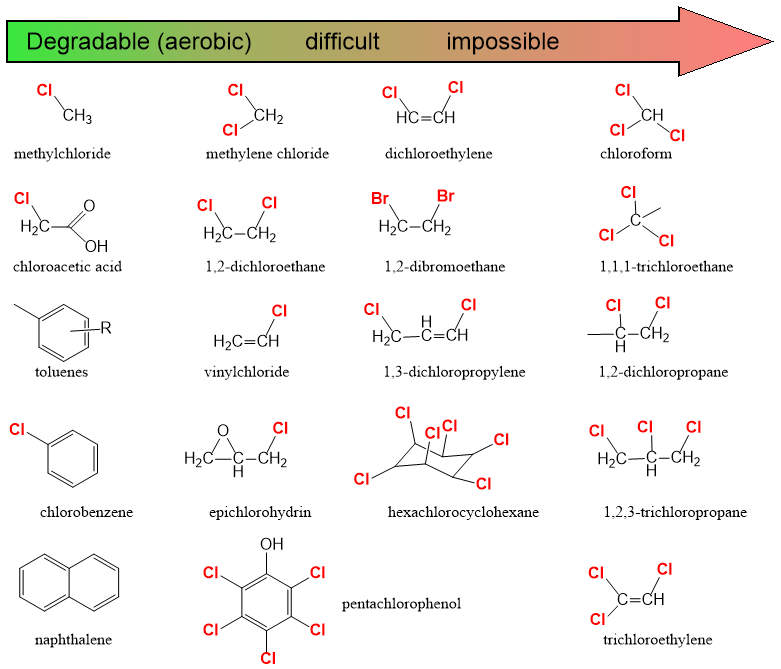
Cuadro 1. Influencia de la estructura molecular en la biodegradabilidad de los químicos en el ambiente aeróbico.
|
Tipo de compuestos o sustituyentes |
Más biodegradable |
Menos biodegradables |
|
hidrocarburos |
alcanos lineales < C 12 |
alcanos lineales > C 12 |
|
alcanos con un peso molecular no demasiado alto |
alcanos de alto peso molecular |
|
|
cadena lineal |
cadena ramificada |
|
|
-C-C-C- |
-C-O-C- |
|
|
alifático |
aromático |
|
|
cloro alifático |
Cl más de 6 carbonos del terminal C |
Cl a menos de 6 carbonos del terminal C |
|
Subyuyentes a un anillo aromático |
-OH |
-F |
|
-CO 2 H |
-Cl |
|
|
-NH 2 |
-NO 2 |
|
|
-OCH 3 |
-CF 3 |
Ya sea expresado como términos de cinética de primer orden o parámetros de Michaelis Menten, las tasas de biodegradación varían ampliamente para diferentes químicos, lo que demuestra que la estructura química tiene un gran impacto en la biodegradación. Sin embargo, a menudo se observan grandes variaciones en las tasas de biodegradación para el mismo químico en diferentes sistemas experimentales. Esto demuestra que las propiedades y condiciones ambientales también juegan un papel clave en la determinación de la eliminación por biodegradación y a menudo es casi imposible distinguir los efectos de las propiedades químicas de los de las propiedades ambientales. En otras palabras, no existe tal cosa como una tasa intrínseca de biodegradación de una sustancia química. Sin embargo, podemos derivar algunas relaciones genéricas entre la estructura y biodegradabilidad de los productos químicos, como se enumera en el Cuadro 1. Los ejemplos son que las estructuras de hidrocarburos ramificados se degradan más lentamente que las estructuras de hidrocarburos lineales, y los productos químicos cíclicos y en particular aromáticos se degradan más lentamente que los productos químicos alifáticos (no aromáticos). Los sustituyentes y grupos funcionales también tienen un impacto importante en la biodegradabilidad con halógenos y otros sustituyentes aceptores de electrones que tienen efectos fuertemente negativos. Por lo tanto, no es de extrañar que la lista de contaminantes orgánicos persistentes esté dominada por compuestos organohalógenos y en particular aquellos con estructuras aromáticas o alicíclicas.
Debe reconocerse que a menudo se ha observado que las tasas de biodegradación cambian con el tiempo. A menudo se ha observado que la exposición a largo plazo de las comunidades microbianas a nuevos químicos conduce a un aumento de las tasas de biodegradación. Este fenómeno se llama adaptación o aclimatación y suele ser el caso después de la aplicación repetida de un pesticida en el mismo lugar. Se muestra un ejemplo para la atrazina en la Figura 2 donde las tasas de degradación aumentan después de una exposición más prolongada al pesticida.
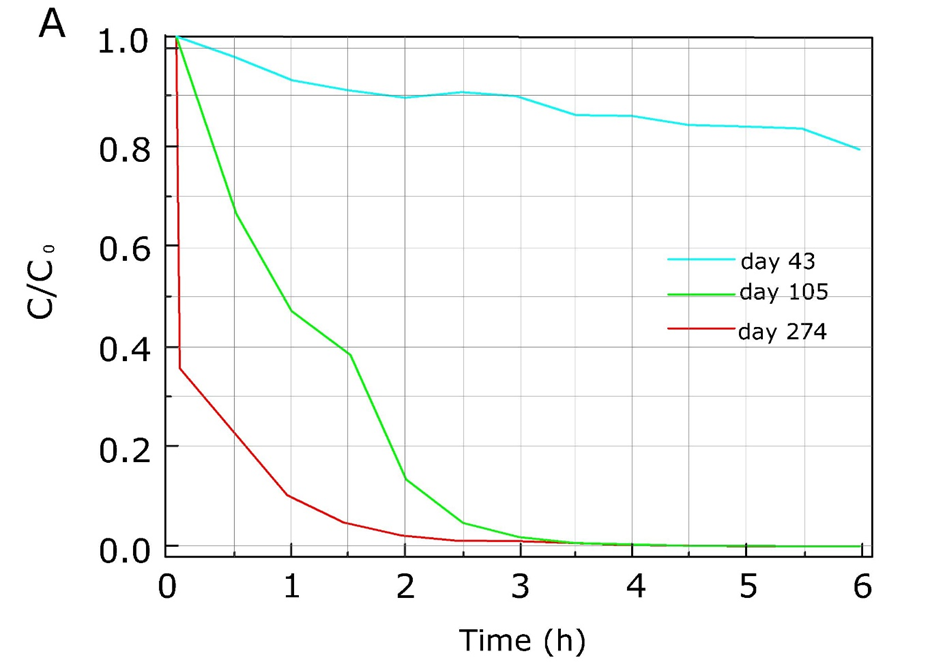
Otro ejemplo reciente son las diferencias en las tasas de biodegradación del coadyuvante L-GLDA (diacetato de glutamato tetrasódico) por lodos activados de diferentes plantas de tratamiento de aguas residuales en Estados Unidos. Los lodos de regiones donde el L-GLDA no estaba o solo recientemente en el mercado requirieron un tiempo de retraso prolongado antes de que comenzara la degradación, mientras que los lodos de regiones donde los productos que contenían L-GLDA habían estado disponibles durante varios meses requerían fases de retraso
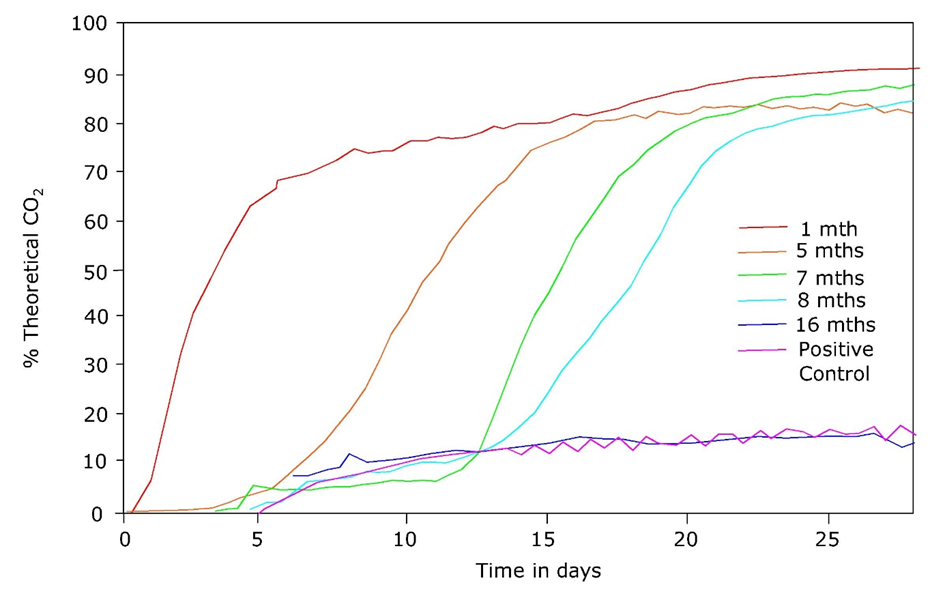
La adaptación puede ser el resultado de i) cambios en la composición o abundancia de especies en una comunidad bacteriana, ii) mutaciones dentro de poblaciones individuales, iii) transferencia horizontal de ADN o iv) eventos de recombinación genética, o combinaciones de estos.
Reacciones y vías de biodegradación
La biodegradación de los químicos que consideramos contaminantes se produce cuando estos químicos se incorporan al metabolismo de microorganismos. Por lo tanto, las reacciones involucradas en la biodegradación son similares a las involucradas en reacciones metabólicas comunes, como hidrolizaciones, oxidaciones y reducciones. Dado que la conversión de una sustancia química orgánica a CO 2 es una reacción de oxidación global, las reacciones de oxidación que involucran oxígeno molecular son probablemente las reacciones más importantes. Estas reacciones con oxígeno son a menudo el primer paso pero esencial en la degradación y pueden considerarse como la etapa de activación convirtiendo moléculas relativamente estables en intermedios más reactivos. Esto es particularmente importante para los productos químicos aromáticos ya que se requiere oxigenación para hacer que los anillos aromáticos sean susceptibles a la escisión del anillo y a la degradación adicional. Estas reacciones son catalizadas por enzimas llamadas oxigenasas de las cuales existen en términos generales dos clases. Las monoxigenasas son enzimas que catalizan reacciones en las que un átomo de oxígeno de O 2 reacciona con una molécula orgánica para producir un producto hidroxilado. Ejemplos de tales enzimas son la familia del citocromo P450 y están presentes en todos los organismos. Estas enzimas están involucradas por ejemplo en la oxidación de alcanos a ácidos carboxílicos como parte de la ruta de “beta-oxidación”, que acorta los ácidos alcanoicos lineales en etapas de unidades C2, como se muestra en la Figura 4.
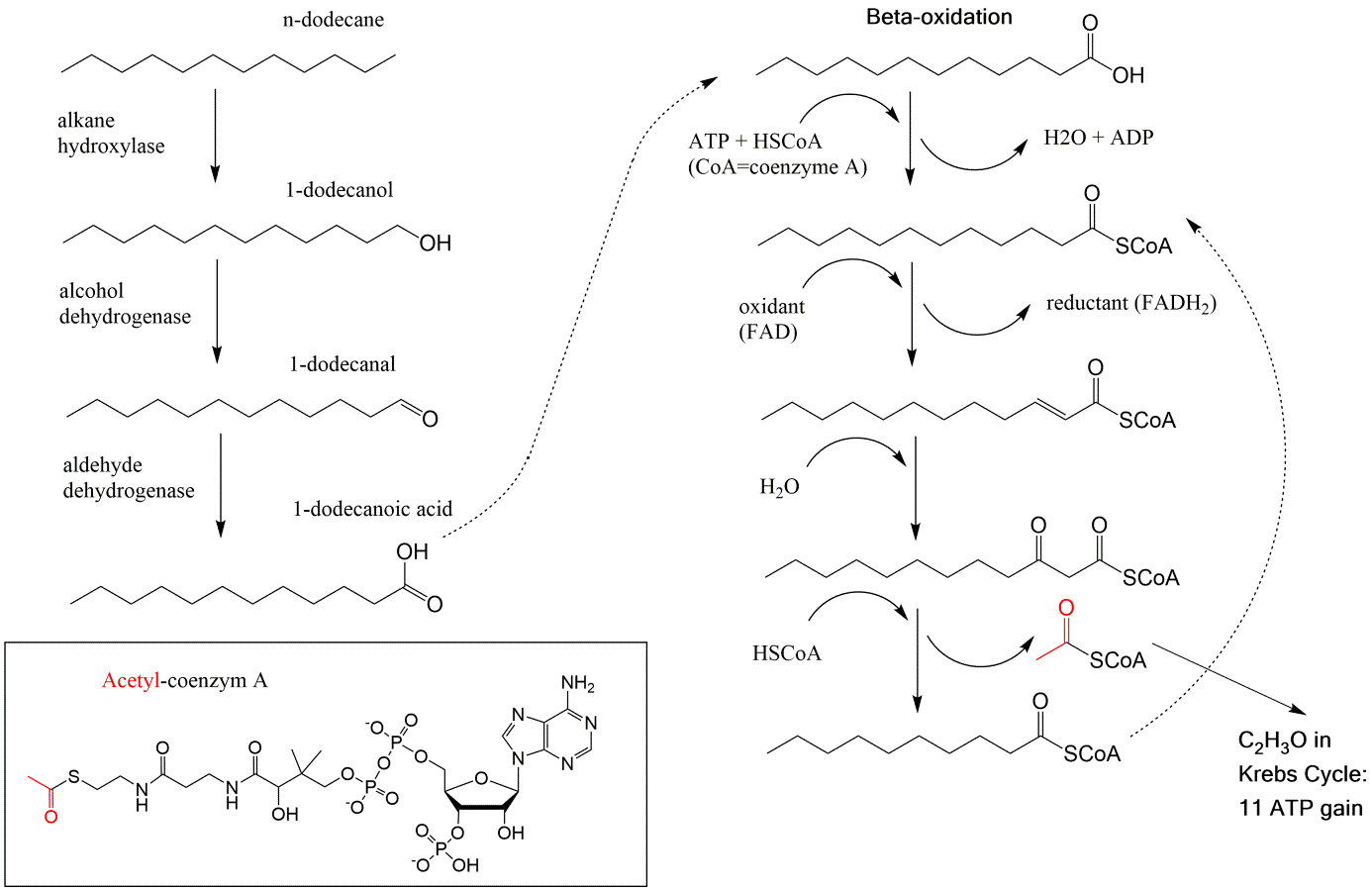
Las dioxigenasas son enzimas que catalizan reacciones en las que ambos átomos de oxígeno del O 2 reaccionan con productos químicos orgánicos y parecen ser exclusivos de microorganismos como bacterias. Ejemplos de estas reacciones se muestran para el benceno en la Figura 5. Reacciones similares están involucradas en la degradación de químicos aromáticos más complejos como HAP y aromáticos halogenados.
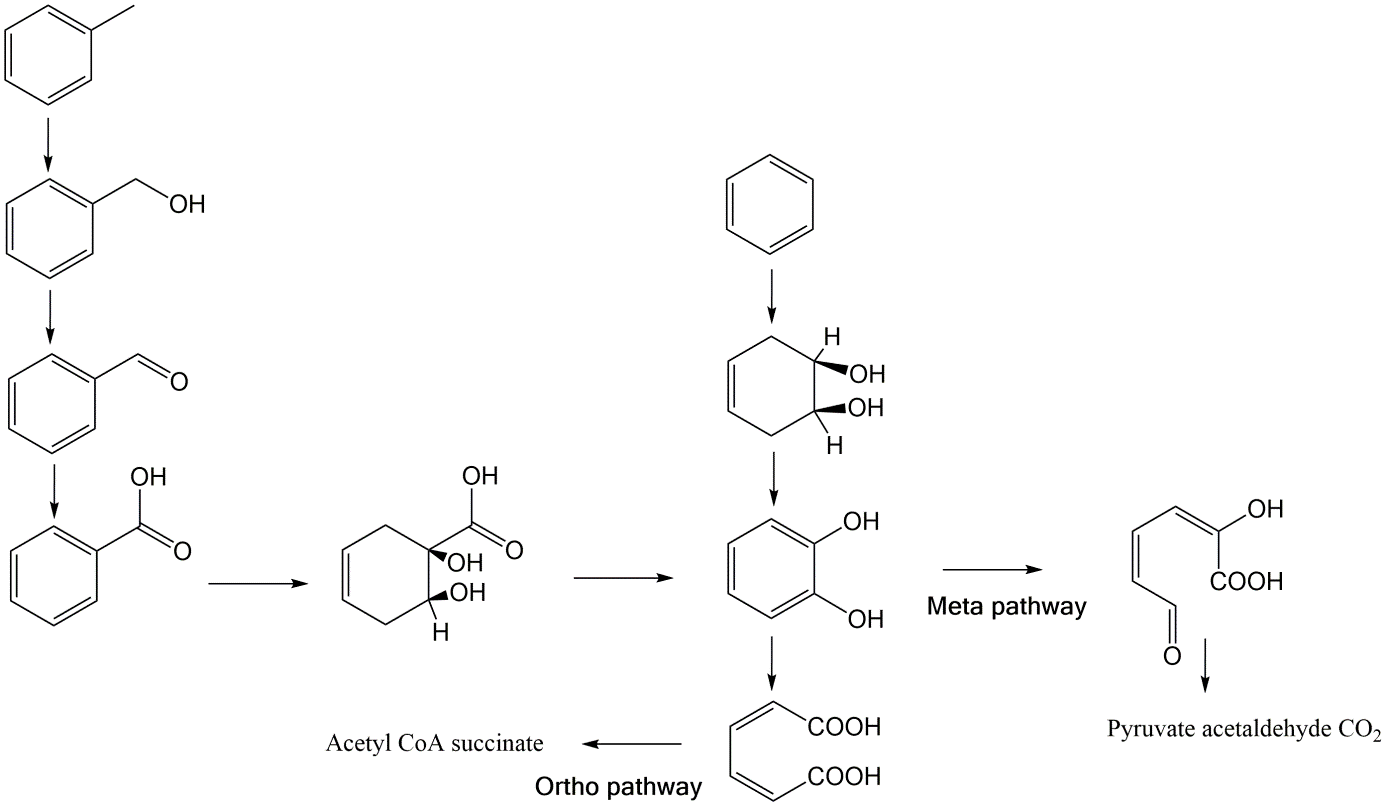
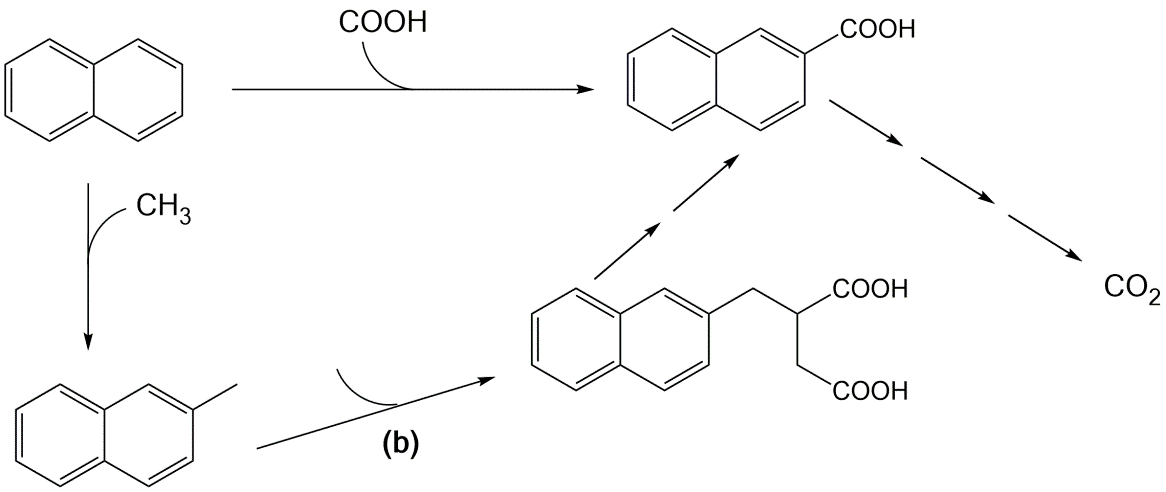
La ausencia de oxígeno en ambientes anaeróbicos (sedimentos y aguas subterráneas) no excluye la oxidación de los químicos orgánicos. Otros oxidantes presentes (nitrato, sulfato, Fe (III) etc) pueden estar presentes en concentraciones suficientemente altas para actuar como oxidantes y aceptores de electrones terminales que apoyan el crecimiento microbiano. En ausencia de oxígeno, la activación se basa en otras reacciones, las reacciones más importantes parecen ser la carboxilación o adición de fumarato. La Figura 6 muestra un ejemplo de la degradación de naftaleno a CO 2 en microcosmos de sedimentos bajo condiciones reductoras de sulfato.
Otras reacciones importantes en los ecosistemas anaeróbicos (sedimentos y penachos de agua subterránea) son las reducciones. Esto afecta a grupos funcionales, por ejemplo reducción de ácidos a aldehídos a alcoholes, grupos nitro a grupos amino y, particularmente importante, sustitución de halógenos por hidrógeno. Estas últimas reacciones pueden contribuir a la conversión de productos químicos altamente clorados, que son resistentes a la biodegradación oxidativa, a productos menos clorados que son más susceptibles a la biodegradación aeróbica. Se ha demostrado que muchos ejemplos de estas reacciones reductoras de deshalogenación ocurren, por ejemplo, en aguas subterráneas contaminadas con tetracloroeteno (por ejemplo, de procesos de limpieza en seco) y sedimentos contaminados con PCB. Estas reacciones son exotérmicas bajo condiciones anaeróbicas y algunos microorganismos son capaces de cosechar esta energía para apoyar su crecimiento. Esto puede considerarse como una forma de respiración basada en la descloración y a veces se la conoce como clororespiración.
Como es el caso de la degradación abiótica, las hidrolizas también son reacciones importantes en las vías de biodegradación, particularmente para los químicos que son derivados de ácidos orgánicos, como los plaguicidas carbamato, éster y organofosfato donde las hidrolizas suelen ser el primer paso en su biodegradación. Estas reacciones son similares a las descritas en la sección sobre Degradación química.
Referencias
Irich, N.R., McDonough, K.M., van Ginkel, C.G., Bisinger, E.C., LePage, J.N., Schaefer, E.C., Menzies, J.Z., Casteel, K.D., Federle, T.W. (2015). Adaptación microbiana generalizada a L-glutamato-N, N, -diacetato (L-GLDA) tras su introducción en el mercado en un producto de limpieza de consumo. Ciencia y Tecnología Ambiental 49, 13314-13321.
Janssen, D. B., Dinkla, I. J. T., Poelarends, G. J., Terpstra, P. (2005). Degradación bacteriana de compuestos xenobióticos: evolución y distribución de nuevas actividades enzimáticas, Microbiología Ambiental 7, 1868-1882.
Kleemann, R., Meckenstock, R.U. (2017). Degradación anaerobia de naftaleno por bacterias grampositivas reductoras de hierro. FEMS Ecología Microbiana 78, 488-496.
Schwarzenbach, R.P., Gschwend, P.M., Imboden, D.M. (2017). Química Orgánica Ambiental, Tercera Edición, Wiley, ISBN 978-1-118-76723-8
Van Leeuwen, C., Vermeire, T.G. (2007). Evaluación de riesgos de productos químicos: una introducción (2a ed.), Springer, ISBN 978-1-4020-6101-1
Zhou, Q., Chen, L. C., Wang, Z., Wang, J., Ni, S., Qiu, J., Liu, X., Zhang, X., Chen, X. (2017). Rápida degradación de la atrazina por los cultivos mixtos enriquecidos a partir de lodos activados y análisis de su sucesión de comunidades microbianas. Ciencia ambiental e investigación de la contaminación 24, 22152-22157.
La degradación por microorganismos juega un papel importante en el destino ambiental de los químicos orgánicos industriales. Explique brevemente por qué el papel de los microorganismos es tan importante.
Las tasas de biodegradación dependen, entre otros factores, de la estructura de los productos químicos. Mencionar tres factores estructurales responsables de la lenta biodegradación.
El DDT es una de las “docenas sucias” originales de Contaminantes Orgánicos Persistentes (COP). Explique qué son estos COP y por qué son etiquetados como persistentes. ¿Qué características estructurales son responsables de que sean etiquetados como COP?
Se descubre que el agua subterránea utilizada para preparar agua potable está contaminada con tolueno y tetracloroeteno. Aunque no se sabe nada sobre las condiciones geoquímicas en el acuífero de agua subterránea, se le pide que investigue si existe alguna evidencia de biodegradación de estos compuestos que ocurren en el acuífero. Sugerir qué compuestos podrían analizarse como evidencia de biodegradación.
3.7.3. Métodos de ensayo de degradación
Autores: John Parsons
Críticos: Steven Droge, Russell Davenport
Objetivos de Inclinación:
Deberías ser capaz de:
- explicar la estrategia utilizada en las pruebas estandarizadas de biodegradabilidad
- describir los aspectos más importantes de los protocolos estándar de pruebas de biodegradabilidad
- interpretar los resultados de las pruebas estandarizadas de biodegradabilidad
Palabras clave: Destino ambiental, degradación química, degradación fotoquímica, biodegradación, mineralización, tasa de degradación
Introducción
Muchos enfoques experimentales son posibles para medir la degradación ambiental de los productos químicos, que van desde experimentos de laboratorio altamente controlados hasta estudios de monitoreo ambiental. Si bien cada uno de estos enfoques tiene sus ventajas y desventajas, un conjunto estandarizado y relativamente sencillo de protocolos tiene claras ventajas como la idoneidad para una amplia gama de laboratorios, amplia aceptación científica y regulatoria y comparabilidad para diferentes productos químicos.
El sistema de directrices de prueba de la OCDE (ver enlaces en la lista de referencia de este capítulo) es el conjunto más importante de protocolos estandarizados aunque otros sistemas de prueba pueden ser utilizados en otros contextos regulatorios. Además de pruebas que cubren procesos de destino ambiental, también cubren propiedades físico-químicas, bioacumulación, toxicidad, etc. Estas pautas han sido desarrolladas en un contexto internacional y son adoptadas oficialmente después de extensas validaciones y pruebas en diferentes laboratorios. Esto asegura su amplia aceptación y aplicación en diferentes contextos regulatorios para la evaluación de riesgos y riesgos químicos.
Ensayos de degradación química
Los Lineamientos de la OCDE incluyen solo dos pruebas específicas para la degradación química. Esto puede parecer sorprendente pero no debe olvidarse que la degradación química también podría contribuir a la eliminación observada en las pruebas de biodegradabilidad. Las Directrices de la OCDE para la degradación química son la Prueba 111 de la OCDE: Hidrólisis en Función del pH (OCDE 2004) y la Prueba 316 de la OCDE: Fototransformación de Productos Químicos en Agua - Fotólisis Directa (OCDE 2008). Si se desea, también se pueden usar controles esterilizados para determinar la contribución de la degradación química en las pruebas de biodegradabilidad.
La Prueba 111 de la OCDE mide las transformaciones hidrolíticas de sustancias químicas en sistemas acuáticos a valores de pH que normalmente se encuentran en el ambiente (pH 4 - 9). Las soluciones tampón acuosas estériles de diferentes valores de pH (pH 4, 7 y 9) que contienen sustancia problema radiomarcada o no marcada (por debajo de la saturación) se incuban en la oscuridad a temperatura constante y se analizan después de intervalos de tiempo apropiados para la sustancia problema y para los productos de hidrólisis. El ensayo preliminar se realiza durante 5 días a 50°C y pH 4.0, 7.0 y 9.0, esto se conoce como prueba de primer nivel. Otras pruebas de segundo nivel estudian la hidrólisis de sustancias inestables y la identificación de productos de hidrólisis y pueden extenderse por 30 días.
La prueba 316 de la OCDE mide las constantes de velocidad de fotólisis directa utilizando una lámpara de arco de xenón capaz de simular la luz solar natural en los 290 a 800 nm o luz solar natural, y extrapolada al agua natural. Si las pérdidas estimadas son superiores o iguales a 20%, se identifican la vía de transformación y las identidades, concentraciones y tasa de formación y declive de los principales productos de transformación.
Pruebas de biodegradabilidad
La biodegradación se considera en general como el proceso de eliminación más importante de los químicos orgánicos en el medio ambiente y, por lo tanto, no es de sorprender que las pruebas de biodegradabilidad jueguen un papel clave en la evaluación del destino ambiental y los riesgos de exposición posteriores de los productos químicos. La biodegradación es un área ampliamente investigada, pero los datos de pruebas estandarizadas son favorecidos para fines regulatorios, ya que se supone que producen datos reproducibles y comparables. Las pruebas estandarizadas se han desarrollado a nivel internacional, lo que es más importante bajo los auspicios de la OCDE y forman parte de la gama más amplia de pruebas para medir las propiedades físico-químicas, ambientales y toxicológicas de los productos químicos. En el Cuadro 1 se ofrece una visión general de estas pruebas de biodegradabilidad.
La forma en que se implementan las pruebas de biodegradabilidad puede variar en detalle dependiendo del contexto regulatorio pero en general se basa en un enfoque escalonado con todos los productos químicos sometidos a pruebas de cribado para identificar productos químicos que pueden considerarse fácilmente biodegradables y, por lo tanto, eliminados rápidamente de plantas de tratamiento de aguas residuales (EDAR) y el medio ambiente en general. Estas pruebas fueron desarrolladas originalmente para surfactantes y a menudo utilizan lodos activados de EDAR como fuente de microorganismos ya que la biodegradación durante el tratamiento de aguas residuales es un importante conducto de emisiones químicas al medio ambiente. Las llamadas pruebas de biodegradabilidad listas están diseñadas para ser rigurosas con bajas concentraciones bacterianas y la sustancia problema como única fuente potencial de carbono y energía a altas concentraciones. El supuesto es que los químicos que muestran una rápida biodegradación bajo estas condiciones desfavorables siempre se degradarán rápidamente en condiciones ambientales. La biodegradación se determina como conversión a CO 2 (mineralización), ya sea mediante la medición directa del CO 2 producido, o el consumo de oxígeno, o la eliminación del carbono orgánico disuelto, ya que este es el resultado más deseable de la biodegradación. Los resultados que se deben lograr para que una sustancia química sea considerada fácilmente biodegradable varían ligeramente dependiendo de la prueba, pero como ejemplo en la prueba OECD 301D (OCDE 2014), el consumo de oxígeno debe alcanzar el 70% del teóricamente requerido para la mineralización completa dentro de los 28 días.
Cuadro 1. Las pruebas de biodegradabilidad de la OCDE
|
Guía de prueba de la OCDE |
PARÁMETROS |
REFERENCIA |
|
Pruebas de biodegradabilidad listas |
||
|
301A: Prueba de troquelado DOC |
DOC |
OCDE 1992a |
|
301B: Prueba de evolución de CO 2 |
CO 2 |
OCDE 1992a |
|
301C: Prueba MITI (I) modificada |
O 2 |
OCDE 1992a |
|
301D: Prueba de botella cerrada |
O 2 |
OCDE 1992a |
|
301E: Prueba de cribado de la OCDE modificada |
DOC |
OCDE 1992a |
|
301F: Prueba de respirometría manométrica |
O 2 |
OCDE 1992a |
|
306: Biodegradabilidad en agua de mar |
DOC |
OCDE 1992c |
|
310: Prueba No. 310: Biodegradabilidad Listo - CO 2 en recipientes sellados (Prueba de espacio de cabeza). |
CO 2 |
OCDE 2014 |
|
Pruebas de biodegradabilidad inherentes |
||
|
302A: Prueba de Lodos Activados Semicontinuos Modificados (SCAS) |
DOC |
OCDE 1981b |
|
302B: Prueba de Zahn-Wellens |
DOC |
OCDE 1992b |
|
302C: Prueba MITI (II) modificada |
O 2 |
OCDE 2009 |
|
Pruebas de simulación |
||
|
303A: Unidades de lodos activados |
DOC |
OCDE 2001 |
|
303B: Biofilms |
DOC |
OCDE 2001 |
|
304A: Biodegradabilidad inherente en el suelo |
14 CO 2 |
OCDE 1981a |
|
307: Transformación aeróbica y anaeróbica en suelo |
14 CO 2 /CO 2 |
OCDE 2002a |
|
308: Transformación aeróbica y anaeróbica en sistemas de sedimentos acuáticos |
14 CO 2 /CO 2 |
OCDE 2002b |
|
309: Mineralización aeróbica en aguas superficiales |
14 CO 2 /CO 2 |
OCDE 2004b |
|
311: Biodegradabilidad anaeróbica de compuestos orgánicos en lodos digeridos: por medición de la producción de gas |
CO 2 y CH 4 |
OECD 2006 |
|
314: Pruebas de simulación para evaluar la biodegradabilidad de los productos químicos descargados en aguas residuales |
Concentración de químicos, 14 CO 2 /CO 2 |
OCDE 2008a |
Estos sistemas de prueba se aplican ampliamente con fines regulatorios pero sí tienen una serie de problemas. Estos incluyen el hecho de que existen dificultades prácticas cuando se aplican a productos químicos volátiles o poco solubles, pero probablemente lo más importante es que para algunos químicos los resultados pueden ser muy variables. Esto suele atribuirse a la fuente de los microorganismos utilizados para inocular el sistema. Para muchos productos químicos, existe una amplia variabilidad en la rapidez con la que son degradados por lodos activados de diferentes EDAR. Esto es probablemente el resultado de diferentes concentraciones de exposición y períodos de exposición a los químicos, y también puede ser causado por la dependencia de la capacidad de pequeñas poblaciones de microorganismos degradantes, que no siempre pueden incluirse en las muestras de lodo utilizadas en las pruebas. Estos temas no se tratan de ninguna manera sistemática en las pruebas de biodegradabilidad. Se ha sugerido que un periodo preliminar de exposición a los productos químicos a ensayar permitiría que los lodos se adaptaran a los productos químicos y podría producir resultados de prueba más reproducibles. Otras sugerencias incluyen el uso de una concentración mayor, más relevante para el medio ambiente, de lodo activado como inóculo.
El incumplimiento de los criterios de aprobación en pruebas de biodegradabilidad listas no significa necesariamente que el químico sea persistente en el ambiente ya que es posible que se produzca una biodegradación lenta. Por lo tanto, estos productos químicos pueden someterse a pruebas de niveles superiores, para lo que se denomina biodegradabilidad inherente en ensayos realizados en condiciones más favorables o en pruebas de simulación que representan compartimentos específicos, para determinar si la biodegradación puede contribuir significativamente a su remoción. Estas pruebas también están estandarizadas (ver Cuadro 1). Las pruebas de simulación están diseñadas para representar las condiciones ambientales en compartimentos específicos, como el potencial redox, el pH, la temperatura, la comunidad microbiana, la concentración de la sustancia problema y la ocurrencia y concentración de otros sustratos.
Los criterios utilizados para clasificar la biodegradabilidad de los productos químicos dependen del contexto regulatorio. Las pruebas de biodegradabilidad se pueden utilizar para diferentes propósitos: en la UE esto incluye 3 propósitos distintos; clasificación y etiquetado, evaluación de peligro/persistencia y evaluación de riesgos ambientales Recientemente, el énfasis regulatorio se ha desplazado hacia la identificación de productos químicos peligrosos y, por lo tanto, aquellos químicos que son menos biodegradables y susceptibles de persistir en el medio ambiente. En el Cuadro 2 se muestran ejemplos para la clasificación como productos químicos PBT (persistentes, bioacumulativos y tóxicos) o VPvB (muy persistentes y muy bioacumulativos). Además de los resultados de pruebas estandarizadas, otros datos como los resultados de datos de monitoreo ambiental o estudios sobre la microbiología de la biodegradación también pueden ser tomados en cuenta en evaluaciones de degradación ambiental en un enfoque llamado peso de evidencia.
Cuadro 2. Criterios utilizados para clasificar productos químicos como PBT o VPvB (van Leeuwen & Vermeire 2007)
|
Propiedad |
Criterios PBT |
Criterios VPvb |
|
Persistencia |
T 1/2 >60 días en agua marina, o T 1/2 >40 días en agua fresca/estuarina, o T 1/2 >180 días en sedimentos marinos, o T 1/2 >120 días en sedimentos frescos/estuarinos, o T 1/2 >120 días en suelo. |
T 1/2 >60 días en agua marina, fresca o estuarina, o T 1/2 >180 días en sedimentos marinos, frescos o estuarinos, o T 1/2 >180 días en suelo |
|
Bioacumulación |
BCF > 2000 L/kg |
BCF > 5000 L/kg |
|
Toxicidad |
- NOEC < 0.01 mg/L para organismos marinos o de agua dulce, o - sustancia se clasifica como cancerígena, mutagénica o tóxica para la reproducción, o - hay otras evidencias de toxicidad crónica, de acuerdo con la Directiva 67/548/CEE |
Los resultados de las pruebas de biodegradabilidad a veces también se utilizan para derivar datos de entrada para modelos de destino ambiental (ver sección Modelado multicompartimental). Sin embargo, no siempre es sencillo transferir datos medidos en lo que a veces es un sistema de prueba multicompartimental a tasas de degradación en compartimentos individuales, ya que otros procesos (por ejemplo, partición) deben tenerse en cuenta.
Referencias
OCDE, 1981a. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 304A: Biodegradabilidad Inherente en Suelo.
OCDE, 1981b. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 302A: Biodegradabilidad Inherente: Ensayo SCAS Modificado.
OCDE, 1992a. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 301: Biodegradabilidad Listo.
OCDE, 1992b. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 302B: Biodegradabilidad Inherente: Prueba de Zahn-Wellens/ EVPA.
OCDE, 1992c. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 306: Biodegradabilidad en Agua de Mar.
OCDE, 2001. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 303: Prueba Simulación - Tratamiento Aerobio de Aguas Residuales - A: Unidades de Lodos Activados; B: Biofilms
OCDE, 2002a. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 307: Transformación Aerobia y Anaeróbica en Suelo.
OCDE, 2002b. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 308: Transformación Aerobia y Anaerobia en Sistemas de Sedimentos Acuáticos.
OCDE, 2004a. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 111: Hidrólisis en función del pH.
OCDE, 2004b. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 309: Mineralización aeróbica en aguas superficiales - Prueba de biodegradación de simulación
OCDE, 2006. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 311: Biodegradabilidad Anaerobia de Compuestos Orgánicos en Lodos Digeridos: por Medición de la Producción de Gas.
OCDE, 2008a. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 314: Pruebas de simulación para evaluar la biodegradabilidad de los productos químicos descargados en aguas residuales
OCDE, 2008b. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 316: Fototransformación de Químicos en Agua - Fotólisis Directa.
OCDE, 2014. Lineamientos de la OCDE para el Ensayo de Productos Químicos. Prueba No. 310: Biodegradabilidad Listo - CO 2 en recipientes sellados (Prueba de espacio de cabeza).
Van Leeuwen, C.J., Vermeire, T.G. (2007). Evaluación de riesgos de productos químicos: una introducción (2a ed.), Springer, ISBN 978-1-4020-6101-1
La OCDE ha publicado extensos protocolos que pueden ser utilizados para evaluar la degradabilidad de los químicos en el medio ambiente. ¿Qué formas de degradación abiótica (química) incluyen estas?
Las pruebas de biodegradación utilizadas para evaluar los efectos ambientales de los productos químicos a menudo miden la mineralización de los productos químicos, por ejemplo midiendo la cantidad de dióxido de carbono producido. Explique por qué se prefiere esto a medir la eliminación del químico original (biodegradación primaria).
La evaluación de la biodegradabilidad de los productos químicos a menudo sigue un sistema escalonado en el que primero se criban para determinar su fácil biodegradabilidad antes de someterse a pruebas más extensas para evaluar su biodegradabilidad inherente o biodegradación en compartimentos ambientales específicos mediante pruebas de simulación. Explique por qué se aplica este enfoque.


