4.3: Procedimiento, diagrama de flujo y hojas de datos para la separación y confirmación de cationes del grupo II
- Page ID
- 76287
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)\(\newcommand{\AA}{\unicode[.8,0]{x212B}}\)
|
Químico |
Peligro |
|---|---|
|
0.1M cloruro de amonio (\(\ce{NH4Cl}\)) |
Tóxico e irritante |
|
Nitrato de bismuto 0.1M en 0.3M\(\ce{HNO3}\) |
Tóxico, irritante y oxidante |
|
Cloruro de cadmio 0.1M en 0.3M\(\ce{HNO3}\) |
Sustancia cancerígena tóxica y sospechosa |
|
Nitrato de cobre (II) 0.1M en 0.3M\(\ce{HNO3}\) |
Tóxico, irritante y oxidante |
|
0.1M Cloruro de Estaño (IV) en 0.3M\(\ce{HNO3}\) |
Corrosivo e irritante |
- *Los peligros de amoniaco 6M, ácido clorhídrico 6M, ácido nítrico 6M, hidróxido de potasio 3M y tioacetamida 1M se enumeran en la tabla de reactivos comunes en el capítulo 2.
- Las soluciones o precipitados de iones de metales pesados usados se desechan en un contenedor de eliminación de desechos metálicos etiquetados, no drene estas soluciones por el desagüe o en la basura normal.
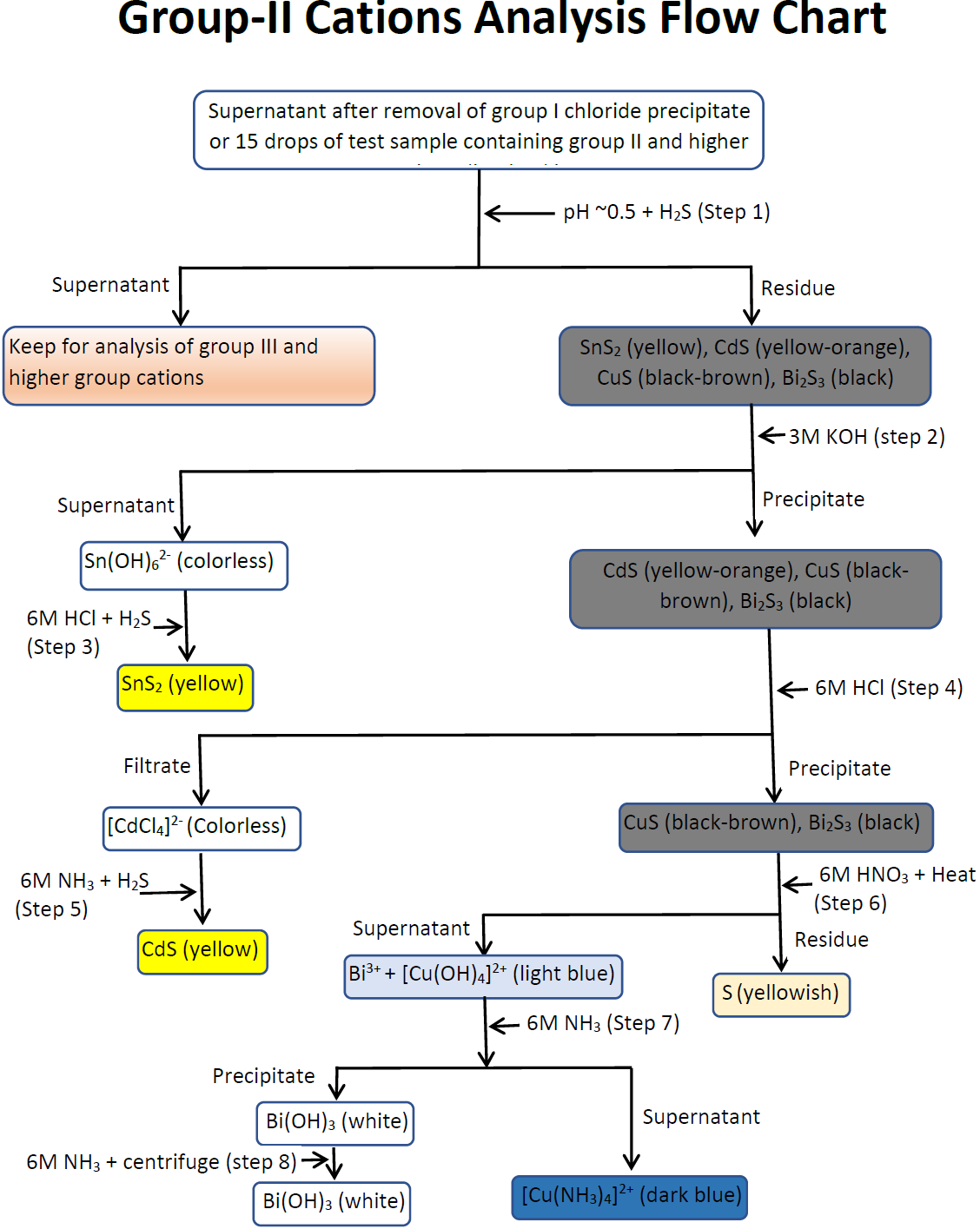
- Tomar 15 gotas de la solución de prueba si los cationes del grupo I no están presentes en la muestra o tomar el sobrenadante de la etapa 1 del análisis del grupo I. Encuentre su pH usando un papel de pH de corto alcance. Si el pH es 0.5 ±3 no hay necesidad de ajustar el pH. Si el pH es menor, aumentarlo a 0.5 ±3 agregando gotas de solución de amoníaco 0.5M, una gota a la vez mientras se agita. Si el pH es mayor, disminuya a 0.5 ±3 agregando gotas de 0.5M\(\ce{HCl}\), una gota a la vez mientras se agita. Después agregue 10 gotas de tioacetamida 1M revuelva y caliente durante 10 min en un baño de agua. Agregue 1 gota de 0.5M\(\ce{NH3}\), revuelva, centrifugue por 2 min y agregue 5 gotas de tioacetamida 1M, revuelva y caliente nuevamente por 2 min. Enfriar en baño de agua a temperatura ambiente y agregar 1 gota más de amoniaco 0.5M mientras se agita y centrifuga por 2 min. Decantar y conservar el sobrenadante para los cationes del grupo III y mantener el precipitado para la separación y análisis de los cationes del grupo II. El precipitado puede ser uno o más de los siguientes:\(\ce{SnS2}\) (amarillo),\(\ce{CdS}\) (amarillo-naranja),\(\ce{CuS}\) (negro-marrón),\(\ce{Bi2S3}\) (negro). Registrar la observación en la hoja de datos.
- Lavar el precipitado de la etapa 1 resuspendiéndolo en 1 mL (20 gotas) de 0.1M\(\ce{NH4Cl}\), centrifugar durante 2 min, decantar y desechar el sobrenadante que es solo el líquido de lavado. Vuelva a suspender el precipitado en 1 mL (20 gotas) de 3M\(\ce{KOH}\) + 1 gota de tioacetamida 1M, agitar, tapar sin apretar el tubo de ensayo y calentar en un baño de agua durante 2 min. Centrifugar la mezcla caliente por 2 min y decantar mientras está caliente. Conservar el sobrenadante para el análisis del\(\ce{Sn^{4+}}\) cual existe como\(\ce{Sn(OH)_{6}^{2-}}\) ión soluble en esta etapa y mantener el precipitado, si lo hay, para el análisis del resto de los cationes del grupo II. Registrar la observación en la hoja de datos.
- Agregar 6M\(\ce{HCl}\) gota a gota al sobrenadante de la etapa 2 y seguir probando con papel tornasol azul hasta que la mezcla se vuelva ácida. Luego agregue 5 gotas de tioacetamida 1M, revuelva y caliente en un baño de agua durante 2 min. El precipitado amarillo en esta etapa es el\(\ce{SnS2}\) que confirma que\(\ce{Sn^{4+}}\) está presente en la muestra de prueba, no\(\ce{Sn^{4+}}\) hubo medias de precipitado amarillo no presente. Registrar la observación en la hoja de datos y desechar la mezcla en un contenedor de residuos.
- Lavar el precipitado de la etapa 2 resuspendiéndolo en 10 gotas de agua destilada y luego centrifugar por 2 min. Decantar y desechar el sobrenadante y lavar nuevamente el precipitado por resuspensión en 10 gotas de agua destilada seguido de centrífuga por 2 min, decantar y desechar el sobrenadante. Vuelva a suspender el precipitado en 10 gotas de agua destilada + 2 gotas de 6M\(\ce{HCl}\) y calentar por 2 min. Centrifugar y decantar mientras la mezcla aún está caliente. Si el sobrenadante parece turbio debido a algún precipitado que queda en él, utilice la técnica de tapón de algodón para aspirar sobrenadante limpio y filtrar el precipitado residual. Conservar el sobrenadante para el análisis del\(\ce{Cd^{2+}}\) cual pueda existir como\(\ce{[CdCl4]^{2-}}\) ión disuelto en esta etapa y conservar el precipitado, si lo hay, para el análisis de los cationes restantes del grupo II. Registrar la observación en la hoja de datos.
- Agregue 6M\(\ce{NH3}\) gota a gota al sobrenadante transparente de la etapa 4 y continúe probando con papel tornasol rojo hasta que la solución se vuelva básica. Agregue 2 gotas de tioacetamida 1M, revuelva y caliente por 2 min en un baño de agua. Si se forma un precipitado amarillo en esta etapa es lo\(\ce{CdS}\) que confirma que\(\ce{Cd^{2+}}\) estuvo presente en la muestra de prueba, de lo contrario no\(\ce{Cd^{2+}}\) estuvo presente. Registre la observación en la hoja de datos y deseche la mezcla en un contenedor de desechos metálicos.
- Lavar el precipitado de la etapa 4, si lo hay, resuspendiéndolo en 10 gotas de agua destilada, centrifugar por 2 min, decantar y desechar el sobrenadante. Vuelva a suspender el precipitado en 10 gotas de HNO 3 6M y calentar en un baño de agua hirviendo durante 5 min. El precipitado, es decir,\(\ce{CuS}\) y/o\(\ce{Bi2S3}\) se disolverá en el líquido,\(\ce{Cu^{2+}}\) y/o se pueden formar iones\(\ce{Bi^{3+}}\) hidratados y partículas de azufre amarillas. Retirar las partículas de azufre por centrifugación y decantación y desecharlas ya que no hay iones en ellas. Conservar el sobrenadante para el análisis\(\ce{Cu^{2+}}\)\(\ce{Bi^{3+}}\) y registrar la observación en la hoja de datos.
- Añadir NH 3 6M gota a gota al sobrenadante de la etapa 6 y seguir probando con papel tornasol rojo hasta que la solución se vuelva alcalina. Agregue 10 gotas más de\(\ce{NH3}\) solución 6M después de que la solución se vuelva alcalina para hacerla fuertemente alcalina. Si la mezcla se vuelve de color azul en esta etapa, se debe al\(\ce{[Cu(NH3)4]^{2+}}\) ion azul que confirma que\(\ce{Cu^{2+}}\) está presente en la solución de prueba. Si hay una suspensión blanca en la mezcla, guárdala para probarla\(\ce{Bi^{3+}}\). Registrar la observación en la hoja de datos.
- Centrifugar la mezcla de la etapa 7 durante 2 min y decantar y desechar el sobrenadante. Si queda algún precipitado blanco después de la decantación, lo más probable es\(\ce{Bi(OH)3}\). Lavar el precipitado resuspendiéndolo en 10 gotas de 6M\(\ce{NH3}\), centrifugar por 2 min y decantar. Si el precipitado blanco permanece ahí después del lavado, es lo\(\ce{Bi(OH)3}\) que confirma que\(\ce{Bi^{3+}}\) está presente en la solución de ensayo, de lo contrario,\(\ce{Bi^{3+}}\) está ausente. Deseche la mezcla en un contenedor de desechos metálicos y registre la observación en la hoja de datos.
- El número de paso se refiere al número de paso correspondiente en la subsección de procedimiento.
- En “la columna de reacción química esperada y observaciones esperadas”, escribir una ecuación iónica neta global de la reacción que sucederá si el ion que se procesa en el paso estuvo presente, escribir el cambio de color esperado de la solución, el precipitado esperado formado y su color esperado, etc.
- En la columna “las observaciones reales y conclusión” escribe el cambio de color, el precipitado formado y su color, etc. que realmente se observa como evidencia, y declara el ión específico como presente o ausente.
- En la fila “la conclusión general” escribe uno por uno símbolo de los iones que se están probando con una declaración “presente” o “ausente” seguida de evidencia/s para apoyar tu conclusión.