1.1: La estructura de los cristales
- Page ID
- 77900
En el contexto de este capítulo, también se le invitará a visitar estas secciones...
- El estado cristalino
- Fuerzas interatómicas en cristales
- Notas históricas tempranas sobre cristales y cristalografía
Todos hemos oído hablar de minerales naturales y cristales. Los encontramos a diario sin entrar a un museo. Una roca y una montaña se componen de minerales, tan cristalinos como un terrón de azúcar, un poco de porcelana o un anillo de oro. Sin embargo, solo ocasionalmente es el tamaño de un cristal lo suficientemente grande como para llamar nuestra atención, como es el caso de estos hermosos ejemplos minerales de: Diamante (carbono puro) - Cuarzo (dióxido de silicio) - Escapolita (silicato de aluminio) - Pirita (sulfuro de hierro)

Varias de estas imágenes son propiedad de Amethyst Galleries, Inc.
Otras excelentes imágenes de minerales se pueden encontrar a través de este enlace.
Si bien puedes seguir leyendo estas páginas sin ninguna dificultad especial, probablemente te gustaría conocer algunos aspectos sobre el desarrollo histórico de nuestra comprensión de los cristales. Para estos lectores ofrecemos algunas notas adicionales que se pueden encontrar a través de este enlace.
Los antiguos griegos identificaban el cuarzo con la palabra cristal (κρσταλλος, crustallos, o fonéticamente kroos'-tal-los = cold + drop), es decir, carámbanos muy fríos de extraordinaria dureza. Pero la formación de cristales no es una propiedad única de los minerales; también se encuentran (pero no necesariamente de manera natural) en los llamados compuestos orgánicos, e incluso en ácidos nucleicos, en proteínas y en virus...
Un cristal es un material cuyos constituyentes, como átomos, moléculas o iones, están dispuestos en una estructura microscópica altamente ordenada. Estos constituyentes se mantienen unidos por fuerzas interatómicas (enlaces químicos) como enlaces metálicos, enlaces iónicos, enlaces covalentes, enlaces de van der Waals y otros.
El estado cristalino de la materia es el estado con el orden más alto, es decir, con correlaciones internas muy altas y en el mayor rango de distancia. Esto se refleja en sus propiedades: anisotrópicas y discontinuas. Los cristales suelen aparecer como no adulterados, homogéneos y con formas geométricas bien definidas (hábitos) cuando están bien formados. Sin embargo, como decimos en español, “el hábito no hace al monje” (la ropa no hace al hombre) y su morfología externa no es suficiente para evaluar la cristalinidad de un material.
La siguiente película muestra el proceso de crecimiento cristalino de la lisozima (una enzima muy estable) a partir de un medio acuoso. La duración del proceso real, que tarda unos segundos en tu pantalla, corresponde aproximadamente a 30 minutos.

La película original fue encontrada en una antigua página web ofrecida por George M. Sheldrik.
La figura de la izquierda muestra una representación de las caras de un cristal dado. Si tu navegador permite el Java Runtime, al hacer clic en la imagen se abrirá una nueva ventana y podrás convertir este objeto. Si no tiene esta aplicación, aún puede observar la rotación del modelo en modo continuo desde este enlace.
Otros pop-ups Java de caras y formas (hábitos) para cristales ideales se pueden obtener a través de este enlace.
Entonces, nos preguntamos, ¿qué tienen de único los cristales que los distingue de otros tipos de materiales? La llamada estructura cristalina microscópica se caracteriza por grupos de iones, átomos o moléculas dispuestos en términos de algún modelo de repetición periódica, y este concepto (periodicidad) es fácil de entender si miramos el dibujos en una alfombra, en un mosaico, o un desfile militar...

Motivos repetidos en una alfombra

Motivos repetidos en mosaico

Motivos repetidos en un desfile militar
Si miramos cuidadosamente estos dibujos, descubriremos que siempre hay una fracción de ellos que se repite. En los cristales, los átomos, iones o moléculas se empaquetan de tal manera que dan lugar a “motivos” (un conjunto o unidad dada) que se repiten cada 5 Angstrom, hasta los cientos de Angstrom (1 Angstrom = 10 -8 cm), y esta repetición, en tres dimensiones, se conoce como la celosía cristalina. El motivo o unidad que se repite, por desplazamientos ordenados en tres dimensiones, produce la red (todo el cristal) y la llamamos celda elemental o celda unitaria. El contenido de la unidad que se repite (átomos, moléculas, iones) también se puede dibujar como un punto (el punto reticular) que representa cada constituyente del motivo. Por ejemplo, cada soldado de la figura anterior podría ser un punto reticular.
Pero hay ocasiones en las que la repetición se rompe, o no es exacta, y esta característica es precisamente lo que distingue a un cristal del vidrio, o en general, de materiales llamados amorfos (desordenados o mal ordenados)...
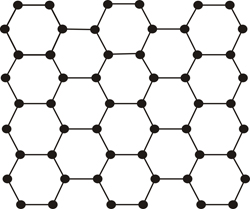
Modelo atómico plano de un material ordenado (cristal)
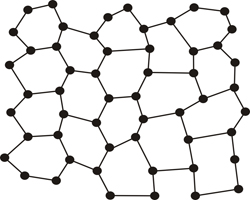
Modelo atómico plano de vidrio (un material amorfo)
Sin embargo, la materia no está completamente ordenada o desordenada (cristalina o no cristalina) y así podemos encontrar una degradación continua del orden (grado de cristalinidad) en los materiales, que va desde el perfectamente ordenado (cristalino ) a los completamente desordenados (amorfos). Esta pérdida gradual de orden que está presente en los materiales equivale a lo que vemos en los pequeños detalles de la siguiente fotografía de entrenamiento gimnástico, que está algo ordenada, pero hay algunas personas que llevan pantalones, otras con faldas, algunas en diferentes posiciones o ligeramente fuera de línea...

En la estructura cristalina (ordenada) de los materiales inorgánicos, las unidades repetitivas (o motivos) son átomos o iones, que están unidos entre sí de tal manera que normalmente no distinguimos unidades aisladas y de ahí su estabilidad y dureza (cristales iónicos, principalmente)...
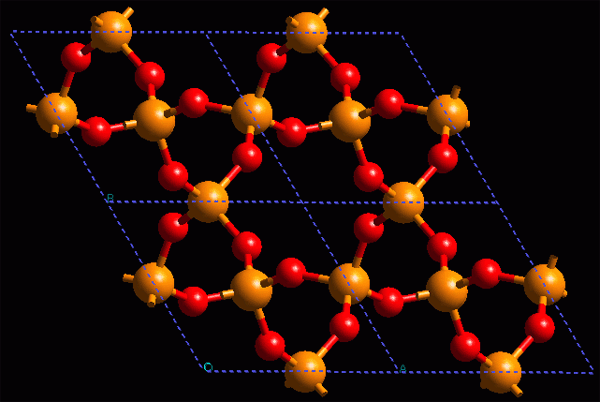
Estructura cristalina de un material inorgánico: α -cuarzo
Donde distinguimos claramente las unidades aisladas es en el caso de los llamados materiales orgánicos, donde aparece el concepto de la entidad aislada (molécula). Las moléculas están compuestas por átomos unidos entre sí. Sin embargo, los vínculos entre las moléculas dentro del cristal son muy débiles (cristales moleculares). Por lo tanto, generalmente son materiales más blandos e inestables que los inorgánicos.
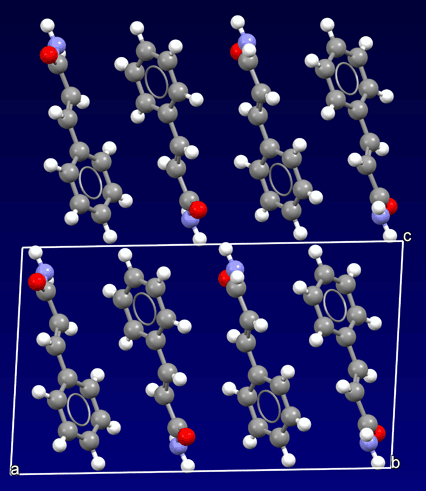
Estructura cristalina de un material orgánico: Cinnamamida
Los cristales proteicos también contienen unidades moleculares (moléculas), como en los materiales orgánicos, pero mucho más grandes. El tipo de fuerzas que unen estas moléculas también son similares, pero su empaquetamiento en los cristales deja muchos agujeros que se llenan de moléculas de agua (no necesariamente ordenadas) y de ahí su extrema inestabilidad...

Estructura cristalina de una proteína: AThal3.
El empaque molecular produce agujeros muy grandes
Los diferentes modos de empaquetamiento en los cristales conducen a las denominadas fases polimórficas (fases alotrópicas de los elementos) que confieren diferentes propiedades a estos cristales (a estos materiales). Por ejemplo, todos conocemos las diferentes apariencias y propiedades del elemento químico carbono, que está presente en la Naturaleza en dos formas cristalinas diferentes, el diamante y el grafito:


Derecha: Grafito (carbono puro)
El grafito es negro, suave y un excelente lubricante, lo que sugiere que sus átomos deben distribuirse (empaquetarse) de tal manera que se expliquen estas propiedades. No obstante, los diamantes son transparentes y muy duros, por lo que podemos esperar que sus átomos estén muy firmemente unidos. En efecto, sus estructuras submicroscópicas (a nivel atómico) nos muestran sus diferencias...
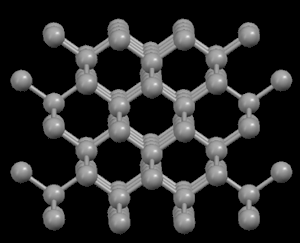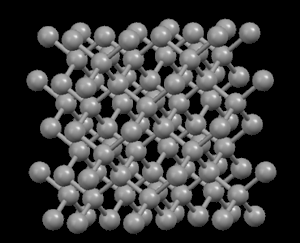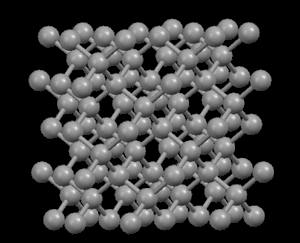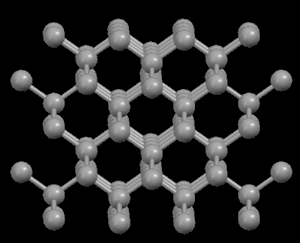
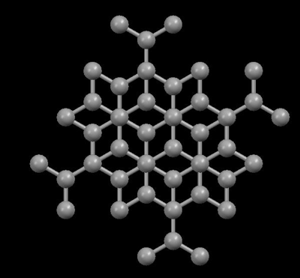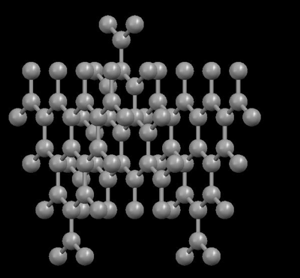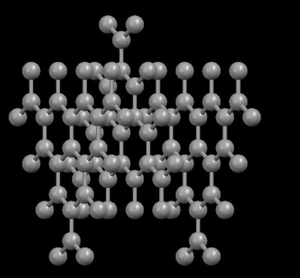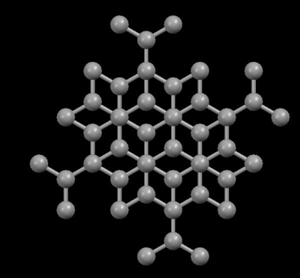
Derecha: Grafito, mostrando su estructura cristalina en capas
En la estructura de diamante, cada átomo de carbono está unido a otros cuatro en forma de una red tridimensional muy compacta (cristales covalentes), de ahí su extrema dureza y su propiedad como aislante eléctrico. Sin embargo, en la estructura del grafito, los átomos de carbono están dispuestos en capas paralelas mucho más separados que los átomos en una sola capa. Debido a estos débiles vínculos entre las capas atómicas de grafito, las capas pueden deslizarse, sin mucho esfuerzo, y de ahí la idoneidad del grafito como lubricante, su uso para plumas y como conductor eléctrico.
Y hablando de conductores... Los átomos metálicos en los cristales metálicos están estructurados de tal manera que algunos electrones deslocalizados dan cohesión a los cristales y son responsables de sus propiedades eléctricas.
Antes de terminar este capítulo vamos a introducir algunas palabras sobre los llamados cuasicristales...
Un cuasicristal es una estructura “ordenada”, pero no perfectamente periódica como lo son los cristales. Los patrones repetitivos (conjuntos de átomos, etc.) de los materiales cuasicristalinos pueden llenar todo el espacio disponible continuamente, pero no muestran una repetición exacta por traducción. Y, en lo que respecta a la simetría, mientras que los cristales (según las leyes de la cristalografía clásica) pueden mostrar ejes de rotación de orden 2, 3, 4 y 6 solamente, los cuasicristales muestran otros ejes de simetría rotacional, como por ejemplo del orden 10
En este sitio web no prestaremos atención al caso de los cuasicristales. Por lo tanto, si le interesa, por favor diríjase a este enlace, donde Steffen Weber, de una manera relativamente sencilla, describe este tipo de materiales desde el punto de vista teórico, y donde también se pueden encontrar algunas fuentes adicionales de información.. los lectores avanzados también deben consultar el sitio ofrecido por Paul J, Steinhardt en la Universidad de Princeton.
El Premio Nobel de Química 2011 fue otorgado a Daniel Shechtman por el descubrimiento de cuasicristales en 1984.
Obviamente hay muchas preguntas que el lector hará, habiendo llegado hasta aquí, y una de las más obvias es: ¿cómo conocemos la estructura de los cristales? Esta pregunta, y otras, serán respondidas en los siguientes capítulos y por ello te animamos a consultarlas...