4.6: Espectroscopia Mössbauer
- Page ID
- 71088
En 1957 Rudolf Mössbauer logró la primera observación experimental de la absorción resonante y emisión libre de retroceso de rayos γ nucleares en sólidos durante su trabajo de posgrado en el Instituto de Física del Instituto Max Planck de Investigación Médica en Heidelberg Alemania. Mössbauer recibió el Premio Nobel de Física 1961 por su investigación en la absorción resonante de la radiación γ y el descubrimiento de la emisión sin retroceso, fenómeno que lleva su nombre. El efecto Mössbauer es la base de la espectroscopia Mössbauer.
El efecto Mössbauer puede describirse de manera muy simple observando la energía involucrada en la absorción o emisión de un rayo γ desde un núcleo. Cuando un núcleo libre absorbe o emite un rayo γ para conservar el impulso, el núcleo debe retrocederse, por lo que en términos de energía:
\[ E_{ \gamma - ray} \ = \ E_{\text{nuclear transition}}\ -\ E_{\text{recoil}} \label{1} \]
Cuando en una matriz sólida la energía de retroceso va a cero porque la masa efectiva del núcleo es muy grande y el impulso puede conservarse con un movimiento insignificante del núcleo. Entonces, para núcleos en una matriz sólida:
\[ E_{\gamma - ray} \ =\ E_{\text{nuclear transition}} \label{2} \]
Este es el efecto Mössbauer que resulta en la absorción/emisión resonante de rayos γ y nos da un medio para sondear las interacciones hiperfinas de un núcleo de átomos y su entorno.
Un sistema de espectrómetro Mössbauer consiste en una fuente de rayos γ que es oscilada hacia y lejos de la muestra por un “Mössbauer drive”, un colimador para filtrar los rayos γ, la muestra y un detector.

La\(\PageIndex{2}\) figura muestra los dos conjuntos básicos para un espectrómetro Mössbauer. El impulso Mössbauer hace oscilar la fuente para que los rayos γ incidentes que golpean el absorbedor tengan un rango de energías debido al efecto Doppler. La escala de energía para los espectros de Mössbauer (eje x) es generalmente en términos de la velocidad de la fuente en mm/s. La fuente mostrada (57 Co) se utiliza para sondear 57 Fe en muestras que contienen hierro porque 57 Co decae a 57 Fe emitiendo un rayo γ de la energía correcta para ser absorbido por 57 Fe. Para analizar otros isótopos de Mössbauer se utilizan otras fuentes adecuadas. El Fe es el elemento más común examinado con espectroscopia de Mössbauer porque su isótopo 57 Fe es lo suficientemente abundante (2.2), tiene un rayo γ de baja energía y un estado nuclear excitado de larga vida que son los requisitos para el espectro observable de Mössbauer. Otros elementos que tienen isótopos con los parámetros requeridos para el sondeo de Mössbauer se ven en la Tabla\(\PageIndex{1}\).
| Elementos examinados con mayor frecuencia | Fe, Ru, W, Ir, Au, Sn, Sb, Te, I, W, Ir, Eu, Gd, Dy, Er, Yb, Np |
| Elementos que exhiben efecto Mössbauer | K, Ni, Zn, Ge, Kr, Tc, Ag, Xe, Cs, Ba, La, Hf, Ta, Re, Os, Pt, Hg, Ce, Pr, Nd, Sm, Tb, Ho, Tm, Lu, Th, Pa, U, Pu, Am |
Mössbauer Spectra
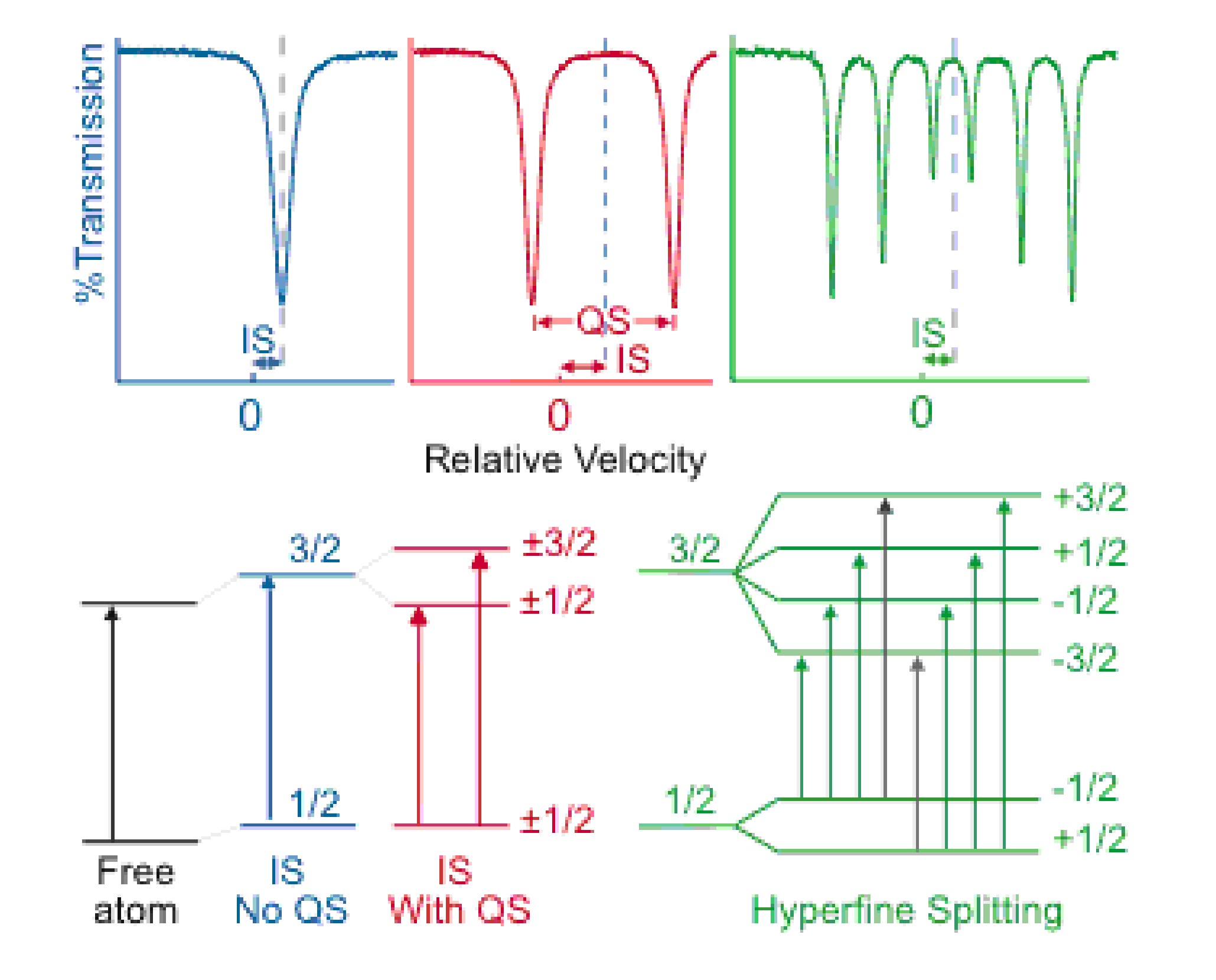
Las principales características observadas en los espectros de Mössbauer son el desplazamiento de isómeros (IS), la división cuadrupolar (QS) y la división magnética (EM o división hiperfina). Estas características son efectos causados por las interacciones del núcleo absorbente con su entorno.
El desplazamiento del isómero se debe a niveles de energía nuclear ligeramente diferentes en la fuente y el absorbedor debido a las diferencias en el entorno de electrones s de la fuente y el absorbedor El estado de oxidación de un núcleo absorbente es una característica que puede ser determinada por el IS de un espectro. Por ejemplo, debido al mayor cribado de electrones d, el Fe 2+ tiene menos densidad de electrones s que el Fe 3+ en su núcleo, lo que resulta en un mayor IS positivo para Fe 2+.
Para los absorbedores con número cuántico de momento angular nuclear I > ½, la distribución de carga no esférica da como resultado la división cuadripolar de los estados de energía. Por ejemplo, el Fe con una transición de I=1/2 a 3/2 exhibirá dobletes de picos individuales en los espectros de Mössbauer debido a la división cuadrupolar de los estados nucleares como se muestra en rojo en la Figura\(\PageIndex{2}\).
En presencia de un campo magnético la interacción entre los momentos de espín nuclear con el campo magnético elimina toda la degeneración de los niveles de energía dando como resultado la división de los niveles de energía con espín nuclear I en subniveles 2I + 1. Usando Fe para un ejemplo nuevamente, la división magnética dará como resultado un sexteto como se muestra en verde en la Figura\(\PageIndex{2}\). Observe que se muestran 8 posibles transiciones, pero solo ocurren 6. Debido a la regla de selección іδM I = 0, 1, las transiciones representadas como flechas negras no ocurren.
Síntesis de nanopartículas de magnetita
Se han ideado numerosos esquemas para sintetizar nanopartículas de magnetita (NMAg). Los diferentes métodos de síntesis de NMAg pueden agruparse generalmente como acuosos o no acuosos de acuerdo con los disolventes utilizados. Dos de los métodos más utilizados y explorados para la síntesis de NMAg son el método de coprecipitación acuosa y el método de descomposición térmica no acuosa.
El método de coprecipitación de la síntesis de NMAg consiste en la precipitación de Fe 3 O 4 (NMAg) mediante la adición de una base fuerte a una solución de sales de Fe 2+ y Fe 3+ en agua. Este método es muy sencillo, económico y produce NMAg altamente cristalino. El tamaño general de nMAg producido por coprecipitación está en el rango de 15 a 50 nm y puede ser controlado por las condiciones de reacción, sin embargo, se produce una distribución de tamaño grande de nanopartículas por este método. La agregación de partículas también se observa con métodos acuosos.
El método de descomposición térmica consiste en la descomposición térmica a alta temperatura de un complejo hierro-oleato derivado de un precursor de hierro en presencia de surfactante en un disolvente orgánico de alto punto de ebullición bajo una atmósfera inerte. Para las muchas variaciones de este método sintético se utilizan muchos disolventes y surfactantes diferentes. Sin embargo, en la mayoría de los métodos NMAg se forma a través de la descomposición térmica de un complejo hierro-oleato para formar NMAg altamente cristalino en el rango de 5 a 40 nm con una distribución de tamaño muy pequeña. El tamaño de NMAg producido es una función de la temperatura de reacción, la relación hierro a tensioactivo y el tiempo de reacción, y se utilizan diversos métodos que logran un buen control de tamaño mediante la manipulación de estos parámetros. El nMAg sintetizado por métodos orgánicos es soluble en solventes orgánicos debido a que el nMAg se estabiliza mediante un recubrimiento superficial de surfactante con el grupo de cabeza polar del surfactante unido y la cola hidrófoba extendiéndose lejos del nMAg (Figura\(\PageIndex{3}\)). Un ejemplo de un método de descomposición térmica se muestra en la Figura\(\PageIndex{3}\).

Mössbauer Análisis de Nanopartículas de Óxido de Hierro
Espectros y Cálculos de Fórmula
Debido a las aplicaciones potenciales de las nanopartículas de magnetita (Fe 3 O 4, NMAg) se han ideado muchos métodos para su síntesis. Sin embargo, el Fe 3 O 4 estequiométrico no siempre se logra mediante diferentes métodos sintéticos. Las vacantes de sitio B introducidas en la estructura cristalina de espinela inversa cúbica de NMAg dan como resultado óxido de hierro no estequiométrico de fórmula (Fe 3+) A (Fe (1-3x) 2+ Fe (1+2X) 3+ Ø x) B O 4 donde Ø representa una vacante en el sitio B. La susceptibilidad magnética que es clave para la mayoría de las aplicaciones de NMAg disminuye con el aumento de la vacante en el sitio B, por lo que la extensión de la vacante La muy alta sensibilidad del espectro de Mössbauer al estado de oxidación y ocupación del sitio de Fe 3+ en óxidos de hierro de espinela inversa cúbica hace que la espectroscopia Mössbauer sea valiosa para abordar los problemas de si el producto de un método sintético es en realidad NMAg y la extensión del sitio B vacante.
Como con la mayoría de los análisis, el uso de múltiples métodos instrumentales en conjunto suele ser útil Esto se ejemplifica por el uso de XRD junto con la espectroscopia Mössbauer en el siguiente análisis. La figura\(\PageIndex{4}\) muestra los resultados de XRD y muestras de espectros de Mössbauer “magnetita” preparadas por una coprecipitación de Fe 2+ /Fe 3+ (Mt025), reducción de hematites por hidrógeno (MTh2) y reducción de hematites con carbón (MTc). El análisis XRD muestra MTh2 y MT025 mostrando solo picos de magnetita, mientras que MtC muestra la presencia de magnetita, maghemita y hematita. Esta información se vuelve muy útil cuando se ajustan picos a los espectros de Mössbauer porque proporciona una base química para los parámetros de ajuste de picos y ayuda a ajustar los picos correctamente.

Siendo que el hierro ocupa dos ambientes locales, el sitio A y el sitio B, y dos especies (Fe 2+ y Fe 3+) ocupan el sitio B se podría esperar que el espectro sea una combinación de 3 espectros, sin embargo deslocalización de electrones o salto de electrones entre Fe 2+ y Fe 3+ en el sitio B hace que los núcleos detecten una valencia promedio en el sitio B, por lo que el espectro se ajusta con dos curvas en consecuencia. Esto se ve más fácilmente en el espectro Mt025. Las dos curvas ajustadas corresponden a Fe 3+ en el sitio A y cenefa mixta Fe 2.5+ en el sitio B. El desplazamiento de isómero de las curvas ajustadas se puede utilizar para determinar qué curva corresponde a qué valencia. El desplazamiento del isómero en relación con la curva ajustada superior es 0.661 y la curva ajustada inferior es 0.274 en relación con αFe, por lo que la curva ajustada superior corresponde a Fe 2.5+ menos denso de electrones s. La división magnética es bastante evidente. En cada uno de los espectros están presentes seis picos debido a la división magnética de los estados de energía nuclear como se explicó anteriormente. La división cuadrupolar no es tan aparente, sino que en realidad está presente en los espectros. Los tres picos a la izquierda del centro de un espectro deben estar espaciados igual que los de la derecha debido a la división magnética sola ya que el espaciamiento del nivel de energía entre los subniveles es igual. Este no es el caso en los espectros anteriores, porque los subniveles de mayor energía I = 3/2 se dividen de manera desigual debido a las interacciones de división magnética y cuadrupolo.
Una vez que los picos se han ajustado adecuadamente, la determinación de la extensión de la vacante del sitio B en (Fe 3+) A (Fe (1-3x) 2+ Fe (1+2X) 3+ Ø x) B O 4 es una cuestión relativamente simple. Todo lo que uno tiene que debido para determinar el número de vacantes (x) es resolver la ecuación:
\[ \frac{RA_{B}}{RA_{A}} = \frac{2-6x}{1-5x} \label{3} \]
donde RA B o A = área relativa
\[ \frac{Area\ A\ or\ B\ site\ curve}{Area\ of\ both\ curves} \label{4} \]
de la curva para el sitio B o A respectivamente
El razonamiento para esta ecuación es el siguiente. Teniendo en cuenta que la curva de cenefa mixta Fe 2.5+ es resultado de la interacción pareada entre Fe 2+ y Fe 3+, la fórmula química no estequiométrica es (Fe 3+) A (Fe (1-3x) 2+ Fe (1+2X) 3+ Ø x) B O 4. La intensidad relativa (o área relativa) de las curvas Fe-A y Fe-B es muy sensible a la estequiometría porque las vacantes en el sitio B reducen la curva de Fe-A y aumentan las intensidades de la curva Fe-B. Esto se debe a que el Fe 5x 3+ no apareado se suma a la intensidad de la curva de Fe-A en lugar de a la curva de Fe-B. Dado que el área relativa es directamente proporcional al número de Fe que contribuye al espectro, la relación de las áreas relativas es igual a la relación estequiométrica de Fe 2.5+ a Fe 3+, lo que produce la fórmula anterior.
Ejemplo de cálculo:
Para MTh2 RA A /RA B = 1.89
Conectando x en los yeilds de fórmula de óxido de hierro no estequiométricos:
\[ \frac{RA_{B}}{RA_{A}} = \frac{2-6x}{1-5x} \label{5} \]
resolviendo para x rendimientos
\[ x=\frac{2-\frac{RA_{A}}{RA_{B}}}{5 \frac{RA_{A}}{RA_{B}}\ +\ 6} \label{6} \]
(Fe 3+) A (Fe 1.9572 2+ Fe 0.0356 3+) B O 4 (muy cerca de la estequiometría)
| Muestra | RA B/RA A | X | Fórmula química |
|---|---|---|---|
| MTh 2 | 1.89 | 0.007 | (Fe 3+) A (Fe 0.979 2+ Fe 1.014 3+) B O 4 |
| MTc | 1.66 | 0.024 | (Fe 3+) A (Fe 0.929 2+ Fe 1.048 3+) B O 4 |
| Mt 025 | 1.60 | 0.029 | (Fe 3+) A (Fe 0.914 2+ Fe 1.057 3+) B O 4 |
Fórmulas químicas de nanopartículas de óxido de hierro no estequiométricas de espectroscopia Mössbauer
Determinación de la Fórmula Química
Las nanopartículas de magnetita (Fe 3 O 4) (N-mag) son de tamaño nanométrico, superparamagnéticas, tienen magnetización de alta saturación, alta susceptibilidad magnética y baja toxicidad. Estas propiedades podrían ser utilizadas para muchas aplicaciones posibles; por lo tanto, N-mag ha atraído mucha atención en la comunidad científica. Algunas de las aplicaciones potenciales incluyen administración de fármacos, agentes de hipertermia, agentes de contraste de MRI, marcaje celular y separación celular, por nombrar algunas.
La estructura cristalina de N-mag es espinela inversa cúbica con cationes Fe 3+ ocupando los sitios tetraédricos intersticiales (A) y Fe 3+ junto con Fe 2+ ocupando los sitios octaédricos intersticiales (B) de un FCC enrejado de O 2-. Incluyendo la ocupación del sitio y carga de Fe, la fórmula química N-mag puede escribirse (Fe 3+) A (Fe 2+ Fe 3+) B O 4. El óxido de hierro no estequiométrico resulta de las vacantes del sitio B en la estructura cristalina. Para mantener la carga equilibrada y tener en cuenta el grado de vacantes de sitio B se escribe la fórmula de óxido de hierro (Fe 3+) A (Fe (1-3x) 2+ Fe (1+2X) 3+ Ø x) B O 4 donde Ø representa sitio B vacante. La extensión de la vacante del sitio B tiene un efecto significativo en las propiedades magnéticas del óxido de hierro y en la síntesis del óxido de hierro estequiométrico N-mag no está garantizado; por lo tanto, la vacante del sitio B merece atención en la caracterización del óxido de hierro y puede abordarse mediante espectroscopia Mössbauer.


