18: Cooperatividad
- Page ID
- 69572
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)A menudo se observa en biología molecular que estructuras a nanoescala con arquitecturas sofisticadas se ensamblan espontáneamente, sin la entrada de energía externa. Por lo tanto, el comportamiento se rige por principios físicos que podemos describir con termodinámica y mecánica estadística. Los ejemplos incluyen:
- Plegamiento de proteínas y ARN
- Hibridación de ADN
- Ensamblaje de complejos proteicos y cápsidas virales
- Formación de micelas y vesículas
Aunque cada uno de estos procesos tiene características distintas, pueden describirse ampliamente como procesos de autoensamblaje.
Una característica del autoensamblaje es que aparece termodinámica y cinéticamente como una simple “transición de dos estados”, aunque estén involucrados miles de grados atómicos de libertad. Es decir, a medida que se cambian variables de control termodinámicas como la temperatura, se observa experimentalmente un estado ensamblado y un estado desmontado, pero raramente un estado intermedio, parcialmente ensamblado. Además, pequeños cambios en estas variables termodinámicas pueden conducir a cambios dramáticos, es decir, fusión del ADN o proteínas en algunos grados. Este comportamiento binario o similar a un cambio es muy diferente de las curvas de despliegue suavemente variables que derivamos para modelos de celosía simples de polímeros.
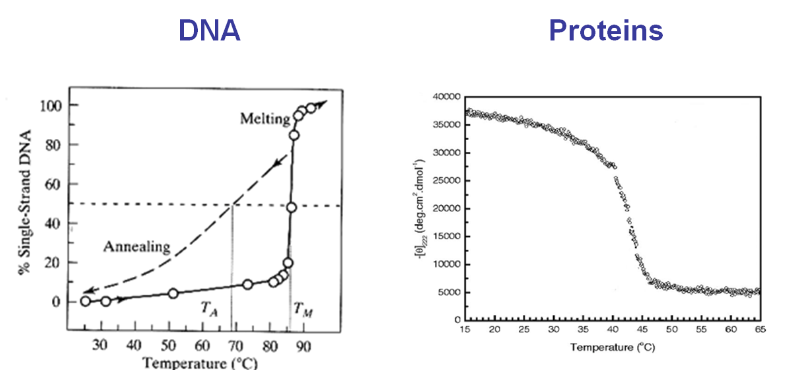
Las transiciones de fase y los equilibrios de fase son fenómenos relacionados descritos por la presencia (o coexistencia) de dos estados. Estos se manifiestan como un gran cambio en las propiedades macroscópicas del sistema con solo pequeños cambios en la temperatura u otras variables termodinámicas. Calentar el agua líquida de 99 °C a 101 °C tiene un profundo efecto sobre la densidad, lo que no tendría un cambio de 2° a 25 °C.
Tal transición de fase de “primer orden” surge de una discontinuidad en la energía libre en función de una variable termodinámica intensiva. 1 La descripción termodinámica del comportamiento de dos estados que gobierna una transición de fase se ilustra a continuación para el equilibrio entre las fases A y B. El perfil de energía libre se traza como una función de un parámetro de orden, una variable que distingue las características físicas relevantes para el cambio de fase. Por ejemplo, para una transición en fase líquido-gas, el volumen o la densidad son parámetros de orden que cambian drásticamente. A medida que aumenta la temperatura la energía libre de cada estado, caracterizada por su mínimo de energía libre (G i), disminuye suave y continuamente. Sin embargo, el estado B disminuye más rápidamente que el estado A. Mientras que el estado A es el mínimo global de energía libre a bajas temperaturas, el estado B está a alta temperatura. Las fases se encuentran en equilibrio entre sí a la temperatura donde G A = G B.
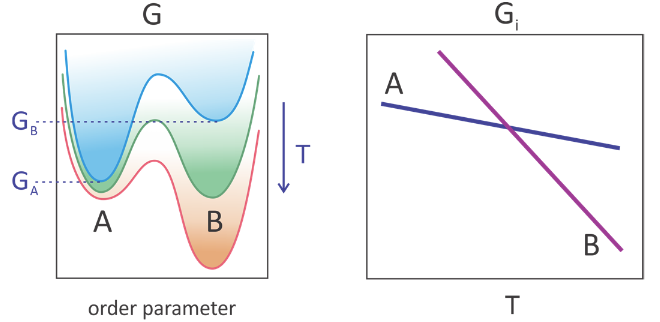
La presencia de una transición de fase depende de que todas las moléculas del sistema cambien de estado juntas, o cooperativamente. En una transición de fase de primer orden, este cambio es infinitamente agudo o discontinuo, pero la transición hélice-bobina y los fenómenos cooperativos relacionados pueden ser continuos. La cooperatividad es un término que puede referirse tanto a fenómenos macroscópicos como a una escala molecular. Lo usamos para referirnos a muchos grados de libertad cambiando de manera concertada. El tamaño o número de partículas o moléculas que participan en un proceso cooperativo es la unidad cooperativa. En el caso de una transición en fase líquido-gas, la unidad cooperativa es la muestra macroscópica, mientras que para el plegamiento de proteínas puede involucrar a la mayor parte de la molécula.
¿Qué subyace a la cooperatividad? Encontramos que la energía libre del sistema no es simplemente aditiva en las partes. La energía de un estado configuracional particular depende de la configuración de sus vecinos. Por ejemplo, la presencia de un contacto o interacción molecular aumenta o disminuye la propensión a un segundo contacto o interacción. Nos referimos a esto como cooperatividad positiva o negativa. Más allá del autoensamblaje, la cooperatividad juega un papel en la unión de múltiples ligandos y alosterías. Aquí queremos discutir los conceptos básicos relevantes para la cooperatividad y su relación con el comportamiento de dos estados.
A partir de observaciones que hemos realizado anteriormente en otros contextos, podemos esperar que el comportamiento cooperativo implique efectos termodinámicos competitivos. La estructura se forma a expensas de una gran pérdida de entropía, pero los numerosos contactos favorables que se forman bajan aún más la entalpía. El cambio de energía libre puede ser pequeño, pero esto resulta de dos efectos opuestos de gran magnitud y signo opuesto (H vs TS). Un pequeño retoque en la temperatura puede cambiar completamente el sistema.
________________________________________________
1. Una transición de primer orden se describe como una discontinuidad en G/S o G/V. Una transición de segundo orden es aquella en la que dos fases se funden en una en un punto crítico y se describe por una discontinuidad en la capacidad calorífica o expansibilidad/compresibilidad del sistema (S/T, S/P, V/T o V/P).

