7.1: Introducción a la Rotación
- Page ID
- 71238
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
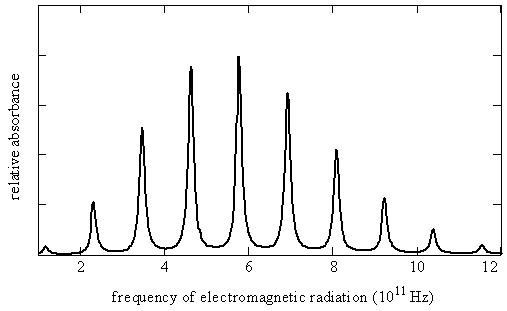
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Las moléculas giran así como vibran. Las transiciones entre los niveles de energía rotacional en las moléculas generalmente se encuentran en las regiones de infrarrojo lejano y microondas del espectro electromagnético. Un espectro rotacional de una molécula diatómica simple se ilustra en la Figura\(\PageIndex{1}\) y la información cuantitativa sobre este espectro se da en la Tabla\(\PageIndex{2}\) cercana al final de este capítulo. Observe que las líneas están casi equidistantes y varían en intensidad. En este capítulo, veremos que la magnitud del momento de inercia de la molécula hace que las transiciones rotacionales se encuentren en estas regiones espectrales. También aprenderemos por qué las líneas están casi igualmente espaciadas y varían en intensidad. Dichos espectros se pueden usar para determinar longitudes de enlace, e incluso ángulos de enlace en moléculas poliatómicas.
Para desarrollar una descripción de los estados rotacionales, consideraremos que la molécula es un objeto rígido, es decir, las longitudes del enlace son fijas y la molécula no puede vibrar. Este modelo para rotación se llama modelo de rotor rígido. Es una buena aproximación (aunque una molécula vibra a medida que gira, y los enlaces son elásticos en lugar de rígidos) porque la amplitud de la vibración es pequeña en comparación con la longitud del enlace.
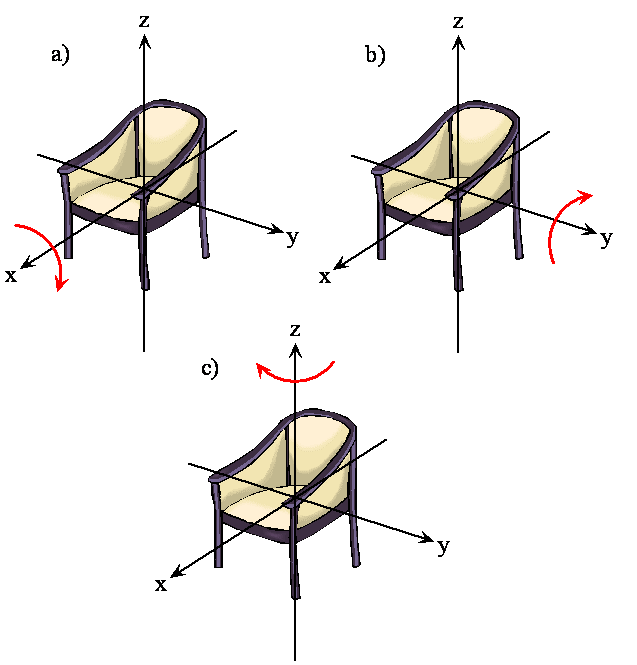
La rotación de un objeto rígido en el espacio es muy simple de visualizar. Recoge cualquier objeto y gírelo. Hay rotaciones ortogonales alrededor de cada uno de los tres ejes de coordenadas cartesianas así como hay traducciones ortogonales en cada una de las direcciones en el espacio tridimensional; ver Figuras\(\PageIndex{2}\) y\(\PageIndex{3}\). Se dice que las rotaciones son ortogonales porque no se puede describir una rotación alrededor de un eje en términos de rotaciones alrededor de los otros ejes así como no se puede describir una traslación a lo largo del eje x en términos de traslaciones a lo largo de los ejes y y z. Para una molécula lineal, el movimiento alrededor del eje interatómico (eje x) no es una rotación.
En este capítulo consideramos el caso de una molécula diatómica. Resolver la ecuación de Schrödinger para el movimiento rotacional nos dará las energías rotacionales y los momentos angulares, las funciones de onda asociadas con estos niveles de energía y momentos angulares, y los números cuánticos que sirven para etiquetar los niveles de energía, momentos angulares y funciones de onda. Los números cuánticos aparecen debido a las condiciones límite impuestas a las funciones de onda.
Encontraremos que se cuantifica la energía de rotación. Esta cuantificación y las reglas de selección para transiciones espectroscópicas entre los diversos niveles de energía conducen a las líneas de absorción vistas en el espectro rotacional en la Figura\(\PageIndex{1}\). El momento angular también se cuantifica, lo que significa que solo son posibles ciertos valores del momento angular, y, cuando alguna dirección está definida de manera única por un campo eléctrico o magnético, solo son posibles ciertas orientaciones de la molécula giratoria en el espacio. Esta restricción en la orientación se llama cuantificación de espacio.
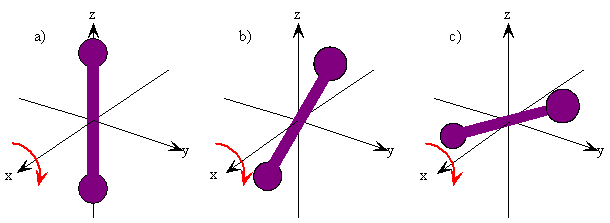
Como puede ver en Figura\(\PageIndex{4}\) y Ejercicio\(\PageIndex{1}\), el vector de momento angular para un sistema giratorio clásico es perpendicular al plano de rotación. La dirección del vector se da aplicando la regla de la derecha a la dirección de rotación. Por lo tanto, la orientación de una molécula diatómica giratoria clásica se define por el plano en el que se encuentra el eje internuclear durante la rotación o por la dirección del vector de momento angular, que es perpendicular a este plano. La dirección del vector de momento angular se llama eje de rotación. Los vectores de momento angular son útiles porque proporcionan una forma taquigráfica de representar el movimiento clásico de una molécula diatómica giratoria. Dado solo un vector de momento angular, es posible reconstruir la dirección y el plano de rotación además de la magnitud del momento angular, que a su vez es una función de la masa reducida, la longitud del enlace y la velocidad angular de la molécula giratoria.
El material de este capítulo es muy importante porque las funciones de onda obtenidas al resolver la ecuación de Schrödinger para el movimiento rotacional también se utilizarán para describir el átomo de hidrógeno en el siguiente capítulo. Las funciones de onda de los átomos de hidrógeno, a su vez, son la clave para comprender la estructura atómica y molecular y la reactividad química.

Ejercicio\(\PageIndex{1}\)
Para visualizar estas diferentes orientaciones y el eje de rotación, usa tu lápiz para representar el eje internuclear de una molécula diatómica, gírela en diferentes planos y alinea otro lápiz a lo largo del eje de rotación en cada caso.


