1.2: Algunos experimentos importantes con electrones y luz
- Page ID
- 69390
Ciertamente, los primeros experimentos sobre las propiedades de los electrones no sugirieron que se esperara ningún comportamiento inusual. Todo apuntaba a que el electrón era una partícula de masa muy pequeña. La trayectoria del electrón se puede seguir en un dispositivo como una cámara de nubes Wilson. De igual manera, un haz de electrones generado al pasar una corriente entre dos electrodos en un tubo de vidrio del que se ha evacuado parcialmente el aire proyectará la sombra de un obstáculo colocado en la trayectoria del haz. Finalmente, la naturaleza de partículas del electrón se evidenció aún más por la determinación de su masa y carga.
Así como las consideraciones clásicas colocaron los electrones en el reino de las partículas, las mismas consideraciones clásicas colocaron la luz en el reino de las ondas con igual certeza. ¿Cómo se pueden explicar los efectos de difracción sin invocar el movimiento de onda?
En los años de 1905 a 1928 se realizaron una serie de experimentos que podrían ser interpretados por la mecánica clásica solo si se suponía que los electrones poseían un movimiento de onda, ¡y la luz estaba compuesta por una corriente de partículas! Tales descripciones dualistas, que atribuyen características tanto de onda como de partícula a electrones o luz, son imposibles en un sentido físico. El electrón debe comportarse ya sea como una partícula o como una onda, pero no ambas (asumiendo que lo es). “Partícula” y “onda” son conceptos utilizados por la mecánica ordinaria o clásica y vemos la paradoja que resulta cuando se utilizan conceptos clásicos en un intento de describir eventos a escala atómica. Consideraremos solo algunos de los experimentos importantes que dieron lugar a la explicación clásica del comportamiento dual para la descripción de electrones y luz, descripción que en última instancia debe abandonarse.
El efecto fotoeléctrico
Ciertos metales emiten electrones cuando se exponen a una fuente de luz. A esto se le llama el efecto fotoeléctrico. Los resultados pertinentes de este experimento son:
- El número de electrones liberados de la superficie aumenta a medida que aumenta la intensidad de la luz, pero las energías de los electrones emitidos son independientes de la intensidad de la luz.
- No se emiten electrones desde la superficie del metal a menos que la frecuencia de la luz sea mayor que un cierto valor mínimo. Cuando los electrones son expulsados de la superficie, exhiben un rango de velocidades, desde cero hasta algún valor máximo. Se encuentra que la energía de los electrones con la velocidad máxima aumenta linealmente con un incremento en la frecuencia de la luz incidente.
El primer resultado muestra que la luz no puede ser un movimiento de onda en el sentido clásico. Como analogía, considera olas de agua golpeando una playa y golpeando una pelota (en lugar de un electrón) en la orilla del agua. La intensidad de una onda es proporcional al cuadrado de la amplitud (o altura) de la onda. Ciertamente, incluso cuando la frecuencia con la que las olas golpean la playa se mantenga constante, un incremento en la amplitud de las olas provocará que se libere mucha más energía cuando golpeen la playa y golpeen la pelota. Sin embargo, cuando las “ondas” de luz golpean una sustancia solo el número de electrones emitidos aumenta a medida que aumenta la intensidad; la energía de los electrones más energéticos permanece constante. Esto puede explicarse sólo si se asume que la energía en un haz de luz no se transmite de la manera característica de una onda, sino que la energía viene en haces o paquetes y que el tamaño del paquete está determinado por la frecuencia de la luz. Esta explicación planteada por Einstein en 1905 relaciona la energía con la frecuencia -y no con la intensidad de la luz- como lo requieren los resultados experimentales. Un paquete de energía luminosa se llama fotón. Los resultados del experimento fotoeléctrico muestran que la energía e de un fotón es directamente proporcional a la frecuencia n de la luz, o, llamando a la constante de proporcionalidad h, tenemos:
\[\varepsilon = hv \label{1} \]
Dado que el electrón está unido a la superficie del metal, el fotón debe poseer una cierta cantidad mínima de energía, es decir, poseer una cierta frecuencia mínima n o, apenas suficiente para liberar el electrón del metal. Cuando un electrón es expulsado de la superficie por un fotón con una frecuencia mayor a este valor mínimo, la energía del fotón en exceso de la cantidad mínima aparece como energía cinética del electrón. Así:
\[kinetic\ energy\ of \ electron = hv - hv_{0} \label{2}\]
donde h n es la energía del fotón con frecuencia n, y h n o es la energía del fotón que es justo suficiente para liberar el electrón del metal. Experimentalmente podemos medir la energía cinética de los electrones en función de la frecuencia n. Una gráfica de la energía cinética versus la frecuencia da una línea recta cuya pendiente es igual al valor de h, la constante de proporcionalidad. El valor de h se encuentra que es 6.6 '10 -27 erg seg.
La ecuación\ ref {1} es revolucionaria. Afirma que la energía de una frecuencia de luz dada no puede variarse continuamente, (Haga clic aquí para obtener nota.) como sería el caso clásicamente, sino más bien que es fijo y viene en paquetes de un tamaño discreto. Se dice que la energía de la luz está cuantificada y un fotón es un cuántico (o haz) de energía.
Es tentador en este punto, si deseamos una imagen clásica de lo que está sucediendo, considerar cada haz de energía luminosa, es decir, cada fotón, como una partícula real. Entonces un fotón, al golpear un electrón individual, dispersa el electrón de la superficie del metal. La energía originalmente en el fotón se convierte en la energía cinética del electrón (menos la energía requerida para que el electrón escape de la superficie). Esta imagen no debe tomarse literalmente, pues entonces la difracción de la luz es inexplicable. Tampoco, sin embargo, la imagen de onda para difracción puede tomarse literalmente, pues entonces el efecto fotoeléctrico queda sin explicación. En otras palabras, la luz se comporta de una manera diferente a las partículas y ondas ordinarias y requiere una descripción especial.
La constante h determina el tamaño del cuántico de luz. Se denomina la constante de Planck en honor al hombre que primero postuló que la energía no es una cantidad continuamente variable, sino que ocurre sólo en paquetes de un tamaño discreto. Planck propuso este postulado en 1901 como resultado de un estudio de la manera en que se distribuye la energía en función de la frecuencia de la luz emitida por un cuerpo incandescente. Planck se vio obligado a asumir que las energías de las oscilaciones de los electrones en la materia incandescente, que son responsables de la emisión de la luz, fueron cuantificadas. Sólo de esta manera podría proporcionar una explicación teórica de los resultados experimentales. Hubo una gran renuencia por parte de los científicos en ese momento a creer que el postulado revolucionario de Planck era algo más que un dispositivo matemático, o que representaba un resultado de aplicabilidad general en la física atómica. El descubrimiento de Einstein de que la hipótesis de Planck proporcionaba una explicación del efecto fotoeléctrico, indicó que la cuantificación de la energía era de hecho un concepto de gran importancia física. Pronto se acercaron más ejemplos de la cuantificación de la energía, algunos de los cuales se discuten a continuación.
La difracción de electrones
Así como hemos encontrado propiedades dualistas para la luz cuando sus propiedades son consideradas en términos de mecánica clásica, así encontramos el mismo dualismo para los electrones. De los primeros experimentos sobre electrones se concluyó que eran partículas. Sin embargo, un haz de electrones, al pasar a través de una rejilla adecuada, da un patrón de difracción completamente análogo al obtenido en experimentos de difracción con luz. En otras palabras, no sólo los electrones y la luz parecen comportarse de maneras completamente diferentes y extrañas cuando se consideran en términos de nuestra física cotidiana, ¡ambos parecen comportarse de la misma manera! En realidad, se puede observar el mismo comportamiento extraño para protones y neutrones. Todas las partículas fundamentales y la luz presentan un comportamiento que conduce a conclusiones contradictorias cuando se utiliza la mecánica clásica para interpretar los hallazgos experimentales.
El experimento de difracción con electrones se realizó a sugerencia de Broglie. En 1923 de Broglie razonó que debía existir una relación entre las propiedades de “partícula” y “onda” para la luz. Si la luz es una corriente de partículas, deben poseer ímpetu. Aplicó a la energía del fotón la ecuación de Einstein para la equivalencia entre masa y energía:
\[\varepsilon = mc^2\]
donde c es la velocidad de la luz y m es la masa del fotón. Así el impulso del fotón es mc y:
\[\varepsilon = momentum \times c\]
Si la luz es un movimiento de onda, entonces, por supuesto, posee una frecuencia característica n y longitud de onda l que están relacionadas por la ecuación:
\[v = \frac{c}{\lambda }\]
La frecuencia y la longitud de onda pueden estar relacionadas con la energía del fotón usando la famosa relación de Einstein:
\[\varepsilon = hv = \frac{hc}{\lambda }\]
Al igualar las dos expresiones para la energía:
\[\frac{hc}{\lambda } = momentum \times c\]
de Broglie obtuvo la siguiente relación que lleva su nombre:
\[ \lambda = \frac{h}{momentum} \label{3}\]
No obstante, de Broglie no se detuvo aquí. Fue él quien razonó que la luz y los electrones podrían comportarse de la misma manera. Así, un haz de electrones, cada uno de masa m y con una velocidad u (y por lo tanto un impulso m u) debe exhibir efectos de difracción con una longitud de onda aparente:
\[ \lambda = \frac{h}{mv}\]
Usando la relación de Broglie, podemos calcular que un electrón con una velocidad de 1 '10 9 cm/s debe tener una longitud de onda de aproximadamente 1 x 10 -8 cm. Esto es solo el orden de magnitud de los espaciamientos entre átomos en una red cristalina. Así, un cristal puede ser utilizado como rejilla de difracción para electrones. En 1927 Davisson y Germer llevaron a cabo este mismo experimento y verificaron la predicción de Broglie. (Ver Problema 1 al final de esta sección.)
Espectros de Línea
Un gas emitirá luz cuando se pase una descarga eléctrica a través de él. La luz se puede producir aplicando un voltaje grande a través de un tubo de vidrio que contiene un gas a baja presión y equipado con electrodos en cada extremo. Un letrero de neón es un ejemplo de tal “tubo de descarga”. Los electrones que fluyen a través del tubo transfieren parte de su energía a los electrones de los átomos gaseosos. Cuando los electrones atómicos pierden esta energía extra y vuelven a su estado normal en el átomo el exceso de energía se emite en forma de luz. Así, los átomos gaseosos sirven para transformar la energía eléctrica en energía de la luz. La característica desconcertante de la luz emitida es que cuando se pasa a través de una rejilla de difracción (o un prisma) para separar la luz según su longitud de onda, solo aparecen ciertas longitudes de onda en el espectro. Cada longitud de onda aparece en el espectro como una sola línea estrecha de luz coloreada, la línea resultante del hecho de que la luz emitida pasa a través de una hendidura estrecha (produciendo así una delgada “línea” de luz) antes de golpear la rejilla o el prisma y ser difractada. Por lo tanto, se obtiene un espectro de “línea” en lugar de un espectro continuo cuando los electrones atómicos son excitados por una descarga eléctrica.
Un ejemplo de tal espectro se da en la Fig. 1-1, que ilustra el espectro visible observado para el átomo de hidrógeno. Este espectro debe contrastarse con el espectro continuo más habitual obtenido de una fuente de luz blanca que consiste en una banda continua de colores que van desde el rojo en el extremo de longitud de onda larga hasta el violeta en longitudes de onda cortas.
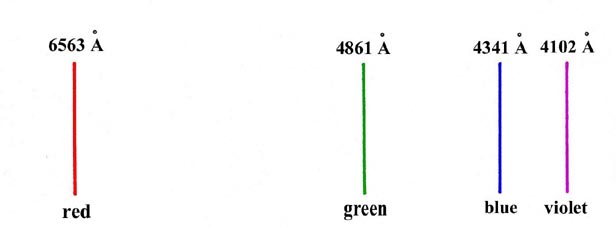
Fig. 1-1. El espectro visible para los átomos de hidrógeno (1Å = 1 Ångstrom = 1 '10 -8 cm)
La energía perdida por un electrón al ser atraída por el núcleo aparece en forma de luz. Si todas las energías fueran posibles para un electrón cuando se une a un átomo, todas las longitudes de onda o frecuencias deberían aparecer en su espectro de emisión, es decir, se debe observar un espectro continuo. El hecho de que sólo aparezcan ciertas líneas implica que sólo ciertos valores para la energía del electrón son posibles o permitidos. Podríamos describir esto asumiendo que se cuantifica la energía de un electrón unido a un átomo. El electrón puede entonces perder energía solo en cantidades fijas correspondientes a la diferencia de valor entre dos de los valores de energía permitidos o cuantificados del átomo. Dado que la energía de un fotón viene dada por
\(\varepsilon = hv\)
y e debe corresponder a la diferencia entre dos de los valores de energía permitidos para el electrón, digamos E y E '{E' > E), entonces el valor de la frecuencia correspondiente para el fotón vendrá dado por
\[\frac{E' - E}{h} = v = \frac{\varepsilon}{h} \label{4}\]
Obviamente, si solo se permiten ciertos valores de E, solo se observarán ciertos valores de e o n, y se observará un espectro lineal en lugar de un espectro continuo (que contiene todos los valores de n).
La ecuación\ ref {4} fue planteada por Bohr en 1913 y se conoce como condición de frecuencia de Bohr. Fue Bohr quien primero sugirió que los espectros de líneas atómicas podrían contabilizarse si asumimos que se cuantifica la energía del electrón unido a un átomo. Así se completa el paralelismo entre las propiedades de la luz y los electrones. Ambos exhiben el dualismo onda-partícula y se cuantifican las energías de ambos.
El efecto Compton
Los resultados de un experimento más jugarán un papel importante en nuestras discusiones sobre la naturaleza de los electrones unidos a un átomo. El experimento se refiere a la interacción directa de un fotón y un electrón.
Para determinar la posición de un objeto debemos de alguna manera “verlo”. Esto se hace reflejando o dispersando la luz del objeto a los ojos del observador. Sin embargo, al observar un objeto tan pequeño como el electrón debemos considerar la interacción de un fotón individual con un electrón individual. Se encuentra experimentalmente y este es el efecto Compton que cuando un fotón es dispersado por un electrón, la frecuencia del fotón emergente es menor que antes de la dispersión. Dado que e = h n, y se observa que n disminuye, parte de la energía del fotón se ha transmitido al electrón. Si el electrón estuviera inicialmente libre, la pérdida en la energía del fotón aparecería como energía cinética del electrón. De la ley de conservación de la energía,
\(hv - hv' = \frac{1}{2}mv^2 = kinetic\ energy\ of\ electron\)
donde n 'es la frecuencia del fotón después de la colisión con el electrón. Este experimento trae consigo un efecto muy importante en la realización de observaciones a nivel atómico. No podemos hacer una observación sobre un objeto sin al mismo tiempo perturbarlo. Obviamente, el electrón recibe una patada del fotón durante la observación. Si bien es posible determinar la cantidad de energía dada al electrón midiendo n y n ', sin embargo, no podemos predecir de antemano el momento final del electrón. Un conocimiento del impulso requiere un conocimiento de la dirección en la que el electrón se dispersa después de la colisión y si bien esto puede medirse experimentalmente no se puede predecir el resultado de un encuentro dado. Ilustraremos más adelante, con la ayuda de un ejemplo definido, que la información relativa tanto a la posición como al impulso de un electrón no se puede obtener con precisión ilimitada. Por el momento, todo lo que queremos sacar de este experimento es que debemos estar preparados para aceptar cierto grado de incertidumbre en los eventos que observamos a nivel atómico. La interacción del observador con el sistema que está observando puede ser ignorada en la mecánica clásica donde las masas son relativamente grandes. Esto no es cierto a nivel atómico ya que aquí las “herramientas” empleadas para hacer la observación necesariamente tienen masas y energías comparables a las del sistema que estamos observando.
En 1926 Schrodinger, inspirado en el concepto de “ondas de materia” de Broglie, formuló una ecuación cuyo papel en la resolución de problemas en la física atómica corresponde al interpretado por la ecuación de movimiento de Newton en la física clásica. Esta única ecuación predecirá correctamente todo el comportamiento físico, incluyendo, por ejemplo, los experimentos con electrones y luz discutidos anteriormente. La cuantificación se deriva automáticamente de esta ecuación, ahora llamada ecuación de Schrodinger, y su solución produce toda la información física que se puede conocer sobre un sistema dado. La ecuación de Schrodinger forma la base de la mecánica cuántica y hasta donde se sabe hoy en día las soluciones a todos los problemas de la química están contenidas en el marco de esta nueva mecánica. En el resto de este sitio nos ocuparemos del comportamiento de los electrones en átomos y moléculas según lo predicho e interpretado por la mecánica cuántica.

