6.E: Ejercicios
- Page ID
- 69403
Q6.1
El elemento berilio tiene un número atómico de cuatro. Racionalizar las siguientes observaciones en términos de la teoría del enlace de valencia de la estructura molecular.
- \(Be_2\)no existe excepto como una molécula de van der Waals débilmente unida.
- \(Be\)puede exhibir una valencia de dos en combinación con un halógeno, por ejemplo, BeF 2.
- \(BeF_2\)puede sufrir una reacción adicional con un exceso de iones F - para dar\[BeF_2 + 2F^- \rightarrow BeF_4^{-2}\] Además de explicar por qué ocurre esta reacción, predecir la forma geométrica del\(BeF_4^{-2}\) ion.
Q6.2
- Usar la teoría de enlaces de valencia para predecir la fórmula molecular y la estructura geométrica del hidruro de fósforo eléctricamente neutro más estable.
- El hidruro de fósforo puede reaccionar con HI para formar un cristal iónico que contiene el ion I. Explique por qué puede ocurrir esta reacción y dar la fórmula y estructura geométrica del ion positivo que contiene fósforo e hidrógeno.
Q6.3
El número atómico de silicio es catorce. ¿Cuál es la estructura electrónica del Si en su estado fundamental? Predecir la fórmula molecular y la forma geométrica del compuesto silicio-hidrógeno más estable usando la teoría de enlaces de valencia.
Q6.4
El elemento vanadio (Z = 23) forma el compuesto VCl 4. ¿Se desviaría un haz de moléculas de VCl 4 en un campo magnético no homogéneo? Explica el razonamiento detrás de tu respuesta. 5. La molécula CH 2 puede existir en dos formas distintas. En un caso todos los electrones están emparejados y la molécula no posee un momento magnético. En la segunda forma, la molécula exhibe un magnetismo que puede demostrarse que surge de la presencia de dos electrones desapareados. Una de las formas de CH 2 es lineal. Utilizar la teoría del enlace de valencia para describir las estructuras electrónicas y geometrías de ambas formas de CH 2. ¿Cuál de los dos poseerá la menor energía electrónica?
Q6.6
- Escribir estructuras de Lewis (estructuras en las que cada par de electrones se designa por una línea que une los núcleos y los puntos se utilizan para designar electrones no compartidos en la capa de valencia) para H 2 O, CH 4, CO 2, HF, NH 4 +, H 2 O 2.
- Dar una discusión sobre la unión de las moléculas enumeradas en la parte (a) en términos de teoría de enlaces de valencia. Denotar el uso de orbitales híbridos por flechas y una etiqueta en cuanto a si son híbridos sp, sp 2 o sp 3. Se debe predecir que H 2 O y H 2 O 2 son moléculas dobladas, que CH 4 y NH 4 + son tetraédricas y que CO 2 es lineal.
Q6.7
A veces es posible escribir una serie de estructuras de Lewis equivalentes para una sola especie. Por ejemplo, la unión en el ion NO 3 puede describirse mediante:
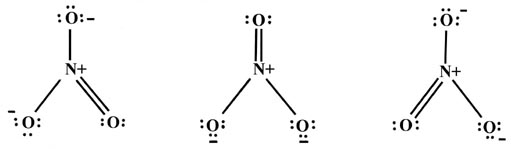
Cada átomo en estas estructuras está rodeado por cuatro pares de electrones, la primera regla cardinal al escribir una estructura de Lewis. En promedio, un electrón del par en cada enlace pertenece a un átomo. Dado que solo hay cuatro enlaces a N y no hay pares de valencia no compartidos, N en promedio tiene solo cuatro electrones de valencia en estas tres estructuras. El átomo de N poseía inicialmente cinco electrones, y un signo más se coloca en N para denotar que tiene, en promedio, un electrón menos en el ion NO 3 -. Los dos oxígenos unidos por un solo enlace tienen en promedio siete electrones en cada estructura, uno más que un átomo de oxígeno neutro. Esto se denota con un signo menos. El O de doble enlace tiene en promedio seis electrones. Observe que la suma de estos cargos formales es menos uno, el cargo correcto para el NO 3 - ion.
La estructura del ion NO 3 es en realidad plana y simétrica, siendo todos los enlaces NO de igual longitud. Esto podría indicarse en una sola estructura de Lewis indicando que el par final de electrones en el enlace p entre N y un O en realidad se extiende sobre los tres enlaces NO simultáneamente:
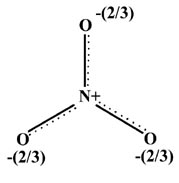
Cuando uno o más pares de electrones se deslocalizan sobre más de dos átomos, el método de Lewis o el método de enlace de valencia de escribir estructuras de valencia con enlaces entre pares de átomos se encuentra en dificultades. La estructura de compromiso anterior indica correctamente que cada enlace NO en NO 3 - es más fuerte y más corto que un enlace sencillo N�O, pero no tan fuerte como un doble enlace N=O.
- Utilice la teoría del enlace de valencia para dar cuenta de la unión y la estructura plana del ion NO 3 -.
- Escriba las estructuras de Lewis y las correspondientes estructuras de enlace de valencia para el ion CO 3 -2 y SO 2. ¿Hay dobles enlaces completos S=O o C=O en alguna de estas moléculas?
Q6.8
Dibujar estructuras de enlace de valencia para benceno, C 6 H 6. Esta molécula tiene una geometría hexagonal plana:
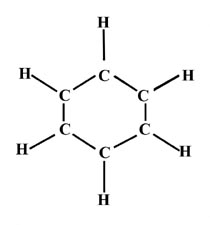
¿Hay pares de electrones deslocalizados en la molécula de benceno?
Q6.9
La molécula de monóxido de carbono forma complejos estables con muchos elementos de metales de transición. Los ejemplos son (de la primera serie de metales de transición)
Cr (CO) 6, (CO) 5 Mn Mn (CO) 5, Fe (CO) 5, Ni (CO) 4
En cada caso el enlace se forma entre el metal y el par de electrones no compartidos en el extremo de carbono del monóxido de carbono. El átomo metálico en estos complejos obviamente viola la regla del octeto, pero ¿se pueden racionalizar las estructuras electrónicas de los complejos de monóxido de carbono sobre la base de una cubierta de valencia expandida para el metal?

