7.1: Introducción
- Page ID
- 69379
Unión Iónica y Covalente
La distribución de carga negativa en una molécula exhibirá diversos grados de asimetría dependiendo de las capacidades relativas de los núcleos en la molécula para atraer y unir la densidad de carga electrónica. La simetría o asimetría de la distribución de carga juega un papel fundamental en la determinación de las propiedades químicas de la molécula y en consecuencia esta propiedad de la distribución de carga se utiliza como base para la clasificación de los enlaces químicos.
Podemos prever dos extremos para la distribución de la densidad de carga de valencia. Un ejemplo de uno de los extremos se obtiene cuando se forma un enlace entre dos átomos idénticos. La densidad de carga de los electrones de valencia será en este caso necesariamente deslocalizada por igual sobre las regiones correspondientes de cada núcleo ya que ambos núcleos atraerán la densidad de electrones con igual fuerza. Tal reparto igual de la densidad de carga es un ejemplo de unión covalente y se ejemplifica por la distribución de carga molecular de N2 (Fig. 7-1).
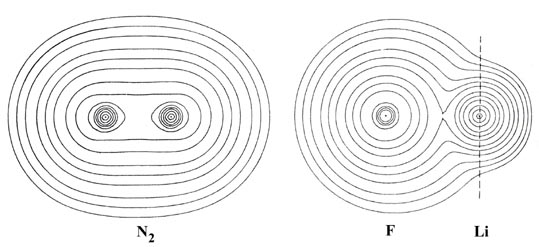
Fig. 7-1. Mapas de contorno de las distribuciones de carga molecular de N2 y LiF en sus separaciones internucleares en equilibrio. El espacio a la derecha de la línea discontinua a través del núcleo de Li denota la región de densidad de carga no enlazada. Los valores de los contornos aumentan desde el más exterior hasta el más interno. Los valores específicos de los contornos que aparecen en este y los siguientes mapas de contorno se pueden obtener haciendo referencia a la Tabla de Valores de Contorno.
La distribución de carga de LiF (Fig. 7-1) proporciona un ejemplo del otro extremo, denominado unión iónica, obtenido cuando se forma un enlace entre dos átomos con afinidades muy diferentes para la densidad de carga electrónica. La distribución muy asimétrica de la carga en LiF no es simplemente un reflejo del átomo de flúor que posee siete electrones de valencia al de litio. En cambio, la formación del enlace en LiF corresponde a la transferencia casi completa de la densidad de carga de valencia del litio al flúor dando como resultado una molécula mejor descrita como Li + F -. Solo necesitamos recordar que inicialmente un átomo de litio es considerablemente mayor que un átomo de flúor para darnos cuenta de que se ha producido una transferencia considerable de carga en la formación de la molécula de LiF.
En N 2 la densidad de carga de valencia se deslocaliza sobre toda la molécula. La carga electrónica está fuertemente concentrada en la región internuclear donde forma un puente de alta densidad entre los dos núcleos. Solo la densidad de los orbitales de la cáscara interna o “núcleo” de 1 s está fuertemente localizada en las regiones de los núcleos. En contraste con esto, prácticamente toda la densidad de carga en la molécula de fluoruro de litio se localiza en contornos casi esféricos en los dos núcleos de la manera característica de dos distribuciones separadas de cubierta cerrada. Solo contornos de muy pequeño valor abarcan ambos núcleos y el puente de densidad de carga que une las dos distribuciones esféricas es muy bajo en valor, siendo aproximadamente una décima parte del valor observado para N 2.
Podemos determinar la cantidad total de carga electrónica en una región arbitraria del espacio sumando la densidad en cada elemento de pequeño volumen dentro de la región de interés (es decir, integrando la distribución de carga sobre algún volumen particular de espacio):
|
|
Se obtiene una medida útil del grado de transferencia de carga que ocurre en la formación de enlaces determinando la carga no unida en cada núcleo. La carga no unida para un núcleo en una molécula se define como ocupar el volumen de espacio en el lado no unido de un plano perpendicular al eje de enlace y a través del núcleo en cuestión. Esto se indica mediante una línea discontinua para el núcleo de Li en LiF (Fig. 7-1).
La densidad de carga no enlazada del núcleo de litio en LiF es de 1.07 e -comparado con 1.5 e - en el átomo de Li (es decir, la mitad del número total de cargas electrónicas en un átomo de Li). La densidad de carga no enlazada del núcleo F, por otra parte, se incrementa por encima de su valor atómico, siendo 5.0 e -en comparación con 4.5 e - en el átomo de flúor. Dado que las distribuciones centradas en los núcleos en LiF son casi esféricas, la carga total contenida en cada distribución será aproximadamente el doble del valor de la carga no enlazada correspondiente. La distribución total de carga en LiF es, por lo tanto, consistente con el modelo iónico Li + F - correspondiente a la transferencia del electrón de valencia único de 2 s del litio al flúor. Los radios de las distribuciones de carga no enlazadas (la distancia medida a lo largo del eje de enlace desde un núcleo hasta el contorno más exterior de su densidad no enlazada) también son consistentes con el modelo iónico. El radio de la densidad de carga no enlazada sobre litio es 1.7 a o, un valor casi idéntico al radio de un ion Li + (1.8 a o) pero mucho menor que el radio de un átomo de Li (3.3 a o). El valor de 3.0 a o para el radio de la densidad de carga no enlazada sobre flúor es consistente con el de una distribución de iones fluoruro ya que representa un ligero aumento sobre el valor atómico para flúor de 2.8 a o.
A modo de comparación, la carga no enlazada en los núcleos de nitrógeno en N 2 se incrementa por encima del valor atómico de 3.5 e - a 3.68 e -. Esta transferencia de densidad de carga a las regiones no unidas en la formación de enlaces es algo sorprendente cuando se recuerda que la densidad de carga debe acumularse en la región de unión, la región entre los núcleos, para lograr un enlace químico. Se requiere una imagen más detallada de la reorganización de carga que acompaña a la formación de un enlace para comprender completamente la distribución de la densidad de carga en una molécula. Además, muchos enlaces químicos poseen distribuciones de carga que se encuentran entre el extremo de la perfecta distribución de la densidad de carga de valencia encontrada en N 2 y su localización completa en un núcleo en LiF.
Consideramos a continuación un método de clasificación de la unión en moléculas, una clasificación que proporciona al mismo tiempo una comprensión del mecanismo de las dos situaciones de unión en términos de las fuerzas ejercidas sobre los núcleos.

