8.E: Ejercicios
- Page ID
- 69436
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
| 1. | (a) | Dar las configuraciones electrónicas orbitales moleculares de las moléculas N 2 y Ne 2. | ||
| b) | ¿La diferencia en el número de orbitales de enlace ocupado y antienlace concuerda con el número de enlaces de pares de electrones que una estructura de Lewis predeciría para estas dos moléculas? | |||
| 2. | Completar el diagrama de correlación (Fig. 8-4) para los orbitales moleculares diatómicos homonucleares correlacionando cada orbital molecular con un orbital atómico del átomo unido. La simetría y la propiedad nodal de cada orbital deben conservarse en la correlación. Comenzando con el orbital molecular de menor energía, cada orbital molecular se correlacionará a su vez con el orbital atómico de energía más baja que posee la misma simetría. Todos los orbitales atómicos con valores l pares son de simetría g y aquellos con valores l impares son de simetría u. | |||
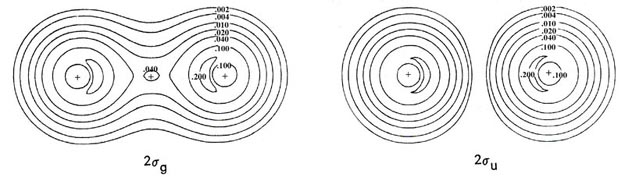
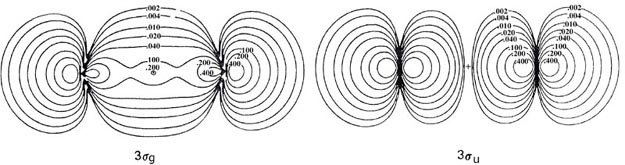
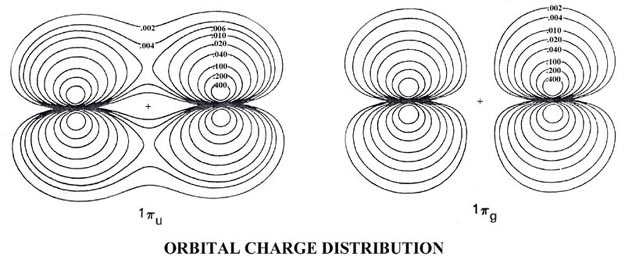
| 3. | Las distribuciones de carga orbital total y molecular del ion bifluoruro (FHF) - se muestran en la Fig. 8-12. 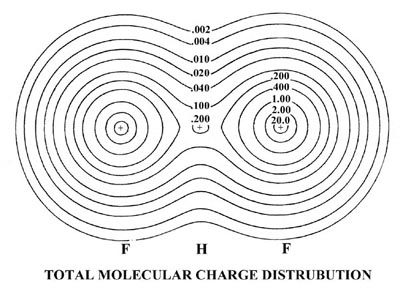
Fig. 8-12. Mapas de contorno de la distribución de carga molecular total y las densidades orbitales moleculares para el ion (FHF) - que tiene la configuración electrónica Esta molécula cargada negativamente es el resultado de la reacción de un ion fluoruro con una molécula de fluoruro de hidrógeno. La molécula tiene una estructura lineal y simétrica con el protón formando un enlace entre los fluorinos. Por lo tanto, los orbitales moleculares tienen la misma clasificación de simetría (s o p y g o u) que los orbitales para las moléculas diatómicas homonucleares. |
|||
| (a) | Dar una comparación cualitativa de las formas y propiedades de unión de los orbitales moleculares para (FHF) - con las de la molécula diatómica homonuclear F 2. (Los orbitales moleculares para F 2 son muy similares a los mostrados en la Fig. 8-8 para O 2. El orbital 3 s u no está ocupado en el estado básico de F 2.) Las densidades orbitales moleculares de 1 s g y 1 s u para (FHF) - no se ilustran ya que, al igual que los orbitales correspondientes en la diatómica homonuclear, son simplemente de concha interna 1 s atómica distribuciones centradas en el átomo de flúor. | |||
| b) | Cuenta de las formas generales y los componentes orbitales atómicos primarios de los orbitales moleculares en (FHF) - en términos de la simple aproximación LCAO usando propiedades de simetría y las energías relativas de los orbitales en H y F. | |||
| 4. | La molécula CO 2 es otra molécula triatómica simétrica lineal que posee las mismas propiedades de simetría que las moléculas diatómicas homonucleares. Los orbitales moleculares serán de simetría s o p y g o u. A partir de un conocimiento de las simetrías de los orbitales atómicos 1 s, 2 s y 2 p y sus energías relativas dadas para C y O en la Fig. 5-3 predicen la configuración electrónica de la molécula de CO 2 en términos de orbitales moleculares. | |||
| 5. | La molécula de CO es isoelectrónica con la molécula de N 2 y se puede pensar que deriva de N 2 transfiriendo un protón de un núcleo N al otro. Los orbitales moleculares de CO serán de simetría s o p pero no exhibirán ninguna dependencia g o u ya que el centro de simetría se ha perdido. Derivar la configuración electrónica del CO considerando cómo se cambiará cada orbital molecular de N 2 a medida que una carga nuclear de N se incrementa en una unidad y la otra disminuye en una unidad. Como indicio, el orbital 1 s g de N 2 se convertirá en el orbital de 1 s de CO. La referencia a la Fig. 5-3 muestra que el orbital de 1 s de O es considerablemente más estable que el orbital de 1 s de C. Así, el orbital de 1 s g de N 2 que se concentra igualmente en l s como atómico. orbitales en ambos núcleos N, se convierte en un orbital atómico similar a 1 s en O. De manera similar, el orbital 1 s u de N 2 se convierte en un orbital similar a 1 s en C. | |||
| 6. | Usando los orbitales atómicos 1 s, 2 s, 2 p s y 2 p p en C y el orbital 1 s en H discuten las formas simples de LCAO esperadas para los orbitales moleculares de la forma lineal de metileno, CH 2. Se puede considerar este problema desde el punto de vista de cómo cambiarían los orbitales moleculares de CH dados en el texto si se elevara un segundo protón al lado no enlazado del átomo de C. | |||
| 7. | Construir un diagrama de correlación para la molécula de HF que relacione los orbitales moleculares con los orbitales de los átomos separados. Organizar los orbitales atómicos de H y F en el lado derecho del diagrama en orden de aumentar la energía. Las energías de los orbitales moleculares de 1 s, 2 s, 3 s y 1 p en la molécula de HF son -26.29 au, -1.60 au, -0.77 au y -0.65 au respectivamente. ¿La energía de la órbita de 1 s en F está muy afectada por la formación del enlace químico con H? | |||
| 8. | Construir un diagrama de correlación para la molécula de CO que relacione los orbitales moleculares con los de los átomos separados. Organizar los orbitales atómicos tanto de C como de O en el lado derecho del diagrama en el orden de aumentar la energía. Solo orbitales atómicos de la misma simetría pueden interactuar para formar un orbital molecular y el orbital molecular resultante tendrá esta misma simetría. Las energías de los orbitales moleculares en CO en au son 1 s (-20.67), 2 s (-11.37), 3 s (-1.53) 4 s (-0.81), 5 s (-0.56), 1 p (-0.65). Recordemos que los orbitales atómicos de 2 p en C y O pueden formar orbitales moleculares de simetría tanto s como p. | |||
| 9. | El diagrama de correlación en el Problema 7 correlaciona los orbitales de átomos separados para R = ¥ con los orbitales moleculares en R e, la distancia internuclear de equilibrio en la molécula. Continuar la correlación de los orbitales con el caso limitante de R = 0, el átomo unido. Cuando la distancia entre el núcleo F y el protón disminuye a cero el resultado es un núcleo de neón y un átomo de neón. La energía electrónica de cada orbital molecular debe correlacionarse suavemente con un nivel de energía atómica del átomo unido, conservándose nuevamente la simetría. Por ejemplo, el orbital molecular de 1 s se correlacionará con el orbital atómico de 1 s del átomo de Ne. ¿Los espaciamientos entre los niveles de energía para HF se asemejan más a los de los átomos unidos o separados? Es decir, ¿es la estructura electrónica del HF mejor comparada con la del átomo de Ne o con la de los niveles de energía perturbados de los átomos F y H? |
|||