12.2: Perfiles de concentración para algunos mecanismos simples
- Page ID
- 72480
Para ilustrar cómo los mecanismos pueden afectar el perfil de concentración de una reacción, podemos examinar algunos mecanismos simples
\(A \rightarrow B\)
En este tipo de reacciones, una sustancia simplemente se está convirtiendo en otra. Un ejemplo de este tipo de reacción podría ser la isomerización de metilcianuro para formar acetonitrilo (metilcianuro) (Redmon, Purvis, & Bartlett, 1978). Si el mecanismo de reacción consiste en una sola etapa unimolecular, que se caracteriza por la constante de velocidad\(k_1\):
\[ A \xrightarrow{k_1} B\]
entonces tasa de cambio de las concentraciones de\(A\) y\(B\) puede escribirse
\[\dfrac{d[A]}{dt} = - k_1 [A]\]
y
\[\dfrac{d[B]}{dt} = + k_1 [A]\]
Una gráfica de las concentraciones en función del tiempo se vería de la siguiente manera:

Se puede ver fácilmente que la concentración del reactivo (A) disminuye a medida que avanza el tiempo, y la del producto (B) aumenta. Esto continuará hasta que se agote el reactivo A.
\(A \rightleftharpoons B\)
Cuando el sistema puede establecer equilibrio, la velocidad de cambio de la concentración de A y B dependerá tanto de las reacciones hacia adelante como de las reacciones inversas. Si k 1 es la constante de velocidad que caracteriza la reacción directa
\[ A \xrightarrow{k_1} B\]
y k -1 lo que caracteriza a la inversa
\[ B \xrightarrow{k_{-1}} A\]
la tasa de cambio en las concentraciones de A y B se puede expresar
\[\dfrac{d[A]}{dt} = - k_1 [A] + k_{-1} [B]\]
y
\[\dfrac{d[B]}{dt} = + k_1 [A] - k_{-1} [B]\]
El perfil de concentración para esta situación se ve de la siguiente manera:
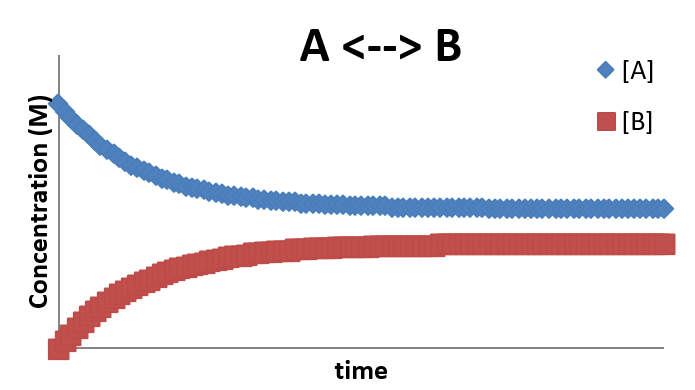
Este perfil se caracteriza por el hecho de que después de cierto tiempo, el sistema alcanza el equilibrio y las concentraciones dejan de cambiar (aunque las reacciones hacia adelante y hacia atrás siguen teniendo lugar. Esta es la naturaleza de un equilibrio dinámico del que hablamos fuera de la época en química. Las concentraciones finales de [A] y [B] una vez establecido el equilibrio dependerán de la relación de k 1 y k -
Dado que la tasa de formación de\(A\) (desde el paso inverso) es igual a la tasa de consumo de\(A\) (desde el paso hacia adelante, la tasa general de cambio de la concentración de A es cero una vez que se ha establecido el equilibrio. Por lo que debería quedar claro que
\[k_1[A] = k_{-1}[B]\]
o
\[\dfrac{k_1}{k_{-1}} = \dfrac{[B]}{[A]}\]
y la relación o f\(k_1\) a\(k_{-1}\) da el valor de la constante de equilibrio!
\(A + C \rightarrow B + C\)
Algunas reacciones requieren un catalizador para mediar la conversión de reactivos en productos. La definición de catalizador es una especie que debe agregarse (no se forma como intermedio) aparece en el mecanismo (generalmente en un paso muy temprano) y esto termina como parte de la ley de tasas, sino que se reforma posteriormente para que no aparezca en la estequiometría general. Si la reacción
\[A \rightarrow B\]
es ayudado por un catalizador\(C\), entonces un mecanismo de reacción posible (de un solo paso) podría ser
\[A + C \rightarrow B + C\]
En este caso,\(C\) está actuando como catalizador a la reacción. La tasa de cambio de las concentraciones se puede encontrar por
\[\dfrac{[A]}{dt} = -k [A][C]\]
\[\dfrac{[B]}{dt} = k [A][C]\]
\[\dfrac{[C]}{dt} = - k [A][C] + k [A][C] = 0\]
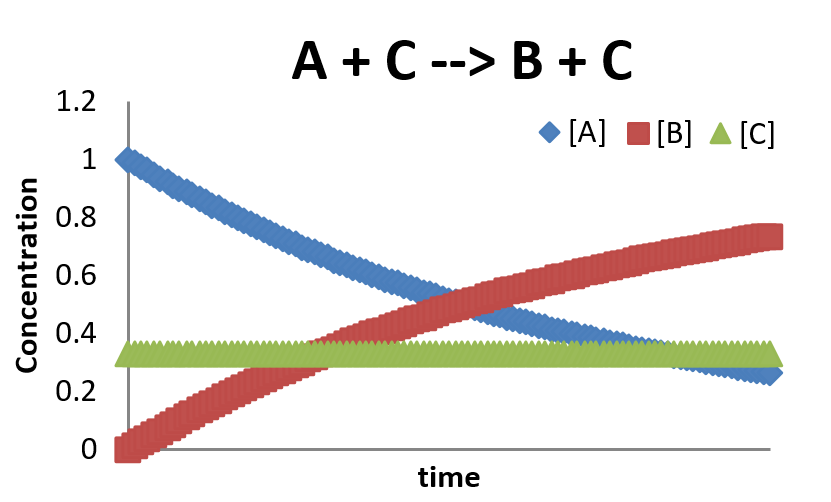
Esta es una imagen muy simplificada de una reacción catalizada. Generalmente, una reacción catalizada requerirá al menos dos etapas:
\[A +C \rightarrow AC\]
\[AC \rightarrow B + C\]
Posteriormente, veremos cómo la aproximación en estado estacionario predice realmente el perfil de concentración descrito anteriormente para el mecanismo de dos etapas cuando\(AC\) es una especie de corta vida que puede tratarse como que tiene una concentración constante y pequeña.
\(A \rightarrow B \rightarrow C\)
Otra característica mecanicista importante (y muy común) es la formación de un intermedio. Esta es una especie que se forma en al menos una de las etapas del mecanismo, pero no aparece en la estequiometría general para la reacción. Esto es diferente de un catalizador que debe agregarse para acelerar la reacción. Un ejemplo sencillo de un mecanismo de reacción que implica la formación de un catalizador es
\[ A \xrightarrow{k_1} B\]
\[ B \xrightarrow{k_2} C\]
En este caso,\(C\) no se puede formar hasta que se\(B\) haya creado una concentración apreciable del intermedio por el primer paso del mecanismo.
La tasa de cambio de las concentraciones de\(A\)\(B\), y se\(C\) puede expresar
\[\dfrac{[A]}{dt} = -k_1 [A]\]
\[\dfrac{[B]}{dt} = k_1 [A] - k_2 [B]\]
\[\dfrac{[C]}{dt} = k_2 [B]\]
A continuación se muestra el perfil de concentración. Observe el retraso en la formación de\(C\).

\(A \rightleftharpoons B \rightarrow C\)
En muchos casos, la formación de un intermedio implica un paso reversible. A este paso se le hace referencia a veces como un paso de preequilibrio ya que a menudo establecerá un equilibrio cercano mientras la reacción progresa. El resultado de combinar un preequilibrio con un intermedio produce un perfil que muestra características de ambos mecanismos más simples. Un ejemplo de tal mecanismo es
\[ A \xrightleftharpoons [k_1]{k_{-1}} B\]
\[ B \xrightarrow{k_2} C\]
En este caso, la tasa de cambio para las concentraciones de\(A\)\(B\), y\(C\) puede ser expresada por
\[\dfrac{[A]}{dt} = -k_1 [A] + -k_{-1} [B]\]
\[\dfrac{[B]}{dt} = k_1 [A] -k_{-1} [B] - k_2 [B]\]
\[\dfrac{[C]}{dt} = k_2 [B]\]
A continuación se muestra el perfil de concentración para este mecanismo. Nuevamente, observe el retraso en la producción del producto\(C\), debido al requisito de que la concentración de B sea lo suficientemente alta como para permitir que el segundo paso ocurra con una tasa apreciable.
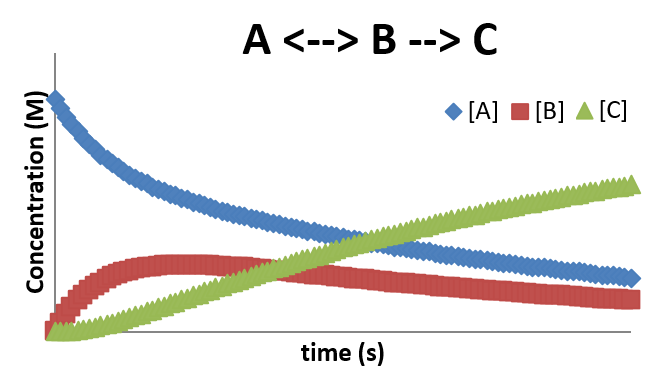
\(A \rightarrow B\)y\(A \rightarrow C\)
Hay muchos casos en los que un reactivo puede seguir caminos hacia diferentes productos (¡o a veces incluso los mismos productos!) , y esos caminos compiten entre sí. Un ejemplo es el siguiente mecanismo simple:
\[ A \xrightarrow{k_{-1}} B\]
\[ A \xrightarrow{k_2} C\]
En este caso, la tasa de cambio en las concentraciones se puede expresar como
\[\dfrac{[A]}{dt} = -k_1 [A] + -k_2 [A] \]
\[\dfrac{[B]}{dt} = + k_1 [A] \]
\[\dfrac{[C]}{dt} = + k_2 [A]\]
En general, el perfil parece dos descomposiciones de primer orden que ocurren al mismo tiempo, favoreciéndose la concentración final del producto formado con la constante de velocidad mayor.

Uno de los objetivos del estudio de la cinética química es entender cómo alterar las condiciones de reacción para favorecer la producción de productos de reacción deseables. Esto se puede lograr por una serie de medios, como la alteración de las concentraciones, la temperatura, la adición de catalizadores, etc. La comprensión de los conceptos básicos conducirá (ojalá) a una mejor comprensión de cómo los perfiles de concentración pueden ser alterados al cambiar las condiciones.


