9.12: Teoría molecular-orbital también se aplica a las moléculas diatómicas heteronucleares
- Page ID
- 79915
Las moléculas diatómicas con dos átomos diferentes se denominan moléculas diatómicas heteronucleares. Cuando dos átomos no idénticos interactúan para formar un enlace químico, los orbitales atómicos que interactúan no tienen la misma energía. Si, por ejemplo, el elemento B es más electronegativo que el elemento A (χ B > χ A), el resultado neto es un diagrama orbital molecular “sesgado” de nivel de energía, como el que se muestra para una hipotética molécula A—B en la Figura\(\PageIndex{4}\). Los orbitales atómicos del elemento B son uniformemente más bajos en energía que los orbitales atómicos correspondientes del elemento A debido a la mayor estabilidad de los electrones en el elemento B. Los orbitales moleculares ya no son simétricos, y las energías de los orbitales moleculares enlazantes son más similares a las del orbitales atómicos de B. De ahí que la densidad electrónica de los electrones de unión probablemente esté más cerca del átomo más electronegativo. De esta manera, la teoría orbital molecular puede describir un enlace covalente polar.
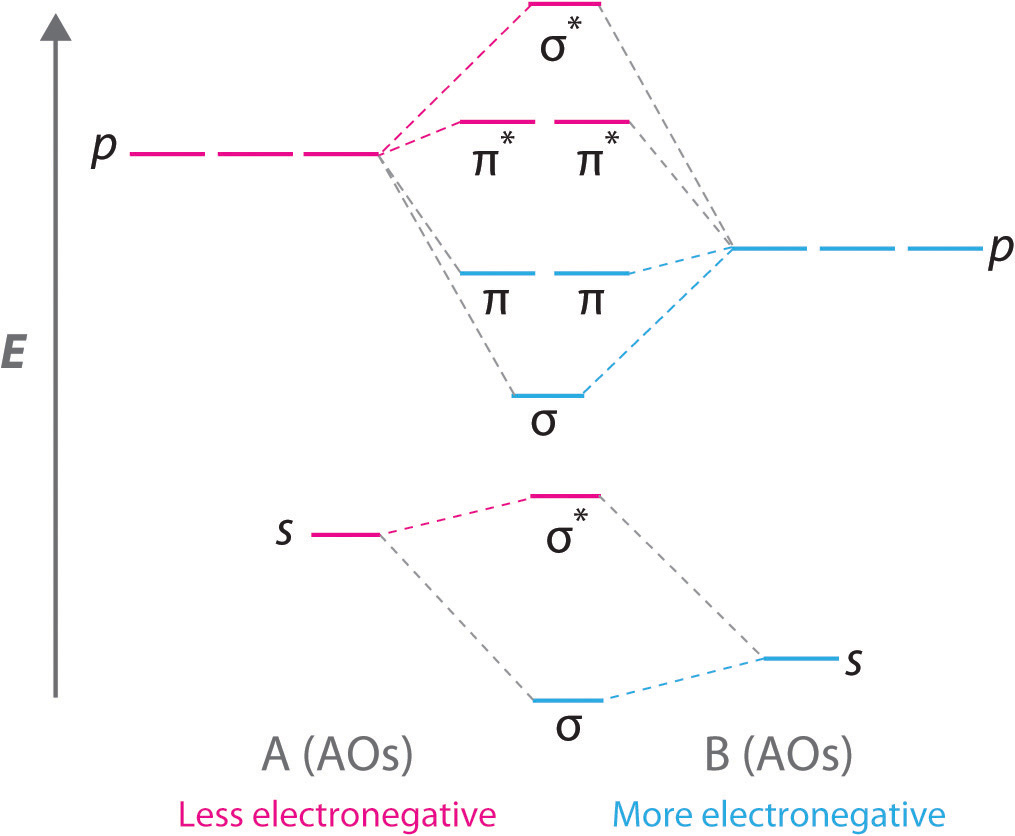
Un diagrama orbital molecular de nivel de energía siempre está sesgado hacia el átomo más electronegativo.
El óxido nítrico (NO) es un ejemplo de una molécula diatómica heteronuclear. La reacción de O 2 con N 2 a altas temperaturas en motores de combustión interna forma óxido nítrico, el cual experimenta una reacción compleja con O 2 para producir NO 2, que a su vez es responsable del color marrón que asociamos con la contaminación del aire. Recientemente, sin embargo, también se ha reconocido que el óxido nítrico es un mensajero biológico vital involucrado en la regulación de la presión arterial y la memoria a largo plazo en mamíferos.
Debido a que el NO tiene un número impar de electrones de valencia (5 de nitrógeno y 6 de oxígeno, para un total de 11), su unión y propiedades no pueden explicarse con éxito ni por el enfoque de pares de electrones de Lewis ni por la teoría de enlaces de valencia. El diagrama de nivel de energía orbital molecular para NO (Figura\(\PageIndex{13}\)) muestra que el patrón general es similar al de la molécula O 2 (Figura\(\PageIndex{11}\)). Debido a que 10 electrones son suficientes para llenar todos los orbitales moleculares enlazantes derivados de orbitales atómicos de 2 p, el undécimo electrón debe ocupar uno de los orbitales π * degenerados. El orden de enlace previsto para NO es, por lo tanto, (8-3) ÷ 2 = 2 1/2. Los datos experimentales, que muestran una longitud de enlace N-O de 115pm y una energía de enlace N-O de 631 kJ/mol, son consistentes con esta descripción. Estos valores se encuentran entre los de las moléculas N 2 y O 2, que tienen enlaces triples y dobles, respectivamente. Como dijimos anteriormente, la teoría orbital molecular puede explicar por lo tanto la unión en moléculas con un número impar de electrones, como el NO, mientras que las estructuras de electrones de Lewis no pueden.
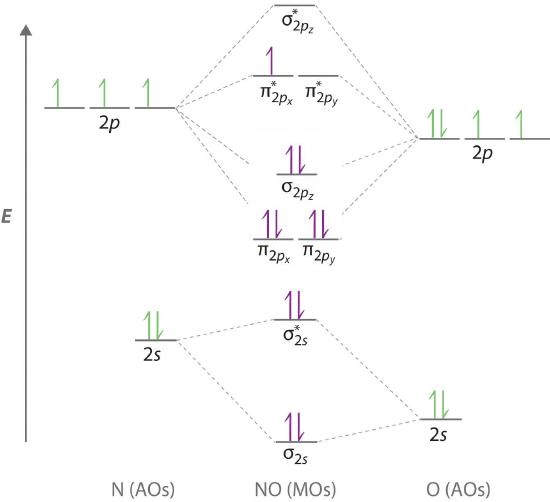
Tenga en cuenta que los estudios de estructura electrónica muestran que la configuración del\(\ce{NO}\) estado fundamental de estar\( \left ( \sigma _{2s} \right)^{2}\left ( \sigma ^{\star }_{2s} \right)^{2}\left ( \pi _{2p_{x,y}} \right)^{4} \left ( \sigma _{2p_{z}} \right)^{2} \left ( \pi _{2p ^{\star }_{x,y}} \right)^{1} \) en orden de aumentar la energía. De ahí que los\( \pi _{2p_{x,y}}\) orbitales sean más bajos en energía que los\(\sigma _{2p_{z}}\) orbitales. Esto se debe a que la\(\ce{NO}\) molécula está cerca de la transición de los niveles de energías de volteo observados en las diatómicas homonucleares donde el enlace sigma cae por debajo del enlace pi (Figura\(\PageIndex{11}\)).
La teoría orbital molecular también puede decirnos algo sobre la química de\(NO\). Como se indica en el diagrama de nivel de energía de la Figura\(\PageIndex{13}\), el NO tiene un solo electrón en un orbital molecular de relativamente alta energía. Por lo tanto, podríamos esperar que tenga una reactividad similar a los metales alcalinos como Li y Na con sus electrones de valencia única. De hecho,\(NO\) se oxida fácilmente al\(NO^+\) catión, que es isoelectrónico con\(N_2\) y tiene un orden de enlace de 3, correspondiente a un triple enlace N=O.
Orbitales moleculares no enlazantes
La teoría orbital molecular también es capaz de explicar la presencia de pares solitarios de electrones. Consideremos, por ejemplo, la molécula de HCl, cuya estructura de electrones de Lewis tiene tres pares solitarios de electrones en el átomo de cloro. Usando el enfoque orbital molecular para describir el enlace en HCl, podemos ver en la Figura\(\PageIndex{6}\) que el orbital de 1 s del hidrógeno atómico es el más cercano en energía a los orbitales de 3 p del cloro. En consecuencia, el orbital atómico lleno de Cl 3 s no está involucrado en la unión en ningún grado apreciable, y las únicas interacciones importantes son las que existen entre los orbitales H 1 s y Cl 3 p. De los tres orbitales p, solo uno, designado como 3 p z, puede interactuar con el orbital H 1 s. Los orbitales atómicos de 3 p x y 3 p y no tienen solapamiento neto con el orbital de 1 s sobre hidrógeno, por lo que no están involucrados en el enlace. Debido a que las energías de los orbitales Cl 3 s, 3 p x y 3 p y no cambian cuando se forma HCl, se denominan orbitales moleculares no enlazantes. Un orbital molecular no enlazante ocupado por un par de electrones es el equivalente orbital molecular de un par solitario de electrones. Por definición, los electrones en orbitales no enlazantes no tienen ningún efecto sobre el orden de enlace, por lo que no se cuentan en el cálculo del orden de enlace. Así, el orden de enlace previsto de HCl es (2 − 0) ÷ 2 = 1. Debido a que el orbital molecular de enlace σ está más cerca en energía al Cl 3 p z que al orbital atómico H 1 s, los electrones en el orbital σ se concentran más cerca del átomo de cloro que al hidrógeno. Por lo tanto, se puede usar un enfoque orbital molecular para la unión para describir la polarización del enlace H—Cl para dar\( H^{\delta +} -- Cl^{\delta -} \).
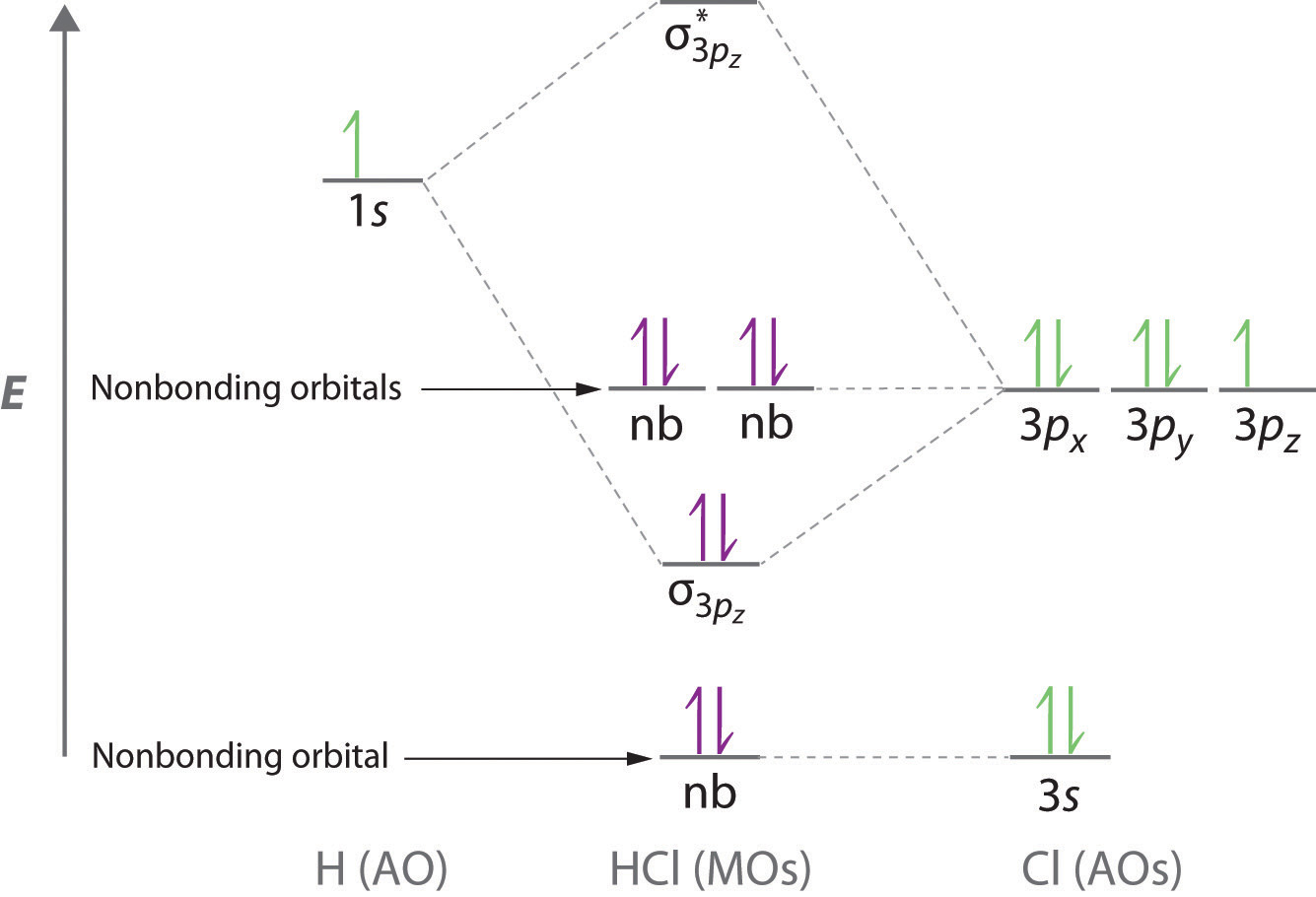
Los electrones en orbitales moleculares no enlazantes no tienen ningún efecto sobre el orden de los enlaces.
Use un diagrama de nivel de energía orbital molecular “sesgado” como el de la Figura\(\PageIndex{4}\) para describir la unión en el ion cianuro (CN −). ¿Cuál es la orden de fianza?
Dado: especies químicas
Preguntado por: diagrama de nivel de energía orbital molecular “sesgado”, descripción de la unión y orden de enlace
Estrategia:
- Calcular el número total de electrones de valencia en CN −. Luego coloque estos electrones en un diagrama orbital molecular de nivel de energía como Figura\(\PageIndex{4}\) en orden de aumento de energía. Asegúrate de obedecer el principio Pauli y la regla de Hund mientras lo haces.
- Calcular el orden de unión y describir la unión en CN −.
Solución:
A El ion CN − tiene un total de 10 electrones de valencia: 4 de C, 5 de N y 1 para la carga −1. Colocar estos electrones en un diagrama de nivel de energía como Figura\(\PageIndex{4}\) llena los cinco orbitales de menor energía, como se muestra aquí:
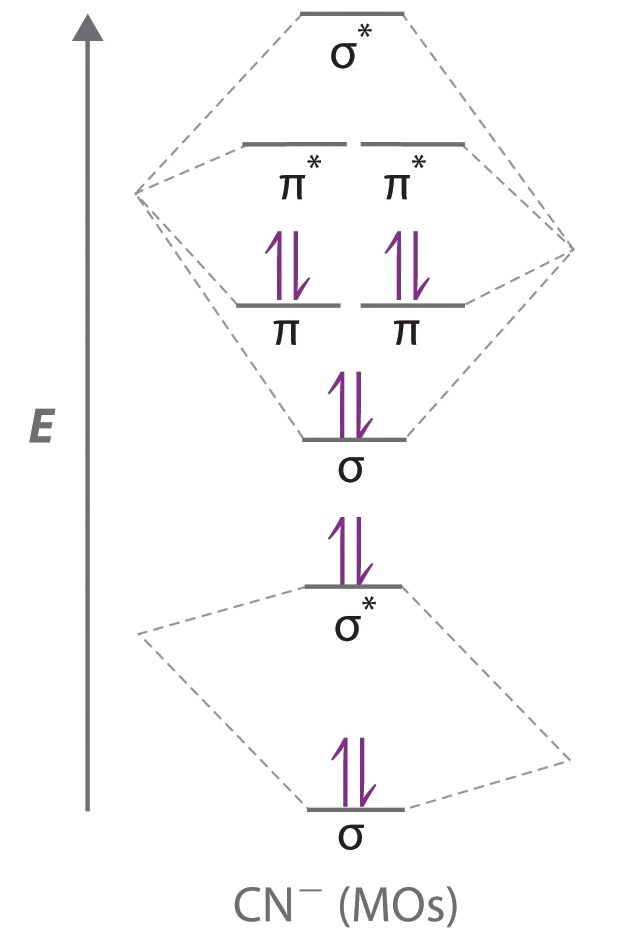
Porque\(\chi_N > \chi_C\), los orbitales atómicos de N (a la derecha) son más bajos en energía que los de C.
B La configuración electrónica de valencia resultante da un orden de enlace predicho de (8 − 2) ÷ 2 = 3, lo que indica que el ion CN − tiene un triple enlace, análogo al de N 2.
Utilice un diagrama cualitativo de nivel de energía orbital molecular para describir la unión en el ion hipoclorito (OCl −). ¿Cuál es la orden de fianza?
- Contestar
-
Todos los orbitales moleculares excepto el σ* de mayor energía se llenan, dando un orden de enlace de 1.
Aunque el enfoque orbital molecular revela mucho sobre el enlace en una molécula dada, el procedimiento rápidamente se vuelve computacionalmente intensivo para moléculas de complejidad incluso moderada. Además, debido a que los orbitales moleculares computados se extienden por toda la molécula, a menudo son difíciles de representar de una manera fácil de visualizar. Por lo tanto, no utilizamos un enfoque orbital molecular puro para describir la unión en moléculas o iones con más de dos átomos. En cambio, utilizamos un enfoque de enlace de valencia y un enfoque orbital molecular para explicar, entre otras cosas, el concepto de resonancia, lo que no puede explicarse adecuadamente utilizando otros métodos.
Resumen
Se pueden crear diagramas orbitales moleculares de nivel de energía para moléculas diatómicas si se conoce la configuración electrónica de los átomos progenitores, siguiendo algunas reglas simples. Lo más importante es que el número de orbitales moleculares en una molécula es el mismo que el número de orbitales atómicos que interactúan. La diferencia entre las combinaciones orbitales moleculares ligantes y antiadherentes es proporcional a la superposición de los orbitales progenitores y disminuye a medida que aumenta la diferencia de energía entre los orbitales atómicos parentales. Con tal enfoque, se pueden entender las estructuras electrónicas de prácticamente todas las moléculas diatómicas homonucleares comúnmente encontradas, moléculas con dos átomos idénticos. El enfoque orbital molecular predice correctamente que la molécula O 2 tiene dos electrones desapareados y por lo tanto es atraída hacia un campo magnético. En contraste, la mayoría de las sustancias solo tienen electrones emparejados. Un procedimiento similar se puede aplicar a moléculas con dos átomos diferentes, llamadas moléculas diatómicas heteronucleares, utilizando un diagrama orbital molecular de nivel de energía que está sesgado o inclinado hacia el elemento más electronegativo. La teoría orbital molecular es capaz de describir el enlace en una molécula con un número impar de electrones como el NO e incluso predecir algo sobre su química.


