26.7: La ecuación de van 't Hoff
- Page ID
- 79537
Podemos usar Gibbs-Helmholtz para obtener la dependencia de la temperatura de\(K\)
\[ \left( \dfrac{∂[ΔG^o/T]}{∂T} \right)_P = \dfrac{-ΔH^o}{T^2} \nonumber \]
En equilibrio, podemos equipararnos\(ΔG^o\) a\(-RT\ln K\) así obtenemos:
\[ \left( \dfrac{∂[\ln K]}{∂T} \right)_P = \dfrac{ΔH^o}{RT^2} \nonumber \]
Vemos que si\(K\) aumenta o disminuye con la temperatura está ligado a si la entalpía de reacción es positiva o negativa. Si la temperatura se cambia lo suficiente como para que\(ΔH^o\) pueda considerarse constante, podemos traducir un\(K\) valor a una temperatura en otra integrando la expresión anterior, obtenemos una derivación similar a la de la depresión del punto de fusión:
\[\ln \dfrac{K(T_2)}{K(T_1)} = \dfrac{-ΔH^o}{R} \left( \dfrac{1}{T_2} - \dfrac{1}{T_1} \right) \nonumber \]
Si se requiere más precisión podríamos corregir los cambios de temperatura\(ΔH^o\) mediante el uso de datos de capacidad calorífica.
La forma en que\(K\) aumenta o disminuye con la temperatura está ligada a si la entalpía de reacción es positiva o negativa.
La expresión for\(K\) es una función bastante sensible de la temperatura dada su dependencia exponencial de la diferencia de coeficientes estequiométricos Una forma de ver la sensible dependencia de temperatura de las constantes de equilibrio es recordar que
\[K=e^{−\Delta_r{G^o}/RT}\label{18} \]
Sin embargo, ya que bajo presión y temperatura constantes
\[\Delta{G^o}= \Delta{H^o}−T\Delta{S^o} \nonumber \]
La ecuación\(\ref{18}\) se convierte
\[ K=e^{-\Delta{H^o}/RT} e^{\Delta {S^o}/R}\label{19} \]
Tomando el tronco natural de ambos lados, obtenemos una relación lineal entre\(\ln K \) las entalpías y entropías estándar:
\[\ln K = - \dfrac{\Delta {H^o}}{R} \dfrac{1}{T} + \dfrac{\Delta{S^o}}{R}\label{20} \]
que se conoce como la ecuación de van 't Hoff. Se muestra que una gráfica de\(\ln K\) vs.\(1/T\) debe ser una línea con pendiente\(-\Delta_r{H^o}/R\) e intercepción\(\Delta_r{S^o}/R\).
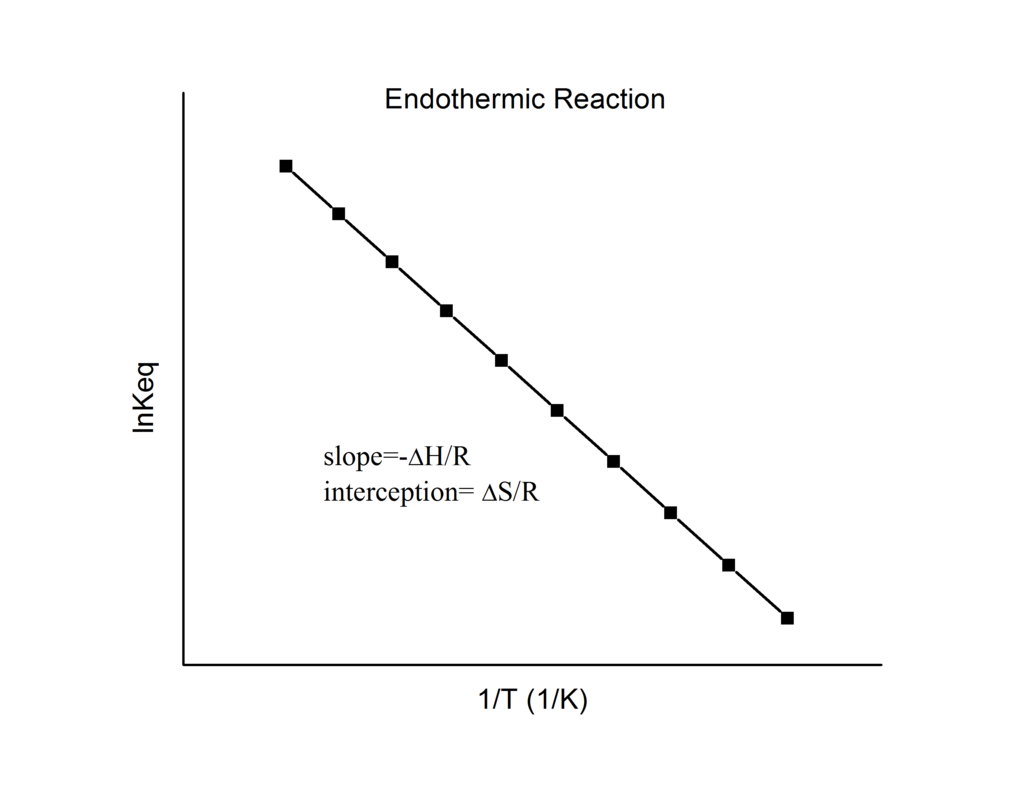
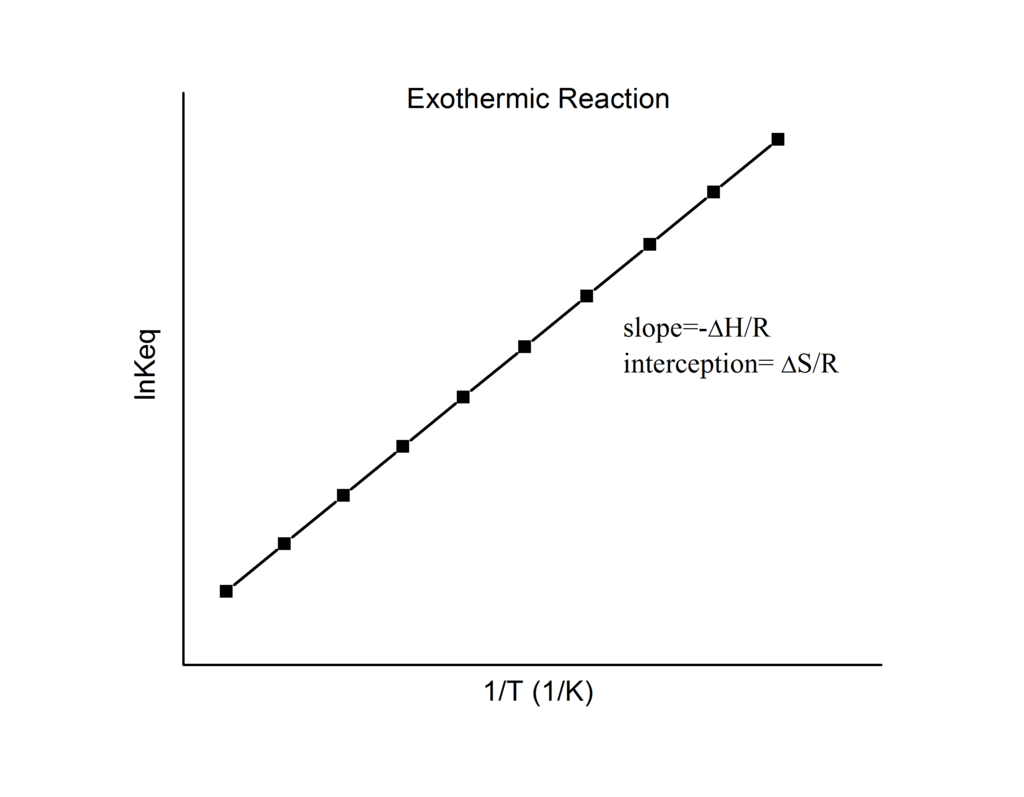
De ahí que estas cantidades se puedan determinar a partir de los\(1/T\) datos\(\ln K\) vs. sin hacer calorimetría. Por supuesto, la suposición principal aquí es esa\(\Delta_r{H^o}\) y sólo\(\Delta_r{S^o}\) dependen muy débilmente de\(T\), lo que suele ser válido.


