7.1: La base molecular para entender el cambio simple de entropía
- Page ID
- 75434
Cuantización de la energía de movimiento de las moléculas
Al principio de su discusión sobre la teoría cinético-molecular, la mayoría de los textos de química general tienen una figura de la distribución mucho mayor de las velocidades moleculares a temperaturas más altas en gases que a temperaturas moderadas.
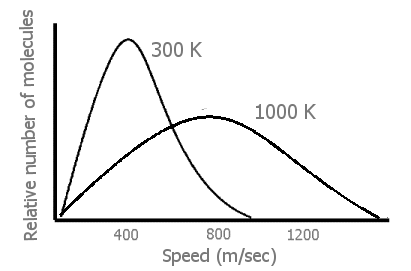
Cuando se eleva la temperatura de un gas (por transferencia de energía desde los alrededores del sistema), se produce un gran aumento en la velocidad,\(v\), de muchas de las moléculas de gas (Figura\(\PageIndex{1}\)). A partir de 1/2mv 2, esto significa que también ha habido un gran aumento en las energías traslacionales de esas moléculas que se mueven más rápido. Finalmente, podemos ver que una entrada de energía no solo hace que las moléculas de gas en el sistema se muevan más rápido, sino que también se muevan a muy muchas velocidades rápidas diferentes. (Por lo tanto, la energía en un sistema calentado es más dispersa, dispersada al estar en muchas velocidades separadas en lugar de más localizada en velocidades menos moderadas).
Una indicación simbólica de las diferentes distribuciones de la energía traslacional de cada molécula de un gas en niveles de energía bajos a altos en un sistema de 36 moléculas se encuentra en la Figura\(\PageIndex{2}\), con el gas de menor temperatura como Figura\(\PageIndex{2A}\) y el gas de mayor temperatura como Figura\(\PageIndex{2B}\).
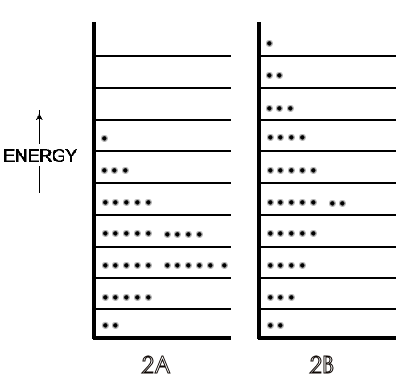
Estas y posteriores Figuras de esta sección son simbólicas porque, en la actualidad, este pequeño número de moléculas no es suficiente para exhibir temperatura termodinámica. Para una mayor simplificación, las energías rotacionales que van desde cero en las moléculas monatómicas hasta aproximadamente la mitad de la energía de traducción total de las moléculas di- y tri-atómicas (y más para la mayoría de las poliatómicas) a 300 K no se muestran en las Figuras. Si se incluyeran esas energías rotacionales, constituirían un conjunto de niveles de energía (correspondientes a un espaciamiento de ~10-23 J) cada uno con distribuciones de energía traslacional de las 36 moléculas (correspondientes a un espaciamiento de ~10-37 J). Estos números muestran por qué los niveles traslacionales, aunque cuantificados, se consideran prácticamente continuos en comparación con la separación de energías rotacionales. Los detalles de los niveles de energía vibracional —dos a temperaturas moderadas (en cuyo estado fundamental serían casi todos los niveles rotacionales y traslacionales poblados por las moléculas de un sistema simbólico o real )— también pueden posponerse hasta la química física. En este punto del curso de primer año, dependiendo de la preferencia del instructor, solo es necesario introducir una descripción verbal de los movimientos rotacionales y vibracionales y el espaciamiento de los niveles de energía.
Para cuando en el curso inicial los estudiantes lleguen a la termodinámica, cinco a quince capítulos después de la teoría cinética, pueden aceptar el concepto de que las energías mocionales totales de las moléculas incluyen no solo los movimientos traslacionales sino también los movimientos rotacionales y vibracionales (que se pueden esbozar simplemente a continuación).
Un microestado es una de las muchas disposiciones de las energías moleculares (es decir, 'las moléculas en cada nivel de energía particular') para la energía total de un sistema. Así, la Figura\(\PageIndex{2A}\) es un microestado para un sistema con una energía dada y la Figura\(\PageIndex{1B}\) es un microestado del mismo sistema pero con una mayor energía total. La figura\(\PageIndex{3A}\) (solo una repetición de la figura\(\PageIndex{2A}\), por conveniencia) es un microestado diferente al microestado para el mismo sistema mostrado en la figura\(\PageIndex{3B}\); la energía total es la misma en\(\PageIndex{3A}\) y\(\PageIndex{3B}\), pero en\(\PageIndex{3B}\) la figura se ha cambiado la disposición de las energías porque dos las moléculas han cambiado sus niveles de energía, como lo indican las flechas.
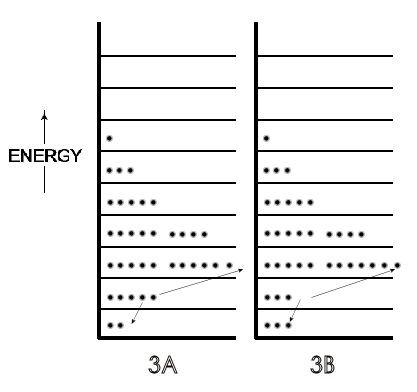
Un posible escenario para ese microestado diferente en la Figura\(\PageIndex{3}\) es que estas dos moléculas en el segundo nivel de energía colisionaron en un ángulo de visión tal que una ganó suficiente energía para estar en el tercer nivel de energía, mientras que la otra molécula perdió la misma cantidad de energía y cayó al nivel más bajo nivel de energía. A la luz de ese resultado de una sola colisión y los miles de millones de colisiones de moléculas por segundo en cualquier sistema a temperatura ambiente, puede haber un número muy grande de microestados incluso para este sistema de tan solo 36 moléculas en Figuras\(\PageIndex{2}\) y\(\PageIndex{3}\). (Esto es cierto a pesar de que no todas las colisiones cambiarían la energía de las dos moléculas involucradas, y así no cambiarían los números en un nivel de energía dado. Las colisiones de mirada podrían ocurrir sin ningún cambio en la energía de ninguno de los participantes.) Para cualquier sistema real que involucre 6 x 10 23 moléculas, sin embargo, el número de microestados se vuelve humanamente incomprensible para cualquier sistema, aunque podamos expresarlo en números, como se desarrollará ahora.
El cambio cuantitativo de entropía en un proceso reversible viene dado por
\[ΔS = \dfrac{q_{rev}}{T}\]
(Los procesos irreversibles que implican cambio de temperatura o volumen o mezcla pueden tratarse mediante cálculos a partir de pasos incrementales que son reversibles). Según la relación de entropía de Boltzmann,
\[ΔS = k \ln \dfrac{W_{Final}}{W_{Initial}}\]
donde\(k\) es la constante de Boltzmann\(W_{Final}\) y/o\(W_{Initial}\) es el recuento de cuántos microestados corresponden a los macroestados Final o Inicial, respectivamente.
El número de microestados para un sistema determina el número de formas en cualquiera de las cuales la energía total de un macroestado puede ser en un instante. Así, un incremento en la entropía significa un mayor número de microestados para el estado Final que para el Inicial. A su vez, esto significa que hay más opciones para la disposición de la energía total de un sistema en cualquier instante, mucho menos posibilidad de localización (como ciclar de ida y vuelta entre solo 2 microestados), es decir, una mayor dispersión de la energía total de un sistema debido a tantas posibilidades.
Un incremento en la entropía significa un mayor número de microestados para el estado Final que para el Inicial. A su vez, esto significa que hay más opciones para la disposición de la energía total de un sistema en cualquier instante.
Deslocalización vs. Dispersión
Algunos instructores pueden preferir la “deslocalización” para describir el estado de la energía total de un sistema cuando hay un mayor número de microestados en lugar de menos, como sinónimo exacto de “dispersión” de energía como se usa aquí en este artículo para otras situaciones de termodinámica química. La ventaja del uso uniforme de la 'dispersión' es su correcta aplicabilidad de significado común a ejemplos que van desde la energía móvil que se extiende literalmente en un volumen mayor hasta los casos de transferencia de energía térmica de entornos calientes a un sistema más frío, así como a distribuciones de energías moleculares en niveles de energía para cualquiera de esos casos generales. Los estudiantes de menor capacidad deben ser capaces de comprender lo que significa 'dispersión' en tres dimensiones, aunque los siguientes pasos de abstracción a lo que significa en niveles de energía y números de microestados pueden resultar en más un 'sentimiento' que una preparación para la química física que puede ser para los más capaces.
Por supuesto, la dispersión de la energía de un sistema en términos de microestados no significa que la energía se unte o se extienda sobre microestados como la mantequilla de maní en el pan! Toda la energía del macroestado está siempre en un solo microestado al instante. Es la posibilidad de que la energía total del macroestado pueda estar en cualquiera de tantas disposiciones más diferentes de esa energía en el siguiente instante —una mayor probabilidad de que no pueda localizarse volviendo al mismo microestado— lo que equivale a una mayor dispersión o esparcirse fuera de la energía cuando hay un mayor número de microestados
(Los números de microestados para sistemas químicos superiores a 0 K son asombrosos. Para cualquier sustancia a una temperatura aproximada de 1-4 K, existen 10 26,000,000,000,000,000,000 microestados (5). Para un mol de agua a 273.15 K, hay 10 2,000,000,000,000,000,000,000 microestados y cuando se calienta para estar apenas un grado más caliente, ese número se incrementa 10 22 veces a 10 2,010,000,000,000,000,000,000,000 microestados. A modo de comparación, una estimación del número de átomos en todo el universo es 'solo' alrededor de 10 70, mientras que un googol, considerado un gran número en matemáticas, es `solo' 10 100.)
Resumiendo, cuando una sustancia se calienta, su entropía aumenta debido a que la energía adquirida y que anteriormente dentro de ella puede dispersarse mucho más en los niveles de energía superiores anteriores y en esos niveles de energía altos adicionales que ahora se pueden ocupar. Esto a su vez significa que hay muchas más disposiciones posibles de las energías moleculares en sus niveles de energía que antes y así, hay un gran aumento de microestados accesibles para el sistema a temperaturas más altas. Una declaración concisa sería que cuando se calienta un sistema, hay muchos más microestados accesibles y esto equivale a una mayor deslocalización o dispersión de su energía total. (El comentario común “el calentamiento causa o favorece el trastorno molecular” es un etiquetado antropomórfico del comportamiento molecular que tiene más defectos que utilidad. Existe un caos virtual, en lo que respecta a la distribución de energía para un sistema (su número de microestados), tanto antes como después del calentamiento a cualquier temperatura superior a 0 K y la distribución de energía está en el corazón del significado de entropía y cambio de entropía.) (5).

