19.1: Cómo el cambio de entalpía para una reacción depende de la temperatura
- Page ID
- 75407
Anteriormente, vimos cómo usar entalpías de formación tabuladas para calcular el cambio de entalpía para una reacción química particular. Dichas tablas suelen dar entalpías de formación a varias temperaturas diferentes, de manera que el cambio de entalpía para una reacción dada también se puede calcular a estas diferentes temperaturas; es solo cuestión de repetir el mismo cálculo a cada temperatura.
A menudo necesitamos encontrar el cambio de entalpía asociado con el aumento de la temperatura de una sustancia a presión constante. Este cambio de entalpía se calcula fácilmente integrando la capacidad calorífica sobre el cambio de temperatura. Es posible que queramos conocer, por ejemplo, el cambio de entalpía para aumentar la temperatura de un mol de metano de 300 K a 400 K, manteniéndose la presión constante a una barra. De la mesa, encontramos
\[ \Delta_fH^o\left(CH_4 ,g,300\, K\right) =-74.656\ \mathrm{k}\mathrm{J}\ \mathrm{mol}^{-1}\]
\[ \Delta_fH^o\left(CH_4\mathrm{,g,400\ K}\right) = -77.703\ \mathrm{k}\mathrm{J}\ \mathrm{mol}^{-1} \]
Podríamos tener la tentación de pensar que la diferencia representa el cambio de entalpía asociado con el calentamiento del metano. ¡Esto no es así! La razón se hace evidente de inmediato si consideramos un ciclo en el que pasamos de los elementos a un compuesto a dos temperaturas distintas. Para el metano, este ciclo se muestra en la Figura\(\PageIndex{1}\).
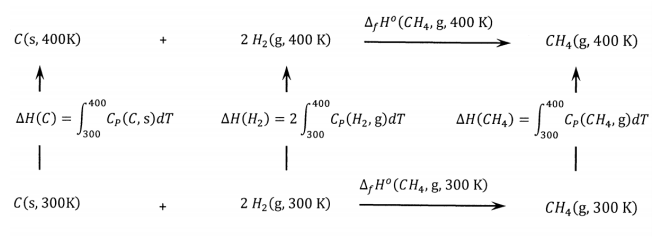
Figura\(\PageIndex{1}\): Un ciclo termoquímico que se relaciona\(\Delta_fH^o (CH_4)\) a dos temperaturas.
La diferencia entre las entalpías estándar de formación de metano a 300 K y 400 K refleja el cambio de entalpía para incrementar las temperaturas de todos los reactivos y productos de 300 K a 400 K. Es decir,
\[\Delta_fH^o\left(CH_4\mathrm{,g,400\ K}\right)-\Delta_fH^o\left(CH_4\mathrm{,g,300\ K}\right)\]\[=\int^{400}_{300}{C_P\left(CH_4\mathrm{,g}\right)dT}-\int^{400}_{300}{C_P\left(C\mathrm{,s}\right)dT} -2\int^{400}_{300}{C_P\left(H_2\mathrm{,g}\right)dT}\]
En el rango de temperatura de 300 K a 400 K, las capacidades térmicas del carbono, hidrógeno y metano se aproximan por\(C_P=a+bT\), con valores de\(a\) y\(b\) dados en el Cuadro 1. A partir de esta información, se calcula el cambio de entalpía para incrementar la temperatura de un mol de cada sustancia de 300 K a 400 K a 1 bar:\(\Delta H\left(C\right)=1,029\ \mathrm{J}\ {\mathrm{mol}}^{-1}\),\(\Delta H\left(H_2\right)=2,902\ \mathrm{J}\ {\mathrm{mol}}^{-1}\), y\(\Delta H\left(CH_4\right)=3,819\ \mathrm{J}\ {\mathrm{mol}}^{-1}\). Así, a partir del ciclo, calculamos:
\[\Delta_fH^o\left(CH_4\mathrm{,g,400\ K}\right)=-74,656+3,819-1,029-2\left(2,902\right)\ \mathrm{J}\ {\mathrm{mol}}^{-1}=\ -77,670\ \mathrm{J}\ {\mathrm{mol}}^{-1}\]
El valor tabulado es\(-77,703\ \mathrm{J}\ {\mathrm{mol}}^{-1}\). Los dos valores difieren en\(33\ \mathrm{J}\ {\mathrm{mol}}^{-1}\), o alrededor de 0.04%. Esta diferencia surge de las limitaciones de las ecuaciones de capacidad calorífica de dos parámetros.
Como otro ejemplo de ciclo termoquímico, consideremos la oxidación selectiva de metano a metanol a 300 K y 400 K. A partir de las entalpías de formación en el Cuadro 1, calculamos las entalpías para que la reacción sea\(\Delta_rH^o\left(3\mathrm{00\ K}\right)=-126.412\ \mathrm{k}\mathrm{J}\ {\mathrm{mol}}^{-1}\) y\(\Delta_rH^o\left(4\mathrm{00\ K}\right)=-126.919\ \mathrm{k}\mathrm{J}\ {\mathrm{mol}}^{-1}\). Al igual que en el ejemplo anterior, utilizamos los parámetros tabulados de capacidad calorífica para calcular el cambio de entalpía para incrementar la temperatura de un mol de cada uno de estos gases de 300 K a 400 K a 1 bar. Encontramos:\(\Delta H\left(CH_3OH\right)=4,797\ \mathrm{J}\ {\mathrm{mol}}^{-1}\),\(\Delta H\left(CH_4\right)=3,819\ \mathrm{J}\ {\mathrm{mol}}^{-1}\), y\(\Delta H\left(O_2\right)=2,975\ \mathrm{J}\ {\mathrm{mol}}^{-1}\).
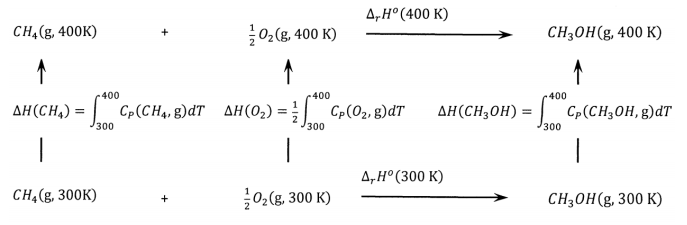
Figura\(\PageIndex{2}\): Un ciclo termoquímico que se relaciona\(\Delta_rH^o\) a dos temperaturas.
El ciclo se muestra en\(\PageIndex{2}\). Inspeccionando este ciclo, vemos que podemos calcular el cambio de entalpía para calentar un mol de metanol de 300 K a 400 K sumando los cambios de entalpía alrededor de la parte inferior, el lado izquierdo y la parte superior del ciclo; es decir,
\[\Delta H\left(CH_3OH\right)=126,412+3,819+\left(\frac{1}{2}\right)2,975-126,919\ \mathrm{J}\ {\mathrm{mol}}^{-1}=4,800\ \mathrm{J}\ {\mathrm{mol}}^{-1}\]
Esto es 3 J o aproximadamente 0.06% mayor que el valor obtenido\(\left(4,797\ \mathrm{J}\right)\) al integrar la capacidad calorífica para metanol.


