27.1: Sistemas Sólido-Líquido - Puntos Eutécticos
- Page ID
- 75539
En la Figura se muestra un diagrama de fases para dos sólidos inmiscibles y la fase líquida (que es miscible en todas las proporciones)\(\PageIndex{1}\). El punto etiquetado “e 2” es el punto eutéctico, es decir, la composición para la que la mezcla de los dos sólidos tiene el punto de fusión más bajo. Las cuatro regiones principales se pueden describir de la siguiente manera:
- Sólido bifásico
- Sólido (principalmente A) y líquido (A y B)
- Sólido (principalmente B) y líquido (A y B)
- Líquido monofásico (A y B)
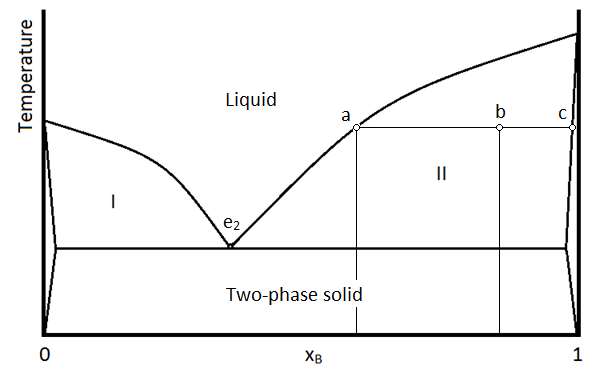
Las regiones no marcadas en los lados del diagrama indican regiones donde un sólido es tan miscible en el otro, que solo se forma un sólido monofásico. Esto es diferente a la región “sólida bifásica” donde hay dos fases distintas, lo que significa que hay regiones (tal vez cristales) que son claramente A o B, a pesar de que están entremezcladas dentro sobre otra. La región I contiene dos fases: una fase sólida que es principalmente el compuesto A, y una fase líquida que contiene tanto A como B. Una muestra en la región II (tal como la combinación temperatura/composición representada por el punto b) constará de dos fases: 1 es una mezcla líquida de A y B con una composición dada por la del punto a, y el otro es un sólido monofásico que en su mayoría es el compuesto B puro, pero con trazas de A arrastradas dentro de él. Como siempre, la regla de la palanca se aplica en la determinación de las cantidades relativas de material en las dos fases.
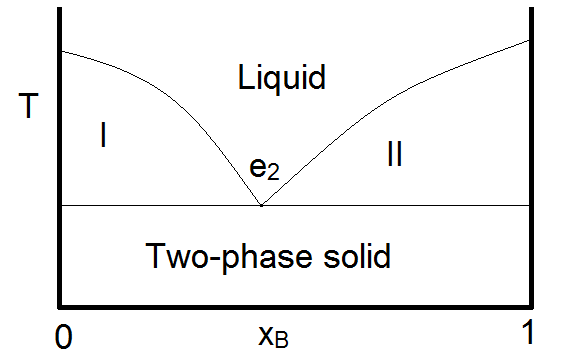
En el caso de que los anchos de las regiones pequeñas a ambos lados del diagrama de fases sean insignificantemente pequeños, se\(\PageIndex{2}\) puede utilizar un diagrama simplificado con una forma similar a la que se muestra en la Figura. En este caso, ¡se supone que los sólidos nunca forman una sola fase! El sistema estaño-plomo exhibe tal comportamiento.
Otro caso importante es aquel para el cual los dos compuestos A y B pueden reaccionar para formar un tercer compuesto químico C. Si el compuesto C es estable en la fase líquida (no se descompone al fundirse), el diagrama de fases se verá como Figura\(\PageIndex{3}\).
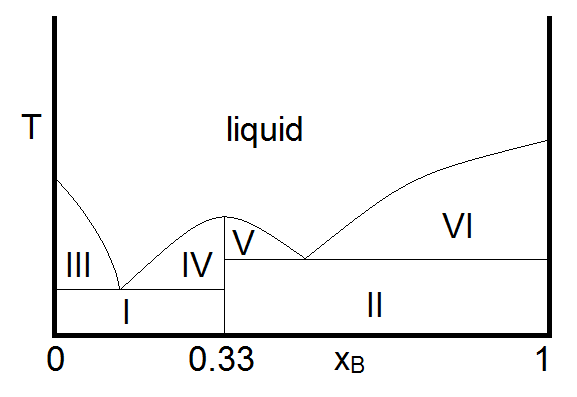
En este diagrama, el límite vertical en\(X_B = 0.33\) es indicativo del compuesto\(C\) formado por\(A\) y\(B\). A partir de la fracción molar de\(B\), es evidente que la fórmula del compuesto\(C\) es\(A_2B\). La reacción que forma el compuesto C es
\[2 A + B \rightarrow C\]
Así, en las composiciones globales donde\(X_B < 0.33\), hay exceso de compuesto A (B es el reactivo limitante) y para\(X_B \) hay un exceso de compuesto\(B\) (ahora\(A\) es el reactivo limitante). Con esto en mente, la composición de la muestra en cada región puede resumirse como
- Sólido bifásico (A y C)
- Sólido bifásico (C y B)
- Sólido A y líquido (A y C)
- Sólido C y líquido (A y C)
- Sólido C y líquido (C y B)
- Sólido B y líquido (C y B)
- líquido. Líquido monofásico (A y C o C y B, dependiendo de cuál esté presente en exceso)
El Zinc y el Magnesio son un ejemplo de dos compuestos que demuestran este tipo de comportamiento, teniendo el tercer compuesto la fórmula\(Zn_2Mg\) (Ghosh, Mezbahul-Islam, & Medraj, 2011).
Fusión incongruente
A menudo, el compuesto estable formado por dos sólidos solo es estable en la fase sólida. En otras palabras, se descompondrá al fundirse. Como resultado, el diagrama de fases tomará una forma ligeramente diferente, como se muestra en la Figura\(\PageIndex{4}\).
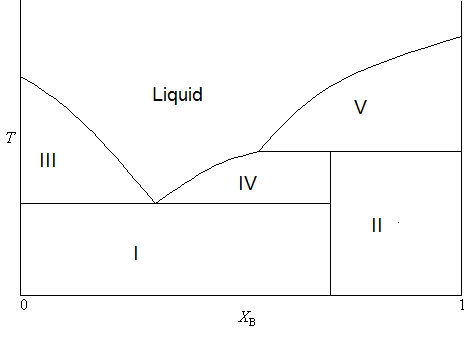
En este diagrama, la fórmula del compuesto estable es\(AB_3\) (consistente con\(X_B < 0.75\)). Pero notará que el límite que separa las dos regiones sólidas bifásicas no se extiende hasta la porción líquida monofásica del diagrama. Esto se debe a que el compuesto se descompondrá al fundirse. El proceso de descomposición al fundir también se llama fusión incongruente. La composición de cada región puede resumirse como
- Sólido bifásico (A y C)
- Sólido bifásico (C y B)
- Sólido A y líquido (A y B)
- Sólido C y líquido (A y B)
- Sólido B y líquido (A y B)
Existen muchos ejemplos de pares de compuestos que muestran este tipo de comportamiento. Una combinación es el sodio y el potasio, que forman un compuesto (\(Na_2K\)) que es inestable en la fase líquida y así se funde incongruentemente (Rossen & Blefwijk, 1912).
Colaboradores
Patrick E. Fleming (Department of Chemistry and Biochemistry; California State University, East Bay)


