1.7: Átomos- Soluciones a problemas seleccionados
- Page ID
- 80676
Ejercicio 1.1.3
- un átomo de mercurio con un átomo de oxígeno.
- dos átomos de mercurio con un átomo de oxígeno.
- 200 amu (Hg) + 16 amu (O) = 216 amu (HGo)
- 2 x 200 amu (Hg) + 16 amu (O) = 416 amu (HGo)
Ejercicio 1.1.4
- 200 g (Hg) + 16 g (O) = 216 g (HGo)
- 2 x 200 g (Hg) + 16 g (O) = 416 g (Hg 2 O)
- Si un mol es 216 g de HGo, entonces 0.25 mol debe ser un cuarto de esa cantidad, o 54 g.
\[ 0.25 mol \times 216 \frac{g}{mol} = 54 g \nonumber\]
Alternativamente escrito como
\[ 0.25 mol \times 216 g \: mol^{-1} = 54 g \nonumber\]
La cantidad de mercurio es apenas una fracción de eso: 200/216. Entonces la respuesta es\(\frac{200}{216} \times 54 g = 50 g\).
d) ¿Qué fracción de un mol es 2.08 g de Hg 2 O, si un mol es 416 g?
\[ \frac{2.08g}{416 g \: mol^{-1}} = 0.005 mol \nonumber\]
Observe que cuando dividimos g por g mol -1, los gramos cancelan y el mol -1 se convierte en mol.
Hay 1 mol de O en 1 mol de HgO, por lo que se necesitan 0.005 moles de O para 0.005 mol de HgO.
\(0.005 mol \times 16 g \: mol^{-1} = 0.08 g\)O necesario
Ejercicio 1.1.6
a) azufre b) silicio c) calcio d) potasio y litio
e) fósforo f) yodo g) plata y cobre h) rutenio
Ejercicio 1.1.7
a) 20 b) Na c) 16.00 d) fósforo
e) carbono f) Sn g) 32.07 h) potasio
Ejercicio 1.1.8
a) Ne: 20 g/mol b) Fe: 56 g/mol c) Cu: 64 g/mol d) Au: 197 g/mol e) Si: 28 g/mol
Ejercicio 1.1.9
- H 2 O:\(18 \frac{g}{mol} (2 \times H + 1 \times O = 2 \times 1 + 1 \times 16 \frac{g}{mol})\)
- NaHCO 3:\(84 \frac{g}{mol} (3 \times O + 1 \times Na + 1 \times H + 1 \times C = 3 \times 16 + 1 \times 23 + 1 \times 1 + 1 \times 12 \frac{g}{mol})\)
- SiO 2:\(60 \frac{g}{mol} (1 \times Si + 2 \times O = 1 \times 28 + 2 \times 16 \frac{g}{mol})\)
- NaCl:\(58 \frac{g}{mol} (1 \times Na + 1 \times Cl = 1 \times 23 + 1 \times 35 \frac{g}{mol})\)
- TaN:\(195 \frac{g}{mol} (1 \times Ta + 1 \times N = 1 \times 181 + 1 \times 14 \frac{g}{mol})\)
- NH 3:\(17 \frac{g}{mol} (1 \times N + 3 \times H = 1 \times 14 + 3 \times 1 \frac{g}{mol})\)
- NaH 2 PO 4:\(120 \frac{g}{mol} (1 \times Na + 2 \times H + 1 \times P = 4 \times O = 1 \times 23 + 2 \times 1 + 1 \times 31 + 4 \times 16 \frac{g}{mol})\)
- CH 3 CO 2 H:\(60 \frac{g}{mol} (2 \times C + 4 \times H + 2 \times O = 2 \times 12 + 4 \times 1 + 2 \times 16 \frac{g}{mol})\)
El peso molar del átomo se redondeó al gramo más cercano. Para tener mucho cuidado y evitar la “propagación de errores”, se podría utilizar el peso molar más exacto (a varios decimales) y se podría realizar el redondeo después del cálculo. En estos casos, el resultado sería el mismo. El resultado podría ser diferente si se encontraran números muy grandes de átomos en el compuesto.
Ejercicio 1.2.1
a) O: 8 protones, 8 electrones, 8 neutrones
El átomo es neutro en general, por lo que el número de protones cargados positivamente es igual al número de electrones cargados negativamente. El peso atómico es proporcionado casi en su totalidad por los protones y neutrones, por lo que el número de protones más el número de neutrones es igual al peso atómico.
b) P: 15 protones, 15 electrones, 16 neutrones
c) Zn: 30 protones, 30 electrones, 35 neutrones
d) Au: 79 protones, 79 electrones, 118 neutrones
Ejercicio 1.2.3
Carbono:\(\frac{(99 \times 12amu) + (1 \times 13 amu)}{100} = \frac{1188 + 13amu}{100} = \frac{1201amu}{100} = 12.01 amu\)
Ejercicio 1.2.4
La salida del electrón cargado negativamente del núcleo deja atrás una carga positiva. Un neutrón se convierte en un protón. El peso atómico global sigue siendo el mismo, pero el átomo termina con un protón más y un electrón más. Un 14 C se convierte en un 14 N.
Ejercicio 1.2.6
Supongamos que y es la fracción decimal de 35 Cl y z es la fracción decimal de 37 Cl.
\(35.5 amu = \frac{(y \times 35 amu + z \times 37 amu)}{100}\)pero y + z = 1
\[35.5 amu = (y \times 35 amu + (1-y) \times 37 amu) \nonumber\]
\[35.5 amu = y \times 35 amu - y \times 37 amu + 37 amu \nonumber\]
\[(37-35) \times y amu = 37 amu - 35.5 amu \nonumber\]
\[2 \times y amu = 1.5 amu \nonumber\]
\[y = 0.75 (75 \% ^{35}Cl) \nonumber\]
\[z = 0.25 (25 \% ^{37}Cl \nonumber\]
Ejercicio 1.2.7
- 1, 2, 3, 4, 5... una serie de números enteros, o n.
- 2, 4, 6, 8, 10... una serie de números pares, o 2n (porque cada número par es dos veces otro número).
- 3, 5, 7, 9, 11... una serie de números impares, o 2n + 1 (porque cada número impar es uno más que algún número par).
- 1, 4, 9, 16, 25... una serie de cuadrados, o n 2.
- 2, 4, 8, 16, 32... una serie en la que cada número es el doble del último número, o 2 n.
- 1, 1/2, 1/4, 1/9, 1/16... una serie de recíprocos de cuadrados, o 1/n 2.
Ejercicio 1.2.8
- Cuando q aumenta, F aumenta. El incremento es lineal: si q 1 dobla, F duplica. A medida que la carga en el núcleo se hace más grande, la fuerza de atracción se hace más grande.
- Cuando r aumenta, F disminuye. La disminución es no lineal: si r se duplica, F cae en un factor de cuatro, en lugar de un factor de dos. A medida que la distancia desde el núcleo se alarga, la atracción hacia el núcleo disminuye bruscamente.
- El hidrógeno y el helio están ambos en la primera fila de la tabla periódica. A una aproximación aproximada, la distancia entre núcleo y electrón es similar en estos dos átomos. Sin embargo, el helio tiene una carga de 2+ en sus núcleos, en comparación con la carga 1+ en el núcleo de un átomo de hidrógeno. En consecuencia, la atracción de un electrón sobre el helio hacia el núcleo sería aproximadamente el doble de grande que la atracción de un electrón sobre el hidrógeno hacia su núcleo.
Los electrones del helio están mucho más apretados que los de hidrógeno.
La situación es realmente mucho más complicada que eso. Por ejemplo, si los electrones del helio son más fuertemente atraídos hacia el núcleo que los del hidrógeno, entonces los electrones del helio deberían ser atraídos más cerca del núcleo que los del hidrógeno. Eso significa que los electrones del helio se mantienen aún más apretados de lo que pensábamos al principio.
Otro factor que complica es que el helio tiene dos electrones, mientras que el hidrógeno solo tiene uno. Un electrón puede ser atraído hacia el núcleo, pero los electrones se repelen entre sí. Ese segundo electrón en el helio debería compensar la atracción adicional hacia el núcleo más positivo del helio. Eso significa que los electrones del helio pueden ser menos atraídos de lo que pensábamos originalmente.
Sin embargo, el efecto del segundo electrón es mucho menor de lo que aparece primero. Eso es porque el segundo electrón podría estar en cualquier parte alrededor del átomo de helio. Tiene un 50% de probabilidad de estar más lejos del primer electrón que ese núcleo cargado positivamente. Cuanto más lejos está, menor es su influencia. Los electrones del helio son definitivamente más fuertemente atraídos por el núcleo que los del hidrógeno, pero es difícil decir exactamente cuánto más sin la ayuda de algunas herramientas más sofisticadas.
Ejercicio 1.2.9
- Cuando la longitud de onda se alarga (el valor de λ aumenta), la energía disminuye.
- A medida que la frecuencia aumenta (el valor de ν aumenta), la energía aumenta.
Ejercicio 1.2.10
| Símbolo de elemento | Número atómico | Número Masivo | Número de protones | Número de Neutrones | Número de electrones | Cargar |
|---|---|---|---|---|---|---|
| H | 1 | 1 | 1 | 0 | 1 | 0 |
| H | 1 | 1 | 1 | 0 | 0 | +1 |
| H | 1 | 1 | 1 | 0 | 2 | -1 |
| H | 1 | 2 | 1 | 1 | 1 | 0 |
| H | 1 | 3 | 1 | 2 | 1 | 0 |
| Be | 4 | 9 | 4 | 5 | 2 | +2 |
| C | 6 | 12 | 6 | 6 | 6 | 0 |
| Mg | 12 | 25 | 12 | 13 | 12 | 0 |
| Tc | 43 | 98 | 43 | 55 | 43 | 0 |
| Ca | 20 | 40 | 20 | 20 | 18 | +2 |
| Si | 14 | 28 | 14 | 14 | 14 | 0 |
| K | 19 | 47 | 19 | 28 | 15 | +4 |
| Fe | 26 | 56 | 26 | 30 | 23 | +3 |
| Br | 35 | 79 | 35 | 44 | 36 | -1 |
| Ti | 22 | 39 | 22 | 17 | 21 | +1 |
| P | 15 | 30 | 15 | 15 | 15 | 0 |
| Al | 13 | 27 | 13 | 14 | 10 | +3 |
| S | 16 | 32 | 16 | 16 | 16 | 0 |
| Pd | 46 | 106 | 46 | 60 | 45 | +1 |
| Cr | 24 | 52 | 24 | 28 | 21 | +3 |
| Sn | 50 | 118 | 50 | 68 | 50 | 0 |
| Hg | 80 | 200 | 80 | 120 | 79 | +1 |
| Au | 79 | 197 | 79 | 118 | 78 | +1 |
Ejercicio 1.3.1
- La energía del electrón se hace mayor.
- La energía del electrón disminuye.
- La longitud de onda se acorta.
- La longitud de onda se alarga.
Ejercicio 1.3.2
La probabilidad de encontrar un electrón en un nodo es cero.
Ejercicio 1.3.3
Tu dibujo es hermoso. Deberías ponértelo en tu refrigerador, o bien envíaselo a tu madre.
Ejercicio 1.4.1
a) 2s b) 3p c) 3d e) 5f e) 4s
Ejercicio 1.4.2
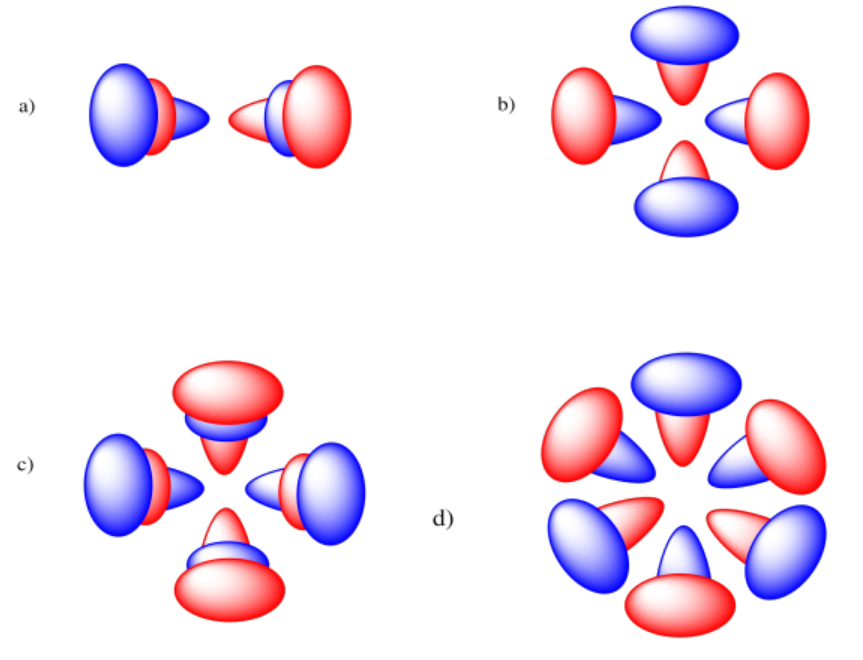
Ejercicio 1.4.3
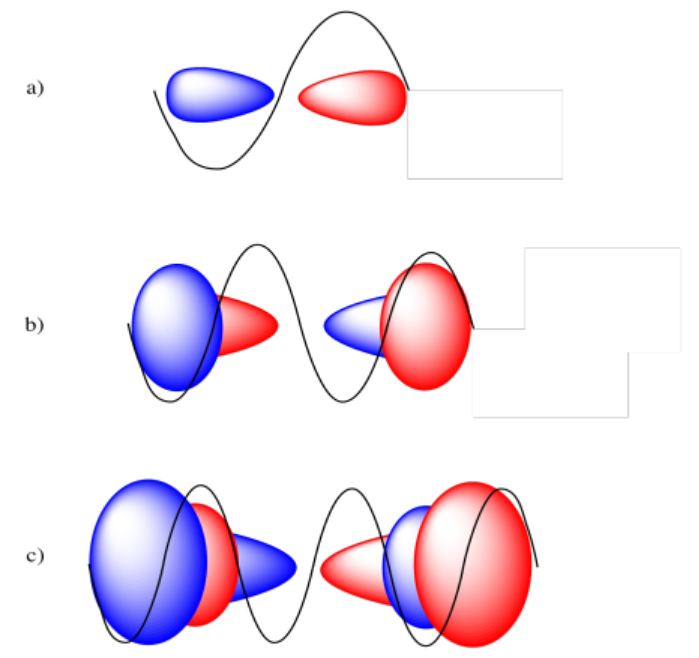
De un extremo de la órbita a otro, el orbital 2p cubre una onda sinusoidal completa, una orbital 3p cubre dos ondas sinusoidales completas y una orbital 4p cubre tres ondas sinusoidales completas.
Ejercicio 1.5.1
- O: 1s 2 2s 2 2p x 2 2p y 1 2p z 1
- S: 1s 2 2s 2 2p 6 3s 2 3p x 2 3p x 2 3p y 1 3p z 1
- Si: 1s 2 2s 2 2p 6 3s 2 3p x 2 3p x 1 3p y 1
- N: 1s 2 2s 2 2p x 1 2p y 1 2p z 1
- Ar: 1s 2 2s 2 2p 6 3s 2 3p 6
- Ne: 1s 2 2s 2 2p 6
Ejercicio 1.5.2
- Cl: [Ne] 3s 2 3p x 2 3p y 2 3p z 1
- Ca: [Ar] 4s 2
- Al: [Ne] 3s 2 3p x 1
- P: [Ne] 3s 2 3p x 1 3p y 1 3p z 1
Ejercicio 1.5.3
- hierro, Fe: [Ar] 4s 2 3d 6
- níquel, Ni: [Ar] 4s 2 3d 8
- mercurio, Hg: [Xe] 6s 2 4f 14 5d 10
- plomo, Pb: [Xe] 6s 2 4f 14 5d 10 6p 2
- arsénico, As: [Ar] 4s 2 3d 10 4p 3
- titanio, Ti: [Ar] 4s 2 3d 2
Ejercicio 1.5.4
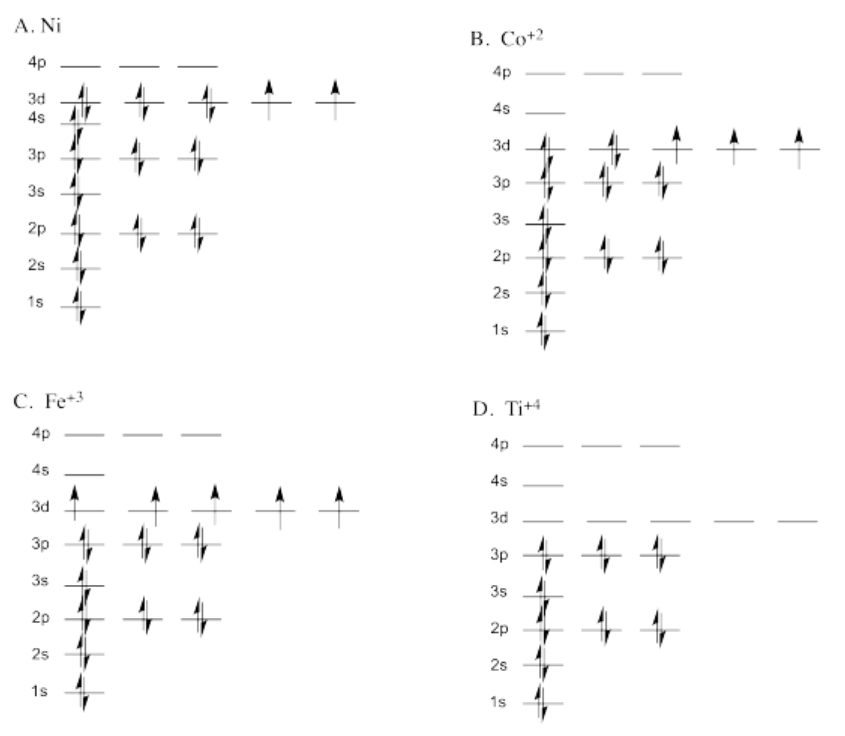
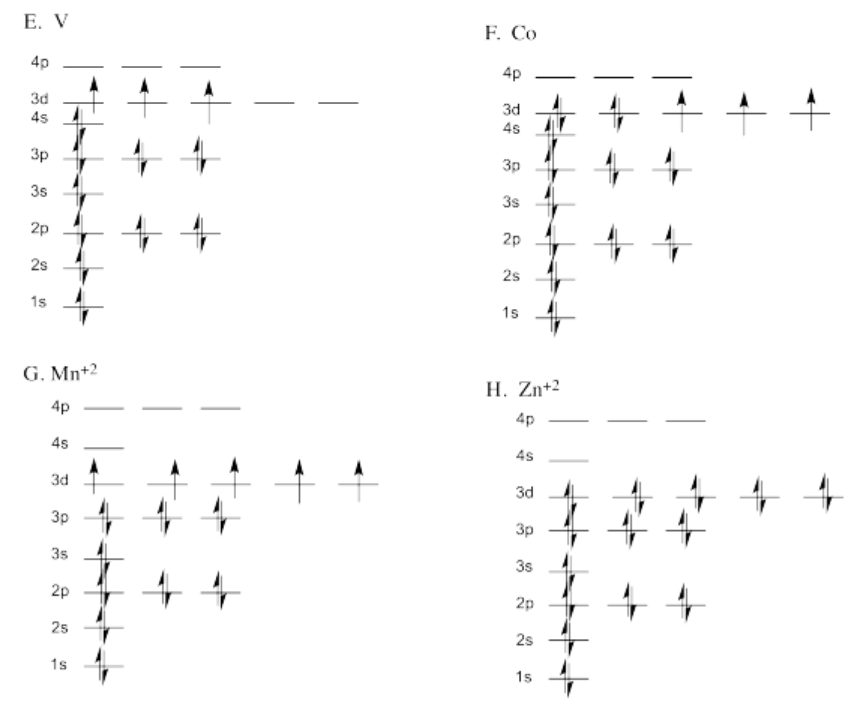
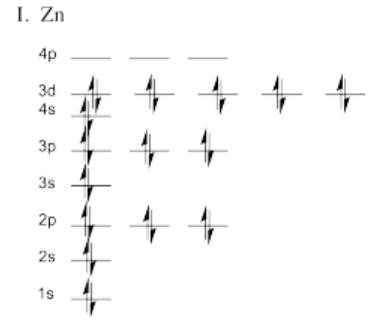
Ejercicio 1.6.1
- Zn: Cd, Hg
- Ca: Mg, Ba
- O: S, Se
- Cl: F, Br
- Cr: Mo, W
Ejercicio 1.6.2
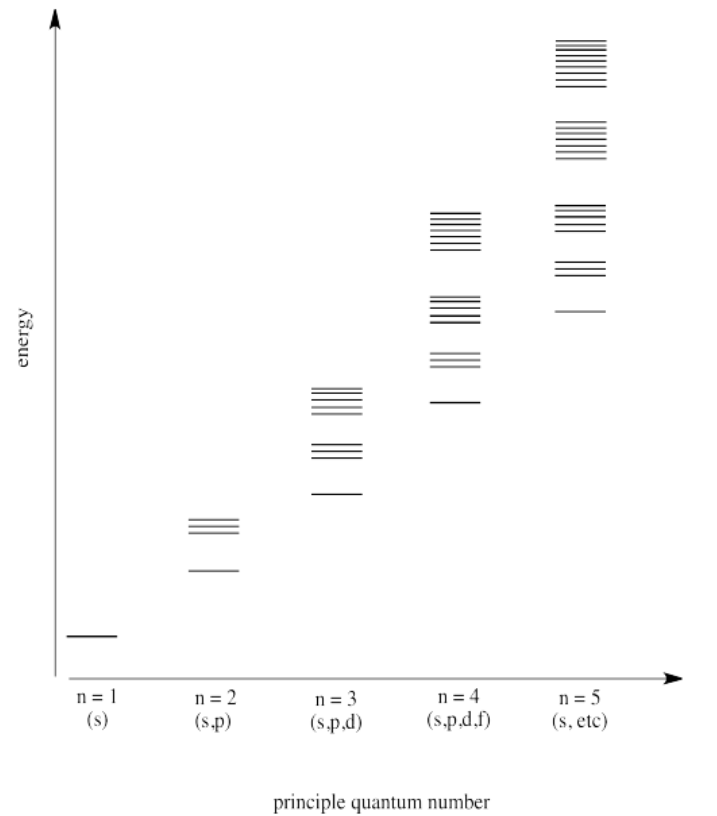
Ejercicio 1.6.3
El número atómico es el número de protones en el núcleo. Para dos átomos en la misma fila de la tabla periódica, los electrones más externos están aproximadamente a la misma distancia del nucelus. Cuantos más protones positivos haya en el núcleo, más fuertemente retenidos están los electrones.
Ejercicio 1.6.4
Tómalo del boro. El átomo de oxígeno sostiene sus electrones con mucha más fuerza.
Ejercicio 1.6.5
Según el dibujo, el neón tomaría el electrón, debido a que de todos los átomos representados en la gráfica, el neón atrae con mayor fuerza a los electrones. Sin embargo, hay una complicación. Aunque el neón atrae fuertemente a sus propios electrones, no puede acomodar un electrón extra tan fácilmente como lo podría hacer el flúor, el siguiente mejor candidato. En términos de “Lewis”, el neón tiene un “octeto completo”. En términos cuánticos, un electrón adicional tendría un número cuántico principal mayor y se colocaría en la siguiente “concha”, más lejos del núcleo. Con el emparejamiento de espinas, el flúor puede aceptar otro electrón en su caparazón de valencia.
Ejercicio 1.6.6
El oxígeno tiraría de los electrones en el enlace más fuertemente hacia sí mismo.
Ejercicio 1.6.7
Pasar de una fila a la siguiente en la tabla periódica significa que el electrón más exterior está en una concha más alejada del núcleo. Esos electrones más externos están menos apretados si están más alejados del núcleo.
Ejercicio 1.6.8
- Cs + F-
- Na + O -
- K + H -
Ejercicio 1.6.9
La atracción por un electrón cae con 1/r 2. A medida que el valor de r se hace cada vez más grande, la cantidad 1/r 2 comenzará a acercarse a un límite (de cero). Como resultado, la diferencia entre dos valores sucesivos de 1/r 2 en una serie se hace cada vez más pequeña.
Ejercicio 1.6.10
- Mg > Ca
- Sn > Pb
- Sb > Ag
- As > Ga
- Cu > W
- S > Tl
Ejercicio 1.6.11
- El electrón es retenido por su atracción hacia el núcleo.
- A medida que aumenta el número de protones en el núcleo, el electrón se sujeta más firmemente y se vuelve más difícil de eliminar.
La relación es similar a la que se ve para la electronegatividad, y no casualmente. La electronegatividad se puede calcular de varias maneras, pero una de esas formas utiliza la energía de ionización como factor.
La electronegatividad es un valor calculado, mientras que la energía de ionización es una determinada experimentalmente. Esta diferencia trae consigo una importante distinción filosófica. Para un estudiante principiante, un valor experimental parece defectuoso, mientras que un valor calculado suena bien. Para un químico experimentado, un valor experimental es verificable; es real. En contraste, un valor calculado se potencia en prestigio sólo si se puede demostrar que concuerda con el experimento.
Ejercicio 1.6.12
Para escapar del átomo, un electrón debe ganar energía. Como se muestra en el problema AT5.2., el nivel de energía 2p es mayor que el nivel de energía 2s. Eso significa que un electrón 2p ya tiene más energía que un electrón 2s. El electrón 2p no necesitará tanta energía adicional para poder escapar del átomo. Como resultado, la energía de ionización del boro es un poco menor que la del berilio.
Los protones adicionales en el núcleo de carbono y nitrógeno compensan con creces ese efecto.
En el caso del oxígeno, el siguiente electrón apenas se agrega a un nivel 2p, pero en este caso debe ser emparejado con otro electrón en la misma región del espacio (en el mismo “orbital”). La repulsión entre estos electrones, o “energía de emparejamiento”, desestabiliza ligeramente el oxígeno, por lo que se necesitará menos energía para eliminar un electrón.
Una vez más, la adición continuada de protones adicionales finalmente compensa este efecto de emparejamiento.
Ejercicio 1.6.13
Al igual que con la electronegatividad, la energía de ionización disminuye a medida que aumenta la distancia al núcleo debido a la relación 1/r 2 en la Ley de Coulomb.
Ejercicio 1.6.14
- La energía se libera por la atracción del electrón libre hacia un núcleo. El electrón se mueve hacia una energía más baja a medida que se estabiliza por su interacción con el núcleo.
- El electrón puede acercarse mucho más al núcleo de hidrógeno que al núcleo de litio, y así sucesivamente. Se liberará más energía debido a la fuerte interacción entre el electrón y el núcleo de hidrógeno en comparación con la interacción entre el electrón y el núcleo de litio (o sodio o potasio...).
Ejercicio 1.6.15
- Los datos zig-zags, pero en términos generales hay un aumento en la afinidad electrónica a medida que aumenta el número de protones en el núcleo.
- El berilio y el neón tienen afinidad electrónica cero debido a que el siguiente electrón en cada caso se agregaría a un nivel de energía más alto. En el caso del berilio, el siguiente electrón entraría en el nivel de energía 2p. Un electrón agregado al neón entraría en el nivel de energía 3s.
- Si bien el siguiente electrón agregado al nitrógeno se agregaría a un nivel 2p, tendría que ser emparejado en la misma región del espacio como un electrón que ya estaba ahí. La energía de emparejamiento en este caso debe ser suficiente para compensar la atracción del electrón hacia el núcleo.
Ejercicio 1.6.16
Quizás la explicación más simple es esta: La adición de 14 protones extra entre lantano y hafnio, en comparación con entre itrio y circonio, da como resultado una contracción considerable del átomo. Los electrones son arrastrados hacia adentro por la carga positiva añadida en el núcleo. Así, los elementos de la tercera fila del bloque de metal de transición no son tan grandes como se podría esperar de otra manera, y en algunos casos son incluso más pequeños que sus elementos precedentes.
Tenga en cuenta que esta no es la única explicación. También se cree que los efectos relativistas juegan un papel en el comportamiento de estos elementos masivos. La teoría de la relatividad de Einstein establece que los objetos se vuelven más pesados cuanto más rápido se mueven. Se puede demostrar que la velocidad de un electrón aumenta con la carga en el núcleo del átomo. Así, los átomos que tienen números atómicos muy altos tienen electrones muy, muy rápidos, y en consecuencia muy pesados. Estos electrones pesados se hunden hacia el núcleo pesado, y el átomo se contrae aún más.

