2.5: Metales- Soluciones a Problemas Seleccionados
- Page ID
- 80694
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Ejercicio 2.1.1
El segundo átomo de metal es de un tamaño diferente al átomo de metal principal. No encajará del todo en la matriz de átomos. En consecuencia, los átomos no podrán deslizarse uno junto al otro con la misma facilidad.
Ejercicio 2.1.2
\[2Fe: \: (3^{+}) \times 2 = (6^{+}) \nonumber\]
\[3 O: \: (2^{-}) \times 3 = (6^{-}) \nonumber\]
Fe 2 O 3: neutro
Ejercicio 2.1.3
Cuanto más larga sea la caja, mayor será la longitud de onda posible.
Ejercicio 2.2.1
El patrón también se repite diagonalmente.
Ejercicio 2.2.2
Los cuadrados pueden formar una serie de patrones que se repiten regularmente. Las filas pueden repetirse exactamente (un patrón aaa), o se pueden cambiar ligeramente, de modo que cada dos filas repitan exactamente la primera fila (un patrón ababab). Incluso podrían ser desplazados para que cada tercera fila sea una repetición exacta de la primera (abcabcabc).
Los pentágonos no forman una capa repetitiva en dos dimensiones.
Ejercicio 2.2.3
En el empaque cuadrado simple, los agujeros tienen forma aproximada de diamante.
En el patrón hexagonal, los agujeros son aproximadamente triangulares.
Ejercicio 2.2.6
- Usando cuartos, la distancia es de aproximadamente 5 mm.
- Usando cuartos, la distancia es de aproximadamente 2.5 mm.
Un electrón libre estaría más cerca de los átomos en una capa hexagonal de empaquetamiento cerrado. Habría una atracción electrón-ion más fuerte en ese caso.
Ejercicio 2.2.7
- Usando dimes, la distancia es de aproximadamente 3.5 mm.
- Usando dimes, la distancia es de aproximadamente 1.5 mm.
Un electrón libre estaría más cerca de los átomos si los átomos fueran más pequeños. Habría una atracción electrón-ion más fuerte en ese caso.
Ejercicio 2.2.8
- puntos de fusión (y fuerza de atracción entre átomos): Fr < Cs < K < Na < Li
- Esta tendencia refleja los tamaños de los átomos. El litio es el más pequeño y el francio el más grande. La atracción electrón/ iónica es mayor en Li y más débil en el Fr.
Ejercicio 2.2.9
a) La superficie total de esta plaza es
\[Area \:= w^{2} \nonumber\]
en el que w = ancho de la celda unitaria. El ancho de la celda unitaria es
\[w = 2r \nonumber\]
en el que r = radio del átomo de titanio.
\[Area \: = 4r^{2} = 4(2.00 \times 10^{-10} m)^{2} = 4(4.00 \times 10^{-20} m^{2}) = 1.60 \times 10^{-19} m^{2} \nonumber\]
b) El área total de este rombo es
\[ Area \: = s^{2} sin \theta \nonumber\]
en el que s = un lado de la celda unitaria y θ = un ángulo de la celda unitaria (ya sea 60° o 120°). Pero
\[s = 2r \nonumber\]
en el que r = radio del átomo de titanio.
\[Area \: = (2 \times 2.00 \times 10^{-10} m)^{2} \: sin(60) = 1.60 \times 10^{-19} \: (0.87) m^{2} = 1.39 \times 10^{-19} m^{2} \nonumber\]
Ejercicio 2.2.10
- \( 4 \times \frac{1}{4} = \: 1 \: atom\)
- \( 2 \times \frac{1}{6} + 2 \times \frac{1}{3} = \frac{2}{6} + \frac{4}{6} = \: 1 \: atom\)
Ejercicio 2.2.11
El área transversal (bidimensional) de un átomo de titanio es el área de un círculo
\[Area \: = \pi r^{2} \nonumber\]
\[Area \: = 3.1415 \times (2.00 \times 10^{-10} m)^{2} = 3.1415 \times 4.00 \times 10^{-20} m^{2} = 1.257 \times 10^{-19} m^{2} = 1.26 \times 10^{-19} m^{2} \nonumber\]
Ejercicio 2.2.12
- \(Efficiency \: = \frac{occupied}{total} \times 100 \% = (\frac{1.26 \times 10^{-19} m^{2}}{1.60 \times 10^{-19} m^{2}}) \times 100 \% = 79 \%\)
- \(Efficiency \: = (\frac{occupied}{total}) \times 100 \% = (\frac{1.26 \times 10^{-19} m^{2}}{1.39 \times 10^{-19} m^{2}}) \times 100 \% = 91 \%\)
Un mayor porcentaje de espacio se ocupa en empaque hexagonal cerrado.
Ejercicio 2.2.13
- número de coordinación = 4
- número de coordinación = 6
Ejercicio 2.2.14
- Suponiendo que el patrón se extiende linealmente, número de coordinación = 2. De lo contrario, el número de coordinación = 2 para los átomos interiores y el número de coordinación = 1 para los átomos terminales.
- Suponiendo que el patrón se extiende en dos dimensiones, número de coordinación = 3. De lo contrario, número de coordinación = 3 para átomos interiores, número de coordinación = 2 para átomos de borde lateral y número de coordinación = 1 para átomos de esquina.
Ejercicio 2.3.0
- i) 8; ii) 6
- i) 4; ii) 4
- i) 5; ii) 5
- i) 5; ii) 6
- i) 6; ii) 8
Ejercicio 2.3.1
- 1/8 átomo en cada esquina
- 8 esquinas en un cubo
- \(8 \times \frac{1}{8} = 1\)átomo por cubo simple
Ejercicio 2.3.2
- 1/8 átomo en cada esquina
- 8 esquinas en un cubo
- 1 átomo en medio del cubo
- \ (1 + 8\ veces\ frac {1} {81 + 8 x 1/8 = 2 átomos por cubo centrado en el cuerpo
Ejercicio 2.3.3
El patrón de cierre hexagonal es ABAB.
Ejercicio 2.3.4
- Tanto en la capa superior como en la inferior, dos átomos están 1/3 dentro de la celda y dos átomos están 1/6 dentro de la celda.
- Eso hace que el\(2 \times (2 \times \frac{1}{3} + 2 \times \frac{1}{6}) = \frac{4}{3} + \frac{4}{6} = \frac{4}{3} + \frac{2}{3} = 1\) átomo sea total en las esquinas
- 1 átomo dentro de la célula.
- 2 átomos en total.
Ejercicio 2.3.5
El patrón en esta variación es ABACA.
Ejercicio 2.3.6
ABCABC.
Ejercicio 2.3.7
- La celda unitaria hexagonal en forma de rombo.
- 4 capas.
Ejercicio 2.3.8
- 1/8 átomo en cada esquina
- 8 esquinas en un cubo
- 1/2 átomo en cada cara del cubo
- \(6 \times \frac{1}{2} + 8 \times \frac{1}{8} = 4\)átomos por cubo centrado en la cara
Ejercicio 2.3.9
a) número de coordinación = 6 (3 dentro del cubo, a lo largo de los tres bordes adyacentes, más tres en cubos adyacentes).
En la imagen, consideremos el átomo verde coordinado por sus vecinos más cercanos, los átomos azules. Una celda unitaria se resalta en rojo.

Aquí está el ambiente de coordinación sin los átomos circundantes.

Se muestra una sola celda unitaria para comparación. Los otros tres átomos más cercanos están en celdas abajo, detrás y a la derecha del que se muestra.

b) número de coordinación = 8 (esquinas del cubo).

Aquí está el ambiente de coordinación sin los átomos circundantes.

A continuación se muestra una sola celda unitaria para mayor simplicidad. Todos los átomos coordinados se encuentran dentro de la célula.

c) los átomos más cercanos están en los centros de las celdas adyacentes; las otras esquinas están más alejadas; número de coordinación = 8.

Aquí está el ambiente de coordinación sin los átomos circundantes.

A continuación se muestra una sola celda unitaria, para mayor simplicidad. Debido a que el átomo está en una esquina, hay otras ocho celdas dispuestas alrededor de esta: una a la derecha, dos detrás, y luego cuatro más abajo.

d) Los átomos más cercanos están en las caras adyacentes a la posición de esquina; estas caras se encuentran a lo largo de tres planos, con cuatro caras rodeando la esquina en cada plano; número de coordinación = 12.

Aquí está el ambiente de coordinación, sin los átomos que están más lejos del verde.
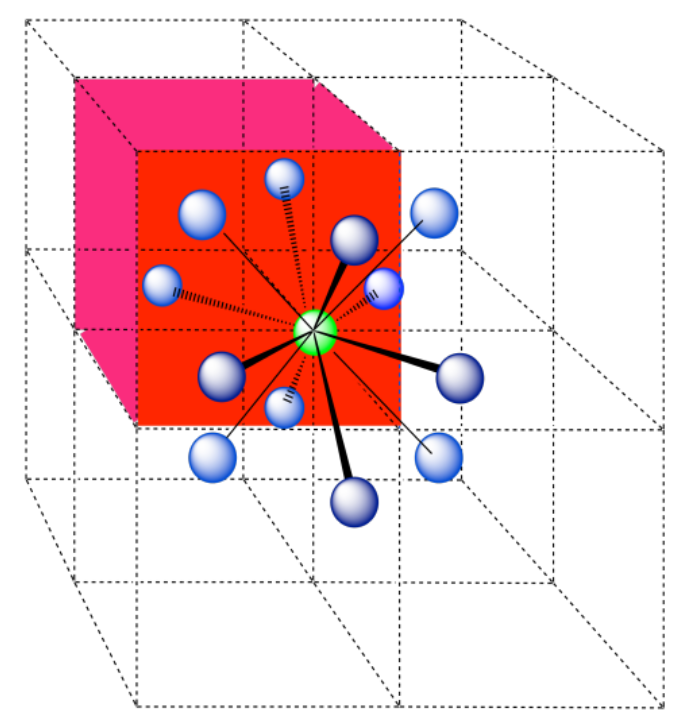
A continuación se muestra una sola celda unitaria. Debido a que el átomo está en una esquina, hay otras siete celdas dispuestas alrededor de esta: una a la derecha, dos detrás, y luego cuatro más abajo.

e) Los átomos más cercanos están en las esquinas alrededor de la cara (4), así como los átomos en el medio de cada cara adyacente (8); número de coordinación = 12.

Aquí está el ambiente de coordinación sin los otros átomos.

A continuación se muestra una sola celda unitaria. Hay otra celda directamente debajo de ella.

Ejercicio 2.3.10
a) Octaédrica. Un octaedro tiene seis vértices y ocho caras.

b) Cúbico. Un cubo tiene ocho vértices y seis caras.

c) Este es también un cubo, traducido del último (es decir, el cubo simplemente se desplaza a una posición diferente en la celosía).

Ejercicio 2.3.11
a) Un agujero cúbico.

b) Un agujero piramidal cuadrado. El átomo en el agujero está por encima de un cuadrado de átomos, con un átomo adicional justo encima de él.

c) Un agujero octaédrico. El átomo que ocupa el agujero ha sido empujado hasta la cara del cubo. Está justo en medio de un cuadrado de átomos. Uno de los vértices está en el centro del siguiente cubo.

d) Un agujero tetraédrico. Tenga en cuenta que las capas en el sistema cúbico más cercano se extienden diagonalmente a través de la celda unitaria cúbica. El átomo en el agujero se asienta sobre un trío de átomos en tres caras adyacentes, y es rematado por el átomo en la esquina del cubo. Debido a que un tetraedro es tan simétrico, la disposición se puede describir de varias otras maneras, eligiendo tres átomos circundantes como base y el cuarto átomo como la tapa del tetraedro.

e) Un octaedro. Nuevamente, las capas hexagonales discurren diagonalmente a través de la celda unitaria.

Ejercicio 2.3.16

Ejercicio 2.4.1
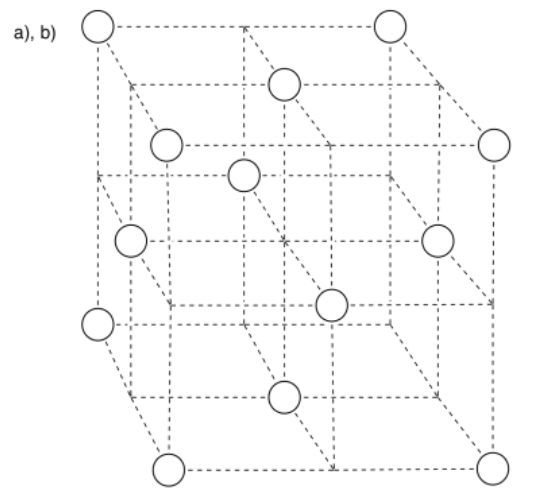
c) Hay ocho átomos en la esquina; cada uno es compartido por ocho cubos vecinos. Hay seis átomos en las caras; cada uno es compartido por dos cubos vecinos.
\[ \# \: atoms = 8 (\frac{1}{8})+ 6 (\frac{1}{2}) = 1 + 3 = 4 \: atoms \nonumber\]

h) El níquel es un poco más pequeño que el hierro. Una fila de átomos rodando a lo largo de la capa de arriba caería en el “bache” causado por el átomo de níquel más pequeño y se atascaría.

