3.6: Problemas de aplicación
- Page ID
- 80682
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El arseniuro de galio se utiliza en la industria electrónica como semiconductor. Puedes comenzar pensando en el arseniuro de galio como iones arseniuro que forman una celda unitaria cúbica centrada en la cara.
a) Dibuja esa celda de unidad cúbica centrada en la cara.
b) Colocar los iones de galio en la mitad de los agujeros tetraédricos.
c) Sombra un tipo de átomo y agrega una leyenda a tu diagrama.
d) Calcular el número total de átomos de arsénico en la celda unitaria.
e) Calcular el número total de átomos de galio en la celda unitaria.
f) ¿Cuál es la fórmula del arseniuro de galio, basado en esa proporción?
g) ¿Cuál sería la carga de cada ion, en función de su ubicación en la tabla periódica?
h) El punto de fusión del arseniuro de galio sería (mayor/menor) que CSi.
i) En realidad, ambos iones tienen mucha menos carga de lo esperado. ¿Por qué el arseniuro de galio no es completamente iónico?
- Respuesta a), b), c
-

- Respuesta d
-
Hay ocho átomos de arsénico en la esquina; cada uno es compartido por ocho cubos vecinos. Hay seis átomos en las caras; cada uno es compartido por dos cubos vecinos.
# átomos = átomos de\( 8 (\frac{1}{8}) + 6 ( \frac{1}{2}) = 1+ 3 = 4\) arsénico
- Respuesta e
-
Cada átomo de galio está completamente dentro de la célula. Hay 4 átomos de galio.
- Respuesta f
-
La fórmula es solo la proporción de cada átomo en el material. Dado que la relación 4:4 es lo mismo que una relación 1:1, la fórmula es solo GaAs.
- Respuesta g
-
El arsénico está a la derecha del galio en la tabla periódica, por lo que el arsénico debe ser más electronegativo; debe ser el anión, y el galio el catión.
El arsénico está a tres átomos del borde derecho de la tabla periódica; como ion, tiene sentido una carga de 3. Para equilibrar la carga, el galio debe tener una carga 3+.
- Respuesta h
-
El cesio es mayor que el galio, y el yodo es mayor que el arsénico, por lo que en términos de distancia internuclear, habría menos atracción entre los iones de cesio y yoduro que entre los iones (más cercanos) de galio y arseniuro. Además, si la carga sobre galio y arseniuro es 3+ y 3-, respectivamente, y las cargas sobre cesio y yoduro son solo 1+ y 1-, respectivamente, entonces debería haber una atracción mucho mayor entre los iones galio y arseniuro.
El punto de fusión del arseniuro de galio (mp = 1,238 o C) debe ser mayor que el del yoduro de cesio (mp = 632 o C).
- Contestar i
-
Los átomos están tan juntos en la tabla periódica que no es probable que el arsénico robe completamente tres electrones del galio; la diferencia en la electronegatividad no es lo suficientemente grande.
Los dispositivos electrónicos se basan en una interfaz entre cobre, un conductor de electricidad y silicio, un semiconductor. Sin embargo, los átomos de cobre tienden a difundirse a través del silicio, alterando sus propiedades semiconductoras Por lo tanto, se usa una capa de barrera en el medio, generalmente óxido de magnesio o nitruro de titanio. Echemos un vistazo a la estructura de estos materiales.
- Con base en su posición en la tabla periódica, ¿cuál es la carga sobre el ion óxido en el óxido de magnesio?
- Con base en su posición en la tabla periódica, ¿cuál es la carga sobre el ion magnesio en el óxido de magnesio?
- Por lo tanto, para equilibrar la carga, ¿cuál es la fórmula del óxido de magnesio?
El óxido de magnesio tiene una estructura de sal de roca. Los iones de óxido forman una célula cúbica centrada en la cara y los iones de magnesio ocupan los agujeros octaédricos.
d) Agregar los átomos a la figura según la leyenda.

e) Calcular cuántos átomos de cada tipo hay en la celda.
f) ¿Cuál es la configuración electrónica de un átomo de Mg (se puede utilizar la abreviatura de gas noble)?
g) ¿Cuál es la configuración electrónica de un ion Mg en el óxido de magnesio?
h) ¿Cuál es más grande: magnesio, o ion magnesio? ¿Por qué?
i) ¿Cuál es la configuración electrónica de un ion óxido en el óxido de magnesio?
j) ¿Cuál es más grande: ion óxido o ion magnesio? ¿Por qué?
Alternativamente, a veces se usa nitruro de titanio (TiN) como capa de barrera en lugar de óxido de magnesio.
k) En base a su posición en la tabla periódica, ¿cuál es la carga sobre el ion nitruro en el nitruro de titanio?
l) Por lo tanto, ¿cuál es la carga sobre el titanio en nitruro de titanio?
El nitruro de titanio, como el óxido de magnesum, adopta una estructura de sal de roca. Tiene un punto de fusión que es un poco mayor que el del óxido de magnesio (2 930 o C vs. 2 852 o C).
m) Explicar, en términos de energía reticular, por qué el punto de fusión del nitruro de titanio es un poco mayor que el punto de fusión del óxido de magnesio.
En la estructura del silicio, imagina una celda cúbica centrada en la cara, pero con átomos de silicio adicionales que ocupan la mitad de los agujeros tetraédricos.
n) Agregar los átomos a la figura para mostrar la estructura del silicio.
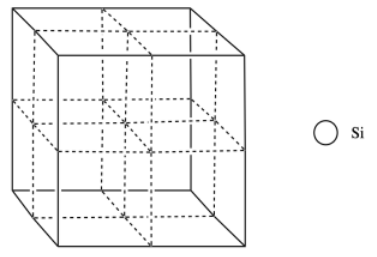
o) ¿Cuál es el número de coordinación de un silicio en un agujero tetraédrico?
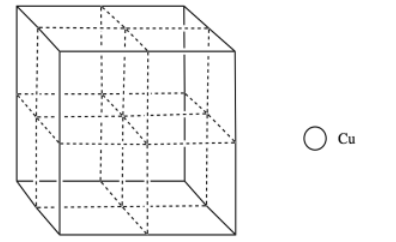
El cobre generalmente forma una celda cúbica centrada en la cara. Sin embargo, los investigadores encontraron que el cobre cúbico centrado en el cuerpo se puede formar durante la ablación con láser a temperatura ambiente (Wu, F; Narayan, J. Cryst. Crecimiento. Des. 2013, 13, 5018-5024.). Cuando se cultiva sobre una superficie de óxido de magnesio, este cobre centrado en el cuerpo forma una capa más duradera que la forma normal de FCC.
p) Agrega los átomos a la figura para formar cobre cúbico centrado en el cuerpo.
q) ¿Cuál es la configuración electrónica del cobre (se puede utilizar la configuración de gas noble)?
r) Explicar por qué el cobre es un buen conductor de la electricidad. Agrega una imagen para apoyar tu explicación.
s) ¿Por qué el silicio no es tan buen conductor de electricidad como el cobre?
- Contestar a
-
O 2-
- Respuesta b
-
Mg 2 +
- Respuesta c
-
MgO
- Respuesta d
-

Respuesta d al Ejercicio 3.6.2s. Un material iónico compuesto por ocho cubos. Los átomos de Mg y O se colocan alternativamente en cada vértice. - Respuesta e
-
O: 8 (1/8) esquinas + 6 (1/2) caras = 4 átomos; Mg: 12 (1/4) bordes + 1 centro = 4 átomos; MgO
- Respuesta f
-
[Ne] 3s 2
- Respuesta g
-
[Ne] o [Él] 2s 2 2p 6
- Respuesta h
-
magnesio; la carga positiva en el ion hace que los electrones restantes se contraigan
- Contestar i
-
[Ne] o [Él] 2s 2 2p 6
- Responder j
-
óxido; tienen la misma configuración electrónica, pero el magnesio tiene más protones en su núcleo para atraer a los electrones.
- Responder k
-
N 3-
- Contesta l
-
Ti 3 +
- Contestar m
-
La mayor carga sobre los iones en TiN conduciría a una mayor fuerza de atracción entre los iones, y por lo tanto se requeriría una mayor energía reticular para eliminar los iones de la red. Esa atracción disminuye así la movilidad de los iones, por lo que el compuesto no se derrite tan fácilmente. Sin embargo, el hecho de que tanto Ti3+ como N3- sean ligeramente mayores que Mg2+ y O2- ayuda a explicar por qué los puntos de fusión no son extremadamente diferentes; la Ley de Coulomb dice que la mayor atracción de las cargas más altas debe compensarse en parte por el mayor tamaño de los iones.
- Responder n
-
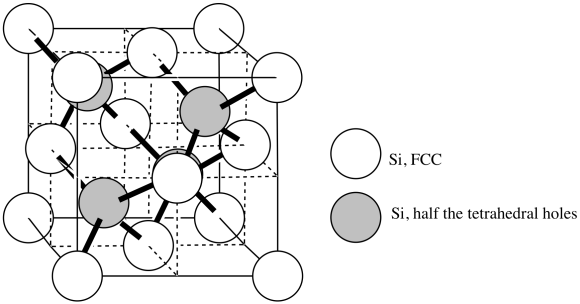
Respuesta n al Ejercicio 3.6.2s. Se muestran dos tipos de átomos de silicio: los átomos blancos son cúbicos centrados en la cara, etiquetados como FCC, y los átomos sombreados están centrados en la mitad de los agujeros tetraédricos. - Responder o
-
CN = 4
- Responder p
-
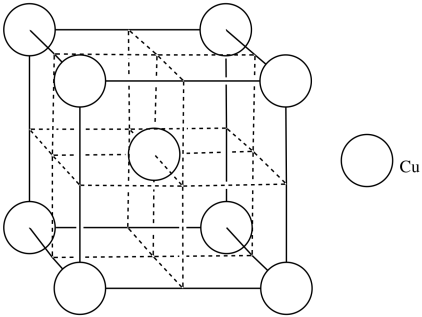
- Contestar q
-
[Ar] 4s 1 3d 10 (recuerda, este es uno de esos casos en los que el nivel 3d está ligeramente por debajo del nivel 4s)
- Responder r
-
La baja electronegatividad del cobre le permite formar un modelo marino de electrones de unión metálica. Los iones de cobre están rodeados por los electrones sueltos que se les permite fluir a través del material.
- Respuesta s
-
El silicio es demasiado electronegativo para formar una estructura de mar de electrones como un metal.

