3.8: Compuestos Iónicos- Soluciones para Problemas Seleccionados
- Page ID
- 80674
Ejercicio 3.1.1
- Ta (tantalio) es menor en la tabla periódica que V (vanadio)
- El Hg (mercurio) es menor en la tabla periódica que el Zn (zinc)
- Si (silicio) está a la izquierda en la tabla periódica en comparación con S (azufre)
- W (tungsteno) está a la izquierda e inferior en la tabla periódica en comparación con Cu (cobre)
Ejercicio 3.1.2
- [Él] 2s 2 2p x 2 2p y 1 2p z 1
- [Él] 2s 2 2p x 2 2p y 2 2p z 2
- [Ar] 4s 2
- [Ar]
- [Ne] 3s 2 2p x 1
- [Ne]
- [Él] 2s 2 2p x 1 2p y 1 2p z 1
- [Él] 2s 2 2p x 2 2p y 2 2p z 2
i) [Ne] 2s 2 2p x 2 2p y 2 2p z 1
j) [Ne] 2s 2 2p x 2 2p y 2 2p z 2
Ejercicio 3.1.3
- 0.076 nm; menor
- 0.140 nm; más grande
- 0.167 nm; menor
- 0.144; más grande
Ejercicio 3.1.4
- 0.154; más grande
- 0.071; menor
- 0.128; más grande
- 0.133; más pequeño
Ejercicio 3.2.1
- 1:1 K:Cl o KCl
- 1:3 Fe:Cl o FeCl 3
- 1:6 Mo:Cl o MoCl 6
- 1:4 Zr:Cl o ZrCl 4
Ejercicio 3.2.2
- Li:O 2:1 o Li 2 O
- Fe:O 2:3 o Fe 2 O 3
- Cr:O 1:3 o CrO 3
- Ti:O 1:2 o TiO 2
Ejercicio 3.2.3
- Li:N 3:1 o Li 3 N
- Ta:N 1:1 o TaN
- W:N 1:2 o WN 2
- Co:N 3:2 o Co 3 N 2
Ejercicio 3.2.4
- Li 4 WO 4 porque el anión tungstato sería 4-
- Li 4 V 4 O 12 porque el ion tetravanadato sería 4-
- Li 2 Mo 4 O 14 porque el ion tetramolibdato sería 2-
- Li 2 Cr (OH) 6 Mo 6 O 18 porque el polioxoanión complejo sería 2-
Ejercicio 3.3.1
- KCl tendría el punto de fusión más bajo. Sería más fácil fundir que LiCl porque el ion Li + más pequeño atraería más fuertemente el contraión, debido a la menor distancia que separa las cargas opuestas.
- El NaBr tendría un punto de fusión más bajo que el NaF.
- CaO tendría un punto de fusión más bajo que BeO.
- KBr tendría un punto de fusión más bajo que LiF.
Ejercicio 3.3.2
La respuesta es (a). La suma del radio de catión y anión es mayor; por lo tanto, la distancia entre los dos es mayor, por lo que la fuerza de atracción será más débil.
Ejercicio 3.3.3
- CaCl 2
- Na 2 O
- CaO
Ejercicio 3.3.4
- Un poco más bajo ya que K + es un poco más grande que Na + (real= 770°C)
- Un poco más alto ya que F - es un poco más pequeño que Cl -. (real = 930°C)
- Mucho mayor ya que la carga aniónica es 2x mayor. (real = 1275°C (sublima pero no se funde)
- Mucho más alto ya que la carga de cationes y aniones son 2x mayores. (real = 2000+ °C (se descompone por encima de esta temperatura))
Ejercicio 3.4.1
- 25 aguas.
- 2 unidades (2 aniones y 2 cationes).
- La mitad del agua solo podría disolver la mitad de la sal: 1 unidad.
- Cuatro veces el agua puede disolverse cuatro veces la sal: 4 unidades.
Ejercicio 3.4.2
- La vida debe ser más soluble.
- El KF debería ser más soluble (pero sigue leyendo).
- El LiF debería ser más soluble.
Ejercicio 3.4.3
El MgO contiene más iones altamente cargados (Mg 2 + y O 2-) que LiF (Li + y F -) y por lo tanto es más difícil separar los iones de su estado sólido.
Ejercicio 3.4.4
Los iones interactúan con el agua a través de interacciones electrostáticas, también. El mismo factor de distancia que permite que los iones pequeños se atraigan entre sí más fuertemente también permite que los iones pequeños interactúen más fuertemente con el agua.
Ejercicio 3.4.5
- La energía reticular de un sólido iónico es una medida de la fuerza de los enlaces en ese compuesto iónico.
- Carga del ion (directamente relacionada con la energía de la red); Radio de cada ion (inversamente relacionado con la energía de la red)
- Una energía de celosía más fuerte resulta en una unión más fuerte. Cuanto más fuerte es el enlace, más energía se requiere para separar los iones.
- La energía de celosía más fuerte da como resultado mayor mp o bp
- La energía de celosía más fuerte da como resultado una red cristalina menos soluble.
Ejercicio 3.4.6
- NaBr
- KF CaF2
- MgO Na2O
- KF CsCl
- RbBr CaCl2
Ejercicio 3.5.1
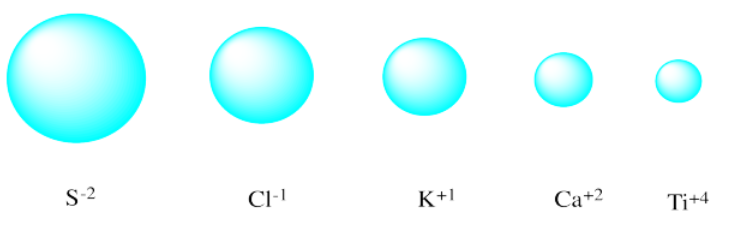
Ejercicio 3.5.2
Generalmente, pero no siempre, los aniones son más grandes que los cationes, por lo que los cationes pueden empacar eficientemente en los agujeros entre los aniones.
Ejercicio 3.5.3
i. a) cúbico simple; b) agujero cúbico; c) número de coordinación = 8; d) todo ocupado; e) 8 x 1/8 Cl y 1 Cs (o viceversa, dependiendo de cómo defina una celda unitaria); f) CsCl
ii. a) cúbico centrado en la cara; b) agujero octaédrico; c) número de coordinación = 6; d) todo ocupado; e) 6 x 1/2 más 8 x 1/8 = 4 Cl y 1 más 12 x 1/4 = 4 Na (o viceversa, dependiendo de cómo defina una celda unitaria); f) NaCl
iii. a) cúbico centrado en la cara; b) agujero tetraédrico; c) número de coordinación = 4; d) todo ocupado; e) 6 x 1/2 más 8 x 1/8 = 4 Ca y 8 F; f) CaF 2
Ejercicio 3.6.1
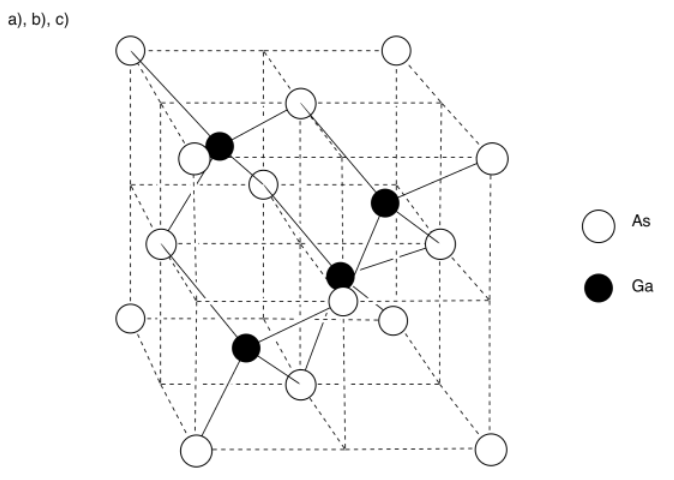
d) Hay ocho átomos de arsénico en la esquina; cada uno es compartido por ocho cubos vecinos. Hay seis átomos en las caras; cada uno es compartido por dos cubos vecinos.
\(\# \: atoms = 8 (\frac{1}{8}) + 6(\frac{1}{2}) = 1 + 3 = 4\)átomos de arsénico
e) Cada átomo de galio está enteramente dentro de la célula. Hay 4 átomos de galio.
f) La fórmula es solo la relación de cada átomo en el material. Dado que la relación 4:4 es lo mismo que una relación 1:1, la fórmula es solo GaAs.
g) El arsénico está a la derecha del galio en la tabla periódica, por lo que el arsénico debe ser más electronegativo; debe ser el anión, y el galio el catión.
El arsénico está a tres átomos del borde derecho de la tabla periódica; como ion, tiene sentido una carga de 3. Para equilibrar la carga, el galio debe tener una carga 3+.
h) El cesio es mayor que el galio, y el yodo es mayor que el arsénico, por lo que en términos de distancia internuclear, habría menos atracción entre los iones de cesio y yoduro que entre los iones (más cercanos) de galio y arseniuro. Además, si la carga sobre galio y arseniuro es 3+ y 3-, respectivamente, y las cargas sobre cesio y yoduro son solo 1+ y 1-, respectivamente, entonces debería haber una atracción mucho mayor entre los iones galio y arseniuro.
El punto de fusión del arseniuro de galio (mp = 1,238 o C) debe ser mayor que el del yoduro de cesio (mp = 632 o C).
i) Los átomos están tan juntos en la tabla periódica que no es probable que el arsénico robe completamente tres electrones del galio; la diferencia en la electronegatividad no es lo suficientemente grande.
Ejercicio 3.6.2
a) O 2- b) Mg 2 + c) MgO
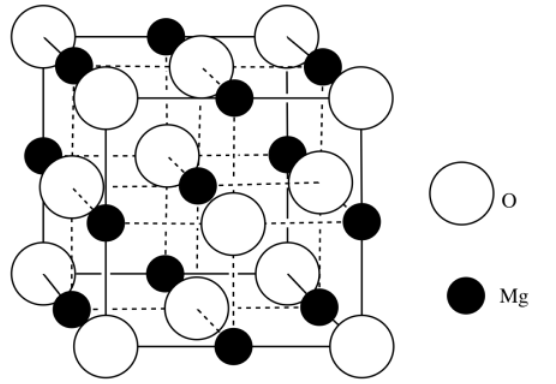
e) O: 8 (1/8) esquinas + 6 (1/2) caras = 4 átomos; Mg: 12 (1/4) bordes + 1 centro = 4 átomos; MgO
f) [Ne] 3s 2 g) [Ne] o [Él] 2s 2 2p 6
h) magnesio; la carga positiva sobre el ion hace que los electrones restantes se contraigan
i) [Ne] o [Él] 2s 2 2p 6
j) óxido; tienen la misma configuración electrónica, pero el magnesio tiene más protones en su núcleo para atraer a los electrones.
k) N 3- l) Ti 3 +
m) La mayor carga sobre los iones en TiN conduciría a una mayor fuerza de atracción entre los iones, y por lo tanto se requeriría una mayor energía reticular para eliminar los iones de la red. Esa atracción disminuye así la movilidad de los iones, por lo que el compuesto no se derrite tan fácilmente. Sin embargo, el hecho de que tanto Ti3+ como N3- sean ligeramente mayores que Mg2+ y O2- ayuda a explicar por qué los puntos de fusión no son extremadamente diferentes; la Ley de Coulomb dice que la mayor atracción de las cargas más altas debe compensarse en parte por el mayor tamaño de los iones.
n)
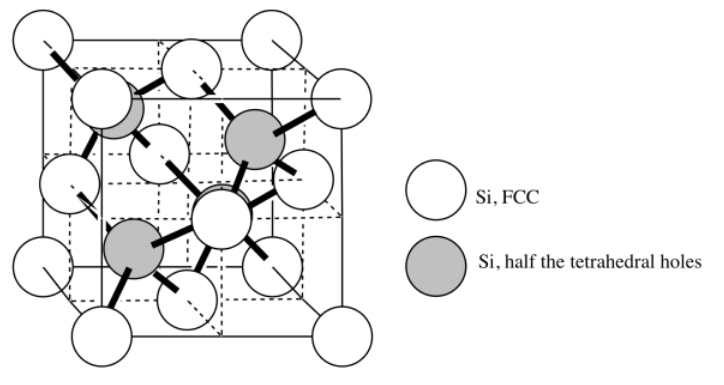
o) CN = 4
p)
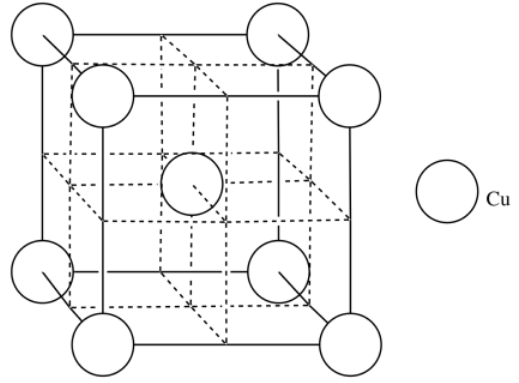
q) [Ar] 4s 1 3d 10 (recuerda, este es uno de esos casos en los que el nivel 3d está ligeramente por debajo del nivel 4s)
r) La baja electronegatividad del cobre le permite formar un modelo marino de electrones de unión metálica. Los iones de cobre están rodeados por los electrones de retención floja que se les permite fluir a través del material.
s) El silicio es demasiado electronegativo para formar una estructura de mar de electrones como un metal.
Ejercicio 3.7.1
a) LiF b) NaI c) KBr d) MgCl 2 e) CaO f) BEs g) Na 2 O Li 3 N
Ejercicio 3.7.2
a) NaNO 3 b) KClO 4 c) Li 2 SO 4 d) (NH 4) 3 PO 4 e) MgCO 3 f) Ca (OCl) 2 g) NaO 2 CCH 3 h) Ser (ClO 3) 2
Ejercicio 3.7.3
a) TaCl 5 b) CrF 3 c) PbBr 2 d) HgCl 2 e) WO 3 f) MoS 2
Ejercicio 3.7.4
a) cloruro de litio b) sulfuro de sodio c) acetato de litio d) nitrito de magnesio e) sulfito de sodio
f) sulfato de plomo (II) g) óxido de osmio (VIII) h) nitrato de plomo (IV)

