4.1: ¿Por qué importan las moléculas?
- Page ID
- 80576
Las moléculas no lo son todo
Para tener una buena idea de lo que es una molécula, primero veamos qué no es una molécula.
No todas las cosas están compuestas por moléculas. Muchas rocas y minerales comunes están compuestos principalmente de sílice. La sílice es un sólido de red no molecular con la fórmula aproximada SiO 2. Su estructura continúa en todas las direcciones. El pedazo de sílice que se muestra a continuación muestra solo 14 átomos de silicio, pero un pedazo real de sílice podría contener 14 mil o 14 millones de átomos de silicio, o casi cualquier otro número.
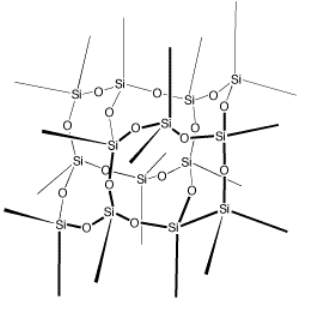
En contraste, una molécula está hecha de un número particular de átomos, y por lo tanto tiene un tamaño particular. Los átomos en sílice no se recogen en unidades discretas de un tamaño particular; en cambio, se pueden disponer en matrices muy grandes de diferentes tamaños. Una unidad de sílice podría contener un millón de átomos de silicio o mil millones de ellos.
Las moléculas contienen una combinación específica de átomos en una proporción específica. Eso no es exactamente cierto en sílice. Realmente hay aproximadamente el doble de átomos de oxígeno que el silicio en la sílice y los átomos están dispuestos de una manera particular, pero la relación Si:O puede variar ligeramente, y también hay pequeñas cantidades de hidrógeno (pero una cantidad tan pequeña que la ignoramos en la fórmula).
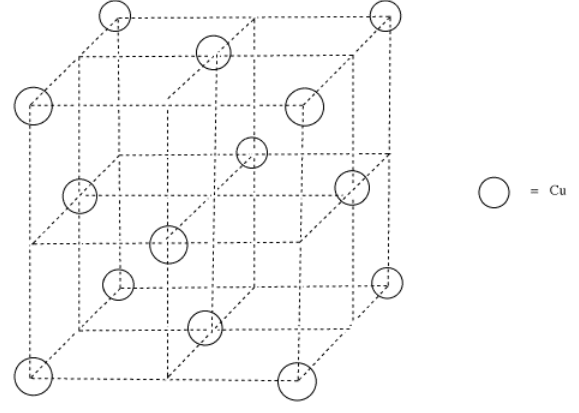
El cobre metálico también es un sólido no molecular, con legiones de átomos de cobre unidos entre sí para formar una masa unida. Los átomos de cobre están dispuestos de una manera particular, y el metal tiene una fórmula muy específica (Cu), pero al igual que la sílice, una unidad de cobre podría contener un millón de átomos de cobre o mil millones de ellos.
Las rocas y los metales son materiales inorgánicos no vivos. A menudo nos interesan los productos químicos utilizados por los sistemas biológicos. Esos compuestos son abrumadoramente moleculares.
- no todos los compuestos son moléculas
- algunos compuestos forman estructuras más grandes que no tienen un tamaño bien definido, aunque pueden tener una proporción específica de átomos
- los metales forman grandes estructuras que no vienen en trozos regulares
Orígenes y alcances de la química inorgánica y orgánica
A veces escucharás los términos “química orgánica” y “química inorgánica”, como en “Hoy tengo un laboratorio de química inorgánica” o “Simplemente me fue muy bien en mi prueba de o-química”. A veces la química de secundaria o de primer año se llama “inorgánica”, pero esa no es realmente una buena descripción. ¿Qué significan realmente estos términos?
La constatación durante el Renacimiento europeo de que existe toda una química única para los seres vivos dio lugar al estudio de la química orgánica. Investigadores que trabajan en escuelas de medicina trabajaron para descubrir los principios activos que se podían encontrar en los remedios herbales y especias, que en ese momento formaban una parte importante del tratamiento de la enfermedad. La química del mundo biológico parecía completamente separada de la del mundo mineral, y en consecuencia la química orgánica se desarrolló como una disciplina separada de la química inorgánica.
- la química orgánica se basa en la química de los organismos
- la química de los organismos involucra abrumadoramente compuestos de carbono
- más generalmente, la química orgánica es la química de los compuestos de carbono
- química inorgánica es la química del resto de la tabla periódica
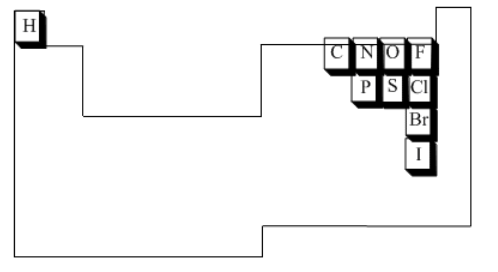
Los compuestos orgánicos se basan en solo unos pocos elementos de la parte superior de la tabla periódica. El componente principal de las moléculas orgánicas es el carbono. Los átomos de carbono son capaces de unirse entre sí para formar estructuras cada vez más grandes.
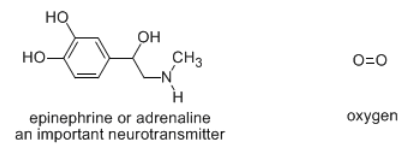
Además, los compuestos orgánicos contienen frecuentemente hidrógeno, oxígeno y nitrógeno; ocasionalmente también se ven fósforo y azufre. Con solo estos átomos, se pueden hacer las principales clases de biomoléculas estructurales (lípidos, proteínas y ácidos nucleicos). La mayoría de las moléculas pequeñas y biológicamente relevantes contienen solo este pequeño grupo de átomos, incluyendo hormonas, neurotransmisores y compuestos involucrados en la ecología química.
Algunos organismos marinos producen compuestos halogenados que contienen bromo, cloro o yodo. Estos compuestos no realizan una función obvia en estos organismos. Muchos compuestos orgánicos halogenados son tóxicos, por lo que es posible que los organismos marinos utilicen estos compuestos como medida de autodefensa; la guerra química no es inaudita en la naturaleza.
Además, los compuestos halogenados a veces son útiles para llevar a cabo reacciones orgánicas en el laboratorio o en la industria.
Ocasionalmente, otros elementos juegan papeles extremadamente importantes en las moléculas biológicas; por ejemplo, la vitamina B12 contiene un átomo de cobalto unido a un carbono, y juega un papel importante como agente regulador. Sin embargo, en general, los compuestos orgánicos y biológicos contienen muy pocos elementos: C, H, O, N, ocasionalmente S y P, y en ocasiones halógenos.
Las aplicaciones de la química orgánica son de amplio alcance. Un área práctica obvia es la industria farmacéutica, ya que las pequeñas moléculas orgánicas son frecuentemente biológicamente activas. Sin embargo, una de las primeras aplicaciones industriales de la química orgánica fue la industria de colorantes y pinturas, ya que muchos pigmentos pueden elaborarse a partir de compuestos orgánicos. Se ha argumentado que el desarrollo de esta industria en Alemania en los años 1800 estuvo estrechamente relacionado con el ascenso de ese país como una gran potencia industrial. Hoy en día, Alemania sigue siendo un importante centro de investigación y desarrollo en química. Una de las mayores aplicaciones es la química de polímeros, que involucra moléculas muy grandes o “macromoléculas” que son útiles como plásticos y otros materiales. La mayoría de los polímeros orgánicos se derivan del petróleo, pero una fracción creciente de ellos proviene de materiales agrícolas como el maíz y la soja.
- los productos farmacéuticos son una aplicación importante de la química orgánica
- pigmentos, pinturas y tintes son históricamente muy importantes en la química orgánica
- una de las mayores aplicaciones de la química orgánica es la química de polímeros
La química inorgánica es solo el resto de la química. Es la parte que no se basa principalmente en el carbono. Resulta que hay mucha química inorgánica importante en biología, también. Frecuentemente, los iones metálicos juegan un papel crucial en Hay aplicaciones importantes de la química inorgánica, también. Muchos materiales importantes son inorgánicos, como la cerámica y los materiales de estado sólido utilizados como conductores y semiconductores. Muchos procesos catalíticos industriales, como refinar petróleo o fabricar detergentes, requieren catálisis por metales de transición. Los metales en sí son importantes en la sociedad, y a menudo se requiere química inorgánica para extraer metales de minerales naturales.
- la ciencia de los materiales ofrece importantes aplicaciones de la química inorgánica
- catálisis ofrece importantes aplicaciones de la química inorgánica
- minería y metalurgia a menudo depende de la química inorgánica
En Sistemas Vivos, el foco está a menudo en las moléculas
Las estructuras biológicas como el ADN, las proteínas y las células dependen de las moléculas. Una hebra de ADN es una molécula muy larga, y también lo es una proteína. Las células son estructuras complicadas y organizadas construidas a partir de un gran número de moléculas más pequeñas.
También hay muchas moléculas pequeñas importantes en biología. Los neurotransmisores como la epinefrina son moléculas bastante simples, pero sin ellos nuestro sistema nervioso no podría funcionar. El oxígeno, que contiene solo dos átomos de oxígeno, es una molécula muy simple, y sin duda es esencial para los seres vivos.
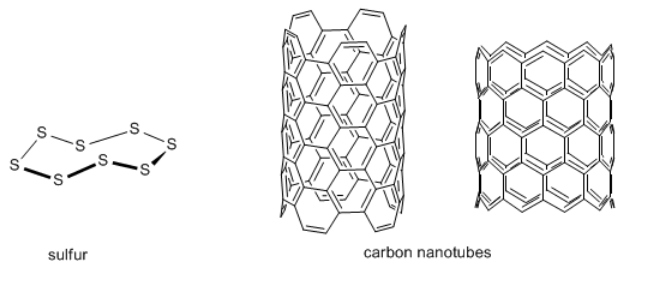
Las moléculas no solo se encuentran en biología. El azufre es una molécula que se encuentra de forma natural en la tierra. Contiene un grupo de átomos de azufre conectados en un anillo, como una cadena margarita. Los nanotubos de carbono y los fullerenos son moléculas que contienen carbono que se pueden encontrar tanto en meteoritos como en algunos tipos de acero.
En general, se trata de un curso sobre química estructural. La química es específicamente el estudio de la materia y la energía: las cosas de las que está hecho el universo. Debido a que muchos de los lectores de este texto serán carreras de biología y estudiantes de premedicina, tendremos especial cuidado de prestar atención a las cosas de las que están hechos los seres vivos. La química orgánica es el estudio de la materia orgánica, es decir, las cosas de las que se hacen los seres vivos. Muchos de los ejemplos en estas páginas sobre moléculas y sus propiedades están relacionados de alguna manera con los seres vivos.
En una molécula, una combinación específica de átomos está dispuesta de una manera específica. Todos los átomos se mantienen en su lugar por enlaces que los conectan con otros átomos. Los átomos en un compuesto específico siempre se encuentran en los mismos lugares de una molécula a la siguiente. Esta información se ha mostrado mediante cristalografía de rayos X y microscopía electrónica de tunelización, dos métodos que nos pueden dar imágenes bastante buenas de dónde se pueden encontrar los átomos individuales dentro de un compuesto o un elemento. Esta disposición única le da a la molécula propiedades físicas y biológicas únicas.
Si bien hay varias formas en las que ocho carbonos, dos oxígenos, cuatro nitrógenos y diez hidrógenos pueden combinarse para formar moléculas con la fórmula C 8 H 10 N 4 O 2, una disposición única de estos átomos forma la estructura de la cafeína, con la efecto estimulante en tu sistema nervioso.
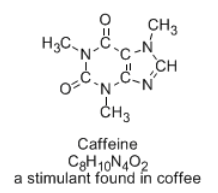
No querrías ingerir cualquier molécula que por casualidad tuviera la misma fórmula que la cafeína. Otras combinaciones de átomos en la relación C 8 H 10 N 4 O 2 podrían ser ineficaces en el mejor de los casos o venenosas en el peor. Las estructuras pueden estar conectadas usando un orden diferente de átomos; a veces, decimos que tienen una conectividad diferente. Estas otras estructuras se describen como “isómeros” de la cafeína.
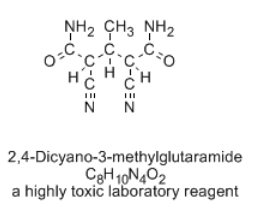
- Los compuestos que tienen las mismas fórmulas pero diferentes conectividades se denominan isómeros.
Estos átomos permanecen unidos entre sí de la misma manera a lo largo de la vida útil de la molécula, independientemente de si la molécula está congelada en la fase sólida, se ha fundido en la fase líquida o flota a través del aire en la fase gaseosa.
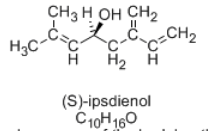
Cuando un escarabajo de corteza hembra produce y secreta una feromona sexual para atraer a un compañero, la feromona puede transportarse en corrientes de aire a los escarabajos de la corteza macho, cuyas antenas pueden interceptar moléculas individuales de feromona, completamente intactas, aún en la misma forma que cuando fueron secretadas por la hembra, no importa lo lejos que esté. El macho reconoce la estructura de la molécula; puede decir claramente si acaba de interceptar la feromona propiamente dicha o algún impostor sutil que también pasa a tener la fórmula C 10 H 16 O.
Dibuja las siguientes moléculas. En cada caso, los hidrógenos están todos unidos al átomo que no es hidrógeno.
a) agua, H 2 O b) amoníaco, NH 3 c) metano, CH 4
- Contestar
-
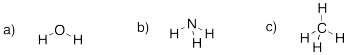
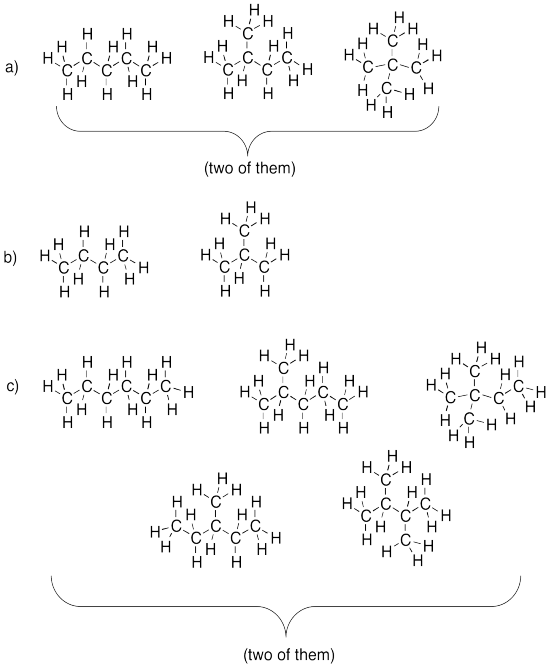
Dibujar tres isómeros para cada uno de las siguientes fórmulas. Supongamos que cada carbono puede formar 4 enlaces y cada hidrógeno puede hacer solo un enlace.
a) C 5 H 12 b) C 4 H 10 c) C 6 H 14
- Contestar
-