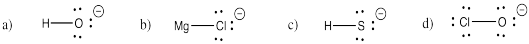4.2: Estructuras de Lewis
- Page ID
- 80580
Para pensar en algunos de los compuestos que se pueden hacer con esta pequeña colección de elementos, necesitaremos una forma de visualizar en papel cómo estos átomos están conectados entre sí.
En un momento, la gente pensaba en los átomos de estos compuestos como esferas cargadas (como aniones de oxígeno, O 2-, o cationes de carbono, C 4+) que simplemente se juntaban por sus cargas opuestas, como pilas de gelatinas pegajosas. Sin embargo, hay algunas limitaciones en esta forma de ver los compuestos. Sabemos que en la mayoría de los compuestos orgánicos, es común encontrar dos átomos de carbono conectados entre sí, lo que no es probable que suceda si todos los carbonos se encuentran como cationes cargados; en ese caso, simplemente se repelerían entre sí.
A principios del siglo XX, G.N. Lewis utilizó algunas observaciones simples sobre la tabla periódica para proponer un modelo alternativo de cómo los átomos pueden unirse entre sí. Este modelo aún influye en la forma en que pensamos sobre las moléculas hoy en día.
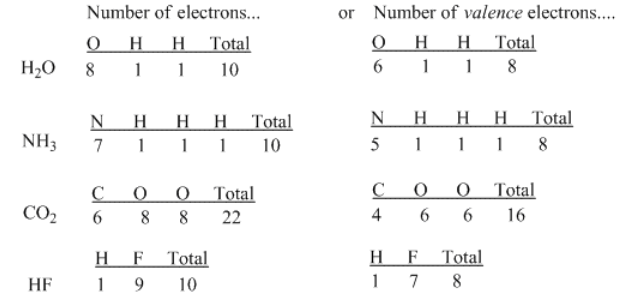
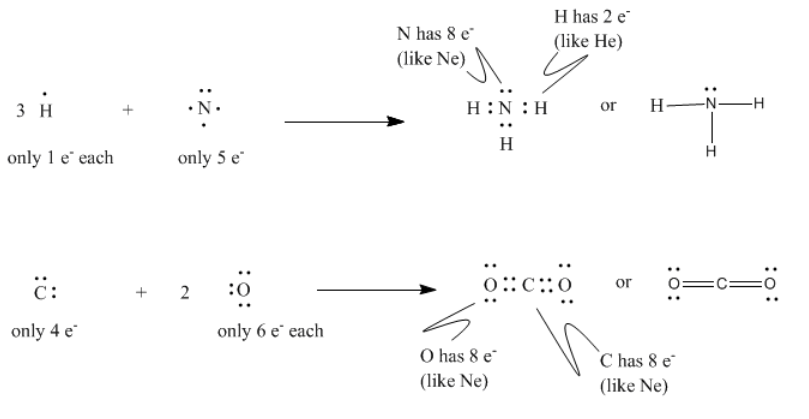
En primer lugar, Lewis señaló que si se cuenta el número de electrones en todos los átomos en casi cualquier compuesto molecular conocido, como el agua (H 2 O), amoníaco (NH 3) o dióxido de carbono (CO 2), se obtiene un número par (10, 10 y 22, respectivamente, en estos ejemplos).

A partir de esta observación finalmente propuso la noción de que los electrones son más estables si se encuentran en pares. Por lo tanto, dos átomos con números impares de electrones pueden ganar estabilidad si se unen para formar un número par en general.
- las moléculas generalmente contienen números pares de electrones totales
Por ejemplo, el hidrógeno, con 1 electrón, más flúor, con 9 electrones, se unen para formar fluoruro de hidrógeno, con 10 electrones. El nuevo par de electrones que se forma a partir del electrón desapareado en el flúor y el electrón simple en el hidrógeno, pensó Lewis, es el enlace que mantiene unidos a los dos átomos.
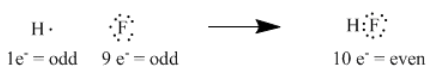
Para simplificar el conteo de electrones, uno solo necesita considerar los electrones de valencia al pensar en la unión; uno podría ignorar los electrones centrales, que son simplemente grupos de electrones que ya numeran lo mismo que un gas noble. Así, consideramos los siete electrones de valencia del flúor en lugar de los nueve; consideramos los cinco electrones de valencia del nitrógeno y no los siete.
- los electrones de valencia son los electrones en una capa externa de un átomo
- contar solo electrones de valencia simplifica el conteo de electrones
Lewis hizo un par de adiciones a esta idea a partir del diseño de la tabla periódica. La gente estaba consciente de la notable estabilidad de los gases nobles, y así parecía que había algo particularmente estable en el número de electrones que se encuentran en estos elementos. Estos son números pares, por supuesto: 2 para helio, 10 para neón, 18 para argón, 36 para criptón y así sucesivamente. En cuanto a los electrones de valencia, el neón tiene 8, el argón tiene 8, el criptón tiene 18 y así sucesivamente. Lewis sugirió que cualquier átomo podría volverse más estable si pudiera compartir suficientes electrones de sus vecinos para obtener el mismo recuento de electrones que un gas noble.
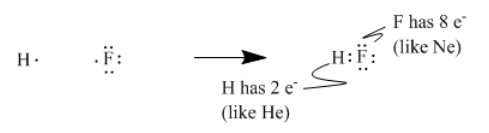
- cuando se encuentra un átomo en una molécula, generalmente tiene el mismo número de electrones de valencia que el gas noble en la misma fila
- este recuento de electrones incluye electrones no compartidos así como electrones compartidos
- para el conteo de electrones, los pares compartidos se cuentan para ambos átomos que comparten los electrones
El hecho de que la química orgánica y biológica, que constituye una mayoría de moléculas familiares, tenga lugar principalmente en la segunda fila de la tabla periódica permite pensar en el modelo de Lewis como “la regla del octeto”, a partir de la palabra latina para ocho: los elementos de la segunda fila forman enlaces para que puedan tener ocho electrones de concha de valencia, como el neón.
- moléculas biológicas u orgánicas más comunes están hechas de átomos en la segunda fila de la tabla periódica
- es común ver átomos con 8 electrones, como el neón, en muchas moléculas
- la regla del “octeto” de Lewis dice que los átomos frecuentemente tienen 8 electrones de valencia en las moléculas
- los átomos en otras filas a veces tienen un mayor número de electrones
Las estructuras de Lewis son dibujos que utilizamos para mostrar cómo los electrones en una molécula están dispuestos de manera estable. Nos permiten verificar que cada átomo de la molécula tiene un octeto.
Tenga en cuenta que un par de electrones que forma un enlace generalmente se escribe como una línea en lugar de un par de puntos. Esta modificación de una estructura de Lewis a veces se llama estructura Kekule. En su mayor parte, las estructuras Kekule serán utilizadas en estas páginas.
Intente dibujar estructuras Kekule para las siguientes moléculas diatómicas:
a) Cl 2 b) H 2 c) HCl d) F 2
- Contestar
-
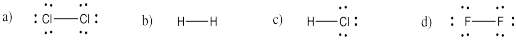
¿Qué sucede si un compuesto es realmente un ion? Una carga positiva o negativa te dice algo sobre la estructura. Si hay una carga negativa debe haber un electrón extra en la estructura, para que la relación protón:electrón ya no esté equilibrada. Si la carga es de dos menos, debe haber dos electrones adicionales. Por la misma razón, una carga positiva significa que falta un electrón en la estructura.
- una carga negativa significa electrón (s) extra (s)
- una carga positiva significa electrón (s) faltante (s)
Intente dibujar estructuras Kekule para los siguientes iones:
a) HO - b) MgCl + c) SA - d) OCl -
- Contestar
-