10.1: Un Sólido de Red - Diamante
- Page ID
- 80620
Algunos materiales no entran en ninguna de las categorías que hemos visto hasta ahora. No son metales, por lo que no pueden describirse como celosías de iones idénticos rodeados de electrones deslocalizados. No son sólidos iónicos, por lo que no pueden ser pensados como matrices de un tipo de ion con los contraiones empaquetados en los agujeros intersticiales para equilibrar la carga. No son moléculas, así que no las dibujaríamos como colecciones discretas y autónomas de átomos conectados.
El diamante, por ejemplo, es un sólido de red. El diamante es un alótropo de carbono, es una de las varias formas de carbono elemental que se encuentran en la naturaleza. Se ve algo así, a escala atómica. Las líneas son enlaces entre los átomos de carbono. Cada átomo de carbono forma cuatro enlaces, uno a cada uno de cuatro vecinos diferentes.
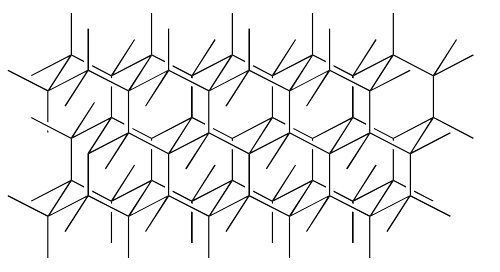
El diamante está compuesto enteramente de átomos de carbono, pero el carbono es demasiado electronegativo para permitir que sus electrones se deslocalicen completamente en un mar de electrones, como lo hacen los elementos metálicos. Forma una estructura cristalina, sólida, pero no se disuelve ni un poquito en agua como lo harían los compuestos iónicos, porque no tiene iones para formar interacciones ión-dipolo con las moléculas de agua. Forma enlaces covalentes con sus átomos vecinos, compartiendo estos electrones en lugar de intercambiarlos, pero forma un sólido extendido en lugar de unidades individuales.
- Los sólidos de la red son como moléculas porque tienen enlaces covalentes que conectan sus átomos.
- Los sólidos de la red son diferentes a las moléculas porque no tienen un tamaño limitado o específico; sus estructuras pueden extenderse “aparentemente para siempre” en la escala atómica.
¿Qué sabe la mayoría de la gente sobre los diamantes? Son muy caros, claro. Son muy brillantes. Son muy, muy duros. De hecho, existe una escala utilizada por los minerólogos para describir la dureza de los materiales llamada “Escala de dureza de Mohs”. La escala fue desarrollada por el geólogo alemán Friedrich Mohs a principios del siglo XIX, simplemente coloca diez minerales diferentes en orden de los más suaves a los más duros y asigna a cada uno de ellos un número. El diamante es un 10, lo que significa que es el material más duro de la escala. El diamante es, de hecho, la sustancia natural más dura del mundo.
| Mineral | Dureza |
|---|---|
| talco | 1 |
| yeso | 2 |
| calcita | 3 |
| fluorita | 4 |
| apatita | 5 |
| ortoclasa | 6 |
| cuarzo | 7 |
| topacio | 8 |
| corindón | 9 |
| diamante | 10 |
La escala de Mohs es cualitativa, no cuantitativa; cada mineral en la escala es más duro que el anterior. La escala de Mohs ha sido ampliamente utilizada por los geólogos de campo debido a su simplicidad. Si recoges un mineral y puedes rayarlo con ese diamante que guardas en tu caja de herramientas, pero el corindón no deja marca, entonces la dureza de la nueva muestra es de alrededor de 9.
Ejercicio\(\PageIndex{1}\)
Clasificar los siguientes minerales usando la escala de Mohs.
- grafito, que raya el talco pero en sí mismo está rayado por yeso
- stishovita, que puede rayar corindón pero no diamante; diamante rasguña stishovita
- ópalo, que raya la ortoclasa y la fluorita pero no el cuarzo ni el topacio
- obsidiana, que puede ser rayada por cuarzo y ortoclasa pero no apatita; la obsidiana no raya apatita, tampoco
- rubí, que está rayado por el diamante; sin embargo, ni el corindón ni el rubí pueden rayarse entre sí.
- esmeralda, que puede ser rayada por rubí y topacio pero rasguña cuarzo
- Respuesta a:
-
el grafito está entre 1 y 2
- Respuesta b:
-
stishovita está entre 9 y 10
- Respuesta c:
-
ópalo es entre 6 y 7
- Respuesta d:
-
la obsidiana es de aproximadamente 5
- Respuesta e:
-
ruby es alrededor de 9
- Respuesta f:
-
esmeralda es entre 7 y 8
Ejercicio\(\PageIndex{2}\)
La “dureza absoluta” se puede medir de varias maneras. Por ejemplo, una muestra se puede marcar con una aguja de diamante usando presión cuidadosamente controlada, y se puede medir el ancho o profundidad de la puntuación para obtener una comparación cuantitativa de la dureza de diferentes materiales.
Trazar la dureza de cada material según la escala de Mohs en el eje x y la dureza determinada por una prueba de esclerómetro para ver la relación entre la escala de Mohs y la dureza absoluta.
|
material |
dureza |
|---|---|
| talco | 1 |
| yeso | 3 |
| calcita | 9 |
| fluorita | 21 |
| apatita | 48 |
| ortoclasa | 72 |
| cuarzo | 100 |
| topacio | 200 |
| corindón | 400 |
| diamante | 1600 |
¿Qué hace que el diamante sea tan duro? Comparémoslo con algunos de los minerales más blandos de la escala. El yeso es un hidrato cristalino de sulfato de calcio: CaSO 4 . 2H 2 O. La calcita es una forma mineral del carbonato de calcio: CaCo 3. La fluorita está compuesta por fluoruro de calcio: CaF 2.
Estos materiales son todos sólidos iónicos. El yeso contiene cationes de calcio y aniones sulfato, así como agua ligada. La calcita contiene iones de calcio e iones de carbonato. La fluorita contiene iones calcio e iones fluoruro. Seguramente los enlaces iónicos que mantienen unidos estos iones son muy fuertes. ¿Por qué se pueden deformar y rayar?
Un enlace iónico no es direccional. No importa si un ion sulfato está por encima o por debajo de un ion calcio, o a la izquierda o a la derecha del mismo. La atracción entre los iones sigue siendo la misma.
Si imaginamos una fuerza de cizallamiento sobre un cristal de sulfato de calcio, lo que significa que estamos empujando contra una sola capa del material cristalino, entonces podríamos ver que esa capa se desliza en respuesta a la fuerza. A medida que los iones en esa capa se deslizan, comienzan a perder su atracción por los iones en la capa debajo de ellos, pero luego se sienten atraídos por nuevos iones que se deslizan hacia. Cuando terminamos, todavía tenemos un sólido iónico en el que los iones se atraen a contraiones a su alrededor, pero los socios han cambiado.
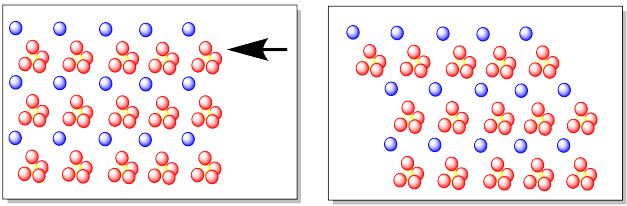
No podemos hacer eso en diamante porque los átomos de carbono están todos unidos covalentemente entre sí. Los electrones en esos enlaces parecen estar localizados en regiones particulares del espacio alrededor de los átomos de carbono, formando un marco de tetraedros. Ese marco fuerte mantiene a cada átomo de carbono en su lugar con cuatro enlaces, por lo que es difícil desplazar cualquier átomo o capa de átomos.
Silicio: un análogo de carbono
El silicio se encuentra debajo del carbono en la tabla periódica. En consecuencia, tiene algunas similitudes químicas con su vecino. Por ejemplo, el silicio puro adopta una estructura que es muy similar a la del diamante.
El silicio elemental, Si, es indispensable para la electrónica moderna ya que, en presencia de trazas de impurezas, tiene propiedades semiconductoras. Sin embargo, el silicio elemental realmente no existe en la naturaleza. Debe pasar por reducción química de sílice, SiO 2, en un horno de arco eléctrico:
\[\ce{SiO2 + 2C -> Si + 2CO}\]
El silicio resultante se purifica minuciosamente mediante una serie de procesos químicos. Por ejemplo, se puede convertir en SiCl4, que luego se purifica repetidamente por destilación para eliminar las impurezas traza, luego se vuelve a convertir en silicio por reducción con zinc:
\[\ce{SiCl4 + 2Zn -> Si + 2 ZnCl2}\]
Una de las etapas finales es la recristalización del silicio a partir de su fase fundida. Una varilla con una pequeña “semilla” de silicio puro se sumerge en el silicio fundido y se arrastra lentamente hacia arriba. A medida que el silicio fundido se enfría contra la superficie más fría de la varilla, se recristaliza. La varilla se tira lentamente hacia arriba, y el silicio puro continúa creciendo en el enfriador, el silicio cristalino se extrae de la masa fundida, formando un cristal largo.
Ejercicio\(\PageIndex{3}\)
Dibujar la estructura del silicio elemental.
Ejercicio\(\PageIndex{4}\)
La silicona no es lo mismo que el silicio. La silicona es una clase de polímero. Existe como cadenas largas y flexibles en las que el mismo grupo de átomos se repite una y otra vez. Hay muchos tipos de silicona, pero un ejemplo de una fórmula de silicona es ((CH 3) 2 SiO) n. El subíndice n significa que la unidad entre paréntesis se repite una y otra vez en una cadena.
- Dibuja una sección de silicona de varias unidades de largo.
- Explique cómo las estructuras del silicio y la silicona podrían darles propiedades físicas muy diferentes.

