3.3: Adición de enolato - Reacciones aldólicas
- Page ID
- 79442
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los iones enolatos son solo otro ejemplo de nucleófilos aniónicos de carbono. La razón por la que consiguen una página para sí mismos es que son especialmente importantes, sobre todo en química biológica. También son importantes en la síntesis de compuestos orgánicos, como en la industria farmacéutica.
Formación de iones enolados
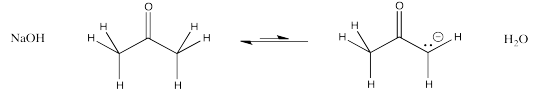
Un ion enolato es el anión que se forma cuando se elimina un protón junto a un carbonilo. El carbono al lado del carbonilo se llama la posición α (posición alfa). La posición alfa es ácida tanto por la cantidad de carga positiva sobre un protón en esa posición como por la estabilidad del anión que resulta si ese protón es eliminado.
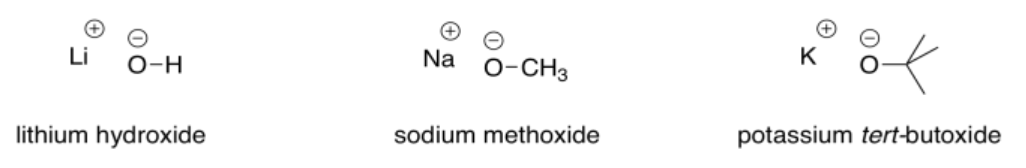
Es posible que hayas aprendido sobre hidróxidos metálicos como el hidróxido de sodio y el hidróxido de litio. El enlace metal-oxígeno es iónico debido a la gran diferencia de electronegatividad entre el metal y el oxígeno. Estos compuestos dan lugar a iones hidróxido. Esos iones hidróxido son básicos porque pueden captar fácilmente protones para convertirse en moléculas de agua neutras. Los hidróxidos metálicos se ven comúnmente en la química, y se consideran bases fuertes.
Otros aniones de oxígeno también son capaces de actuar como bases fuertes, a menos que exista algún factor de resonancia que deslocalice el anión y lo haga menos reactivo. El ion metóxido y el ion butóxido también son bases fuertes comunes.
Ejercicio\(\PageIndex{1}\)
Mostrar por qué un ion enolato, como el que se forma a partir de 2-propanona, anterior, es particularmente estable.
- Responder
-

Ejercicio\(\PageIndex{2}\)
Mostrar un mecanismo, con flechas curvas, para la formación del ion enolato a partir de 2-propanona, arriba.
- Responder
-
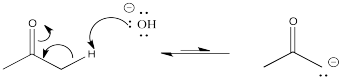
En el ejemplo anterior, la 2-propanona es desprotonada en la posición α para formar el ion enolato correspondiente. Tenga en cuenta que el hidróxido de sodio no es una base lo suficientemente fuerte como para convertir toda la 2-propanona en su enolato. El enolato resultante es lo suficientemente básico como para extraer un protón de una molécula de agua, por lo que resulta un equilibrio.
Ese sería el caso cada vez que se usara una base fuerte como un hidróxido o un alcóxido para desprotonar una cetona o aldehído. En el siguiente ejemplo con pentanal, la reacción también daría como resultado un equilibrio entre los reactivos y los productos.

Eso significa que todos esos compuestos tanto en el lado izquierdo como en el lado derecho de la flecha estarían presentes como una mezcla.
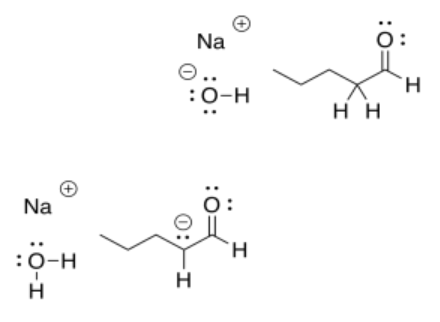
Las cargas negativas son bastante estables en los átomos de oxígeno. Eso permite que esta reacción en particular se desvíe nuevamente hacia la izquierda, para volver a formar ese ion hidróxido. Para que la reacción vaya hasta la derecha, necesitaríamos un anión menos estable a la izquierda. Eso haría más básico ese anión. ¿Se te ocurren átomos que serían menos estables como aniones que oxígeno?
Las bases muy fuertes más utilizadas en la química sintética involucran aniones de carbono, nitrógeno o hidrógeno. Algunos ejemplos de compuestos utilizados como bases muy fuertes son hidruro de sodio (NaH), amida de sodio (NaNH 2), diisopropilamida de litio (LiN [CH (CH (CH 3) 2] 2, también llamada LDA para abreviar) y butillitio (CH 3 CH 2 CH 2 CH 2 CH 2 Li, abreviado BULi).
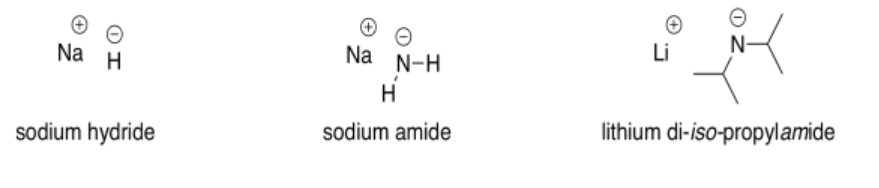
En todos estos compuestos, la carga negativa se encuentra en un elemento menos electronegativo que el oxígeno del ion hidróxido. Eso significa que son menos estables y tienen más reacción que el hidróxido.
Si una de estas bases reaccionara con un aldehído o cetona, el protón se eliminaría irreversiblemente. El ion enolato deslocalizado es en realidad más estable que el ion amida original en amida sódica, por ejemplo.

Como consecuencia, agregar una base muy fuerte a un aldehído o cetona da como resultado la conversión completa en productos. Al final de la reacción, no quedan reactivos.
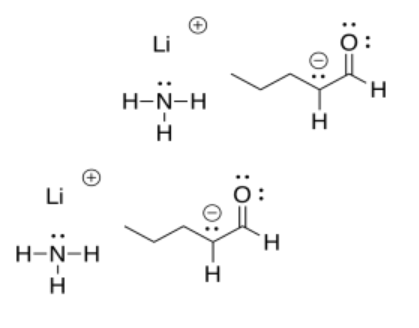
En contraste, una “base fuerte” como el hidróxido de sodio realmente no hará el trabajo. Si lo hiciera, estaríamos negociando un anión en un átomo más electronegativo (oxígeno) por un anión en un átomo menos electronegativo (carbono) en la misma fila de la tabla periódica. Eso no es posible. El anión enolato que se forma sería más básico que el hidróxido con el que comenzamos, y la mayoría de las veces simplemente arrebataría nuevamente el protón del agua, haciendo cetona e hidróxido nuevamente.
- Los iones enolato se forman en equilibrio con sus compuestos carbonílicos originales si se usa una base moderadamente fuerte como el hidróxido de sodio.
- Una base muy fuerte, como amida de sodio (NaNH 2), butillitio (CH 3 CH 2 CH 2 CH 2 Li, o BuLi) o hidruro de sodio (NaH), daría como resultado la formación completa de enolato.
Sin embargo, a veces es realmente útil tener un equilibrio entre un compuesto carbonilo y su enolato. Esa situación permite que tanto una cetona (la 2-propanona, izquierda) como su enolato (derecha) estén presentes al mismo tiempo. Eso significa que hay tanto un nucleófilo como un electrófilo (la cetona y el enolato). Podrán reaccionar juntos.

- Los carbonílicos simples son electrófilos.
- Los iones enolados que se forman a partir de carbonilos simples son nucleófilos.
- Los carbonilo reaccionan con iones enolatos.
Si bien estamos en el tema de bases, existe una tercera categoría de compuestos que consideraríamos bases débiles. Los ejemplos más comunes son aminas (pero no amidas) y aniones de oxígeno estabilizados por resonancia.
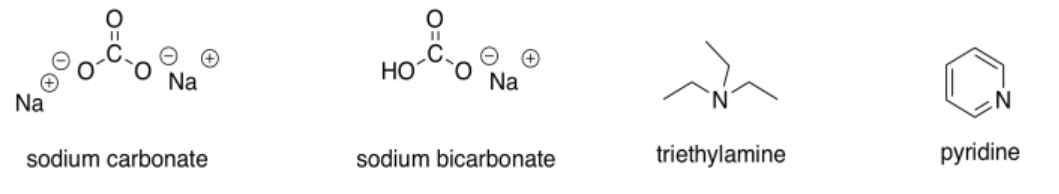
Estos compuestos serían buenos para recoger el exceso de protones que flotaban alrededor. Sin embargo, en la mayoría de los casos no serían bases lo suficientemente fuertes como para proporcionar una cantidad apreciable de ion enolato.
Ejercicio\(\PageIndex{3}\)
Identificar los siguientes compuestos como bases débiles, fuertes o muy fuertes.
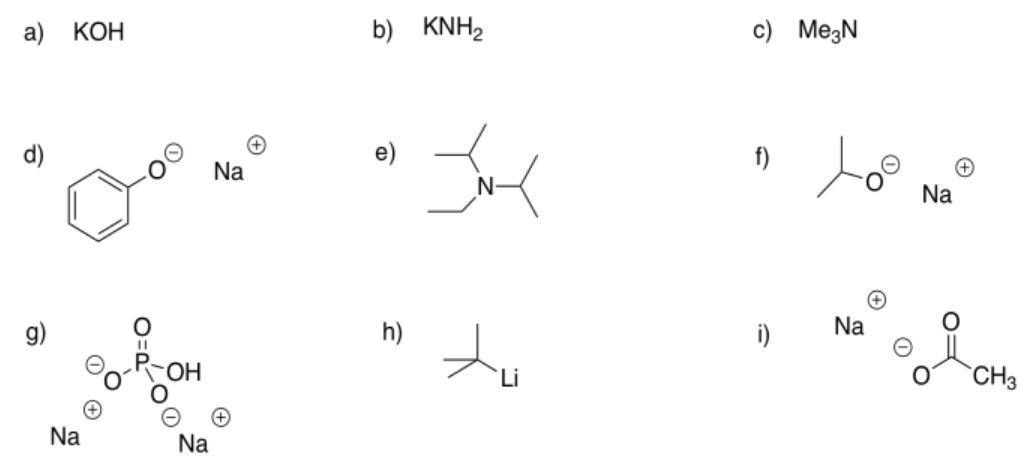
- Responder
- Responder a
-
muy fuerte
- Respuesta b
-
muy fuerte
- Respuesta c
-
débil
- Respuesta d
-
débil
- Respuesta e
-
débil
- Respuesta f
-
fuerte
- Respuesta g
-
débil
- Respuesta h
-
muy fuerte
- Respuesta i
-
débil
Reacciones aldólicas: adición de enolatos a electrófilos de carbonilo
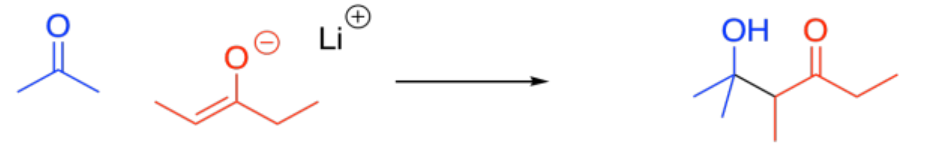
La reacción de un nucleófilo enolado con otro compuesto carbonilo se denomina reacción aldólica. Aquí se muestra un ejemplo sencillo de esta reacción. Este ejemplo implica la reacción de 2-propanona con su enolato.
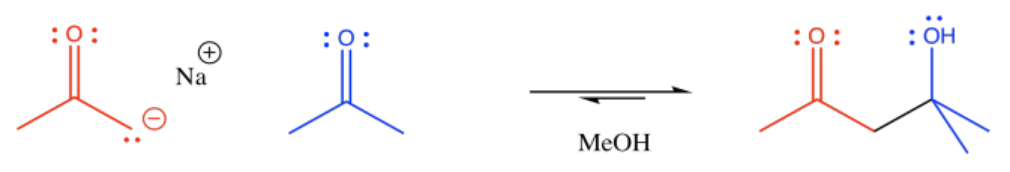
Anote el patrón en el producto. El carbonilo del enolato está conectado al carbono del enolato que está conectado al carbono del alcohol.
Ejercicio\(\PageIndex{4}\)
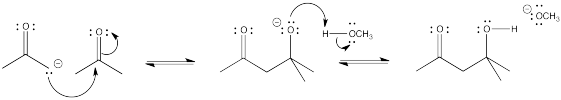
Proporcionar un mecanismo, con flechas curvas, para la reacción aldólica de la 2-propanona, arriba.
- Responder
-
La biosíntesis de azúcares, como la fructosa, implica acoplar azúcares más pequeños entre sí. Si un azúcar se convierte en nucleófilo, puede donar electrones al carbonilo en el otro azúcar, formando un nuevo enlace C-C. El carbonilo en el segundo azúcar se convierte en un grupo hidroxilo en el nuevo azúcar más grande.
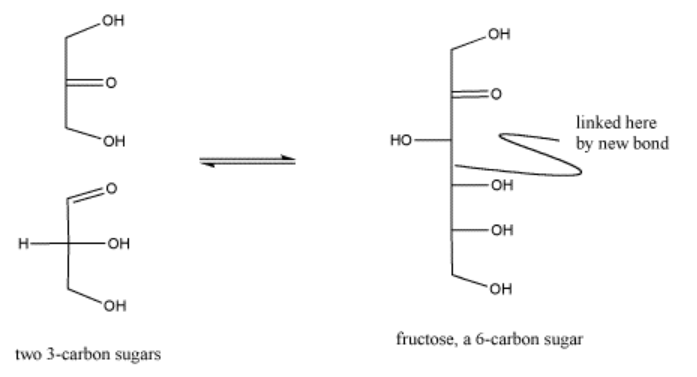
En la célula, los azúcares suelen estar en forma fosforilada cuando reaccionan de esta manera. La fosforilación es a menudo un paso importante en la activación de moléculas para reacciones bioquímicas.
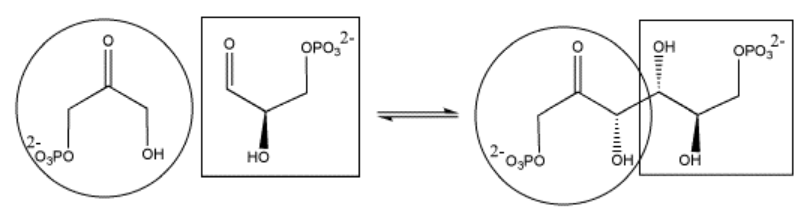
Ejercicio\(\PageIndex{5}\)
Mostrar el mecanismo para la formación de la fructosa fosforilada mostrada anteriormente.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Variación A: Condensación de Aldol
En ocasiones, las reacciones aldólicas van seguidas de una reacción posterior, llamada reacción de eliminación. Esa reacción produce formalmente una molécula de agua. Los primeros estudios de esta reacción resultarían en gotitas de condensación sobre la cristalería en la que se produjo la reacción; de ahí que a veces se le llame reacción de condensación.
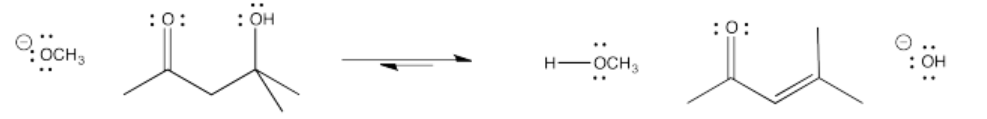
El término “condensación” proviene del hecho de que la reacción da como resultado formalmente la pérdida de una molécula de agua de las posiciones alfa y beta (H de alfa y OH de beta). Las reacciones tempranas que se observaron como resultado de pérdida de agua se describieron frecuentemente como condensaciones debido a las gotas de agua que aparecerían en la cristalería (literalmente, condensación) a medida que avanzaba la reacción. También se utiliza el término “deshidratación” para describir esta pérdida de agua.
Sin embargo, no te ates demasiado a las descripciones de las reacciones (condensación vs. adición). Los términos se utilizan de forma floja y a veces se intercambian. En esta página, tratamos de usar adición para describir el producto inicial y la condensación para describir el producto después de la pérdida de agua, pero fuentes en otros lugares podrían no describirlo de esa manera.
Ejercicio\(\PageIndex{6}\)
Proporcionar un mecanismo para la etapa de deshidratación en la condensación aldólica mostrada anteriormente.
- Responder
-

Puede ser difícil predecir el resultado de una reacción aldólica debido a que hay dos posibles productos de una reacción aldólica (uno con un nuevo hidroxilo y otro con un nuevo doble enlace). Un químico podría intentar hacer un producto en el laboratorio, y terminar con el otro. Este proceso puede ser difícil de controlar. Sin embargo, en general, la reacción de eliminación se fomenta calentando la reacción. La reacción a veces ocurre sin eliminación si la reacción se mantiene fría. No obstante, también hay otros factores que pueden entrar en juego.
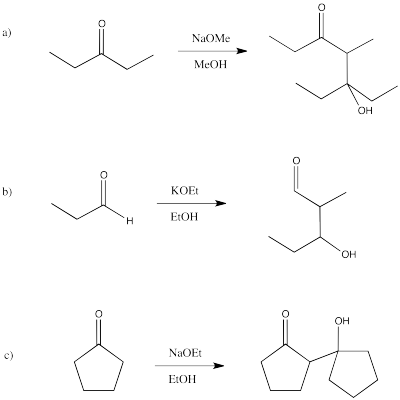
Ejercicio\(\PageIndex{7}\)
Predecir los productos de las siguientes reacciones aldólicas.
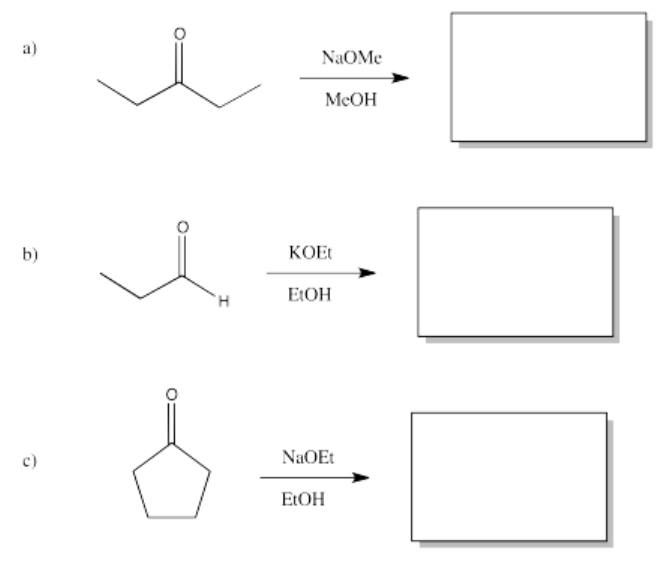
- Responder
-
Ejercicio\(\PageIndex{8}\)
El siguiente compuesto daría múltiples productos a través de diferentes reacciones de condensación aldólica. Mostrar los productos.
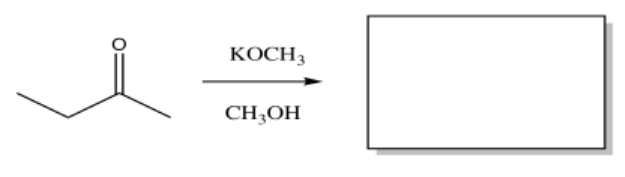
- Responder
-
A veces, dos compuestos diferentes pueden reaccionar juntos en una reacción aldólica. Un compuesto actúa como nucleófilo, y el otro actúa como electrófilo. Sin embargo, la reacción realmente no es muy diferente a las reacciones aldólicas que ya hemos visto.
La única complicación es que ahora hay dos compuestos diferentes que potencialmente podrían ser nucleófilos y dos compuestos diferentes que potencialmente podrían ser electrófilos. Eso dificulta un poco más la predicción del resultado de la reacción.
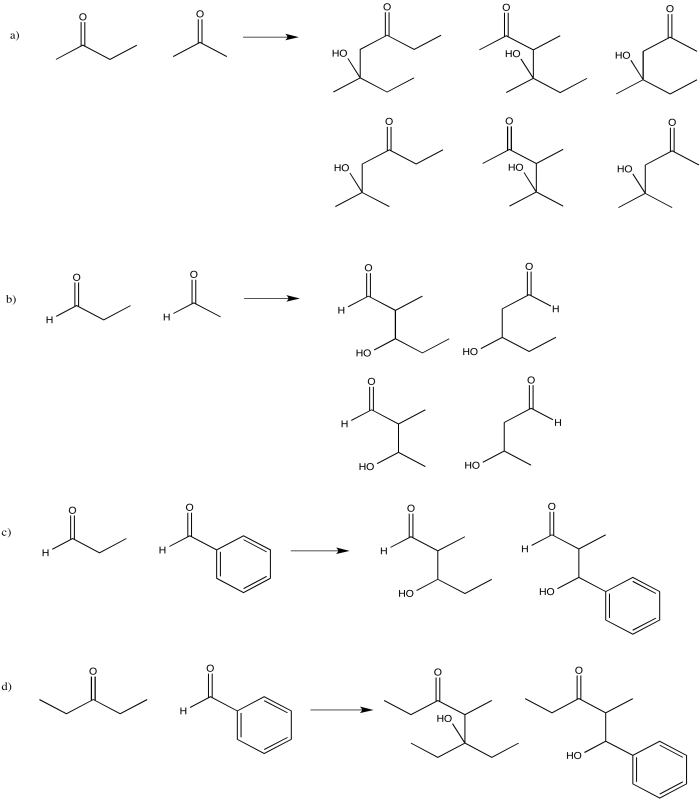
Ejercicio\(\PageIndex{9}\)
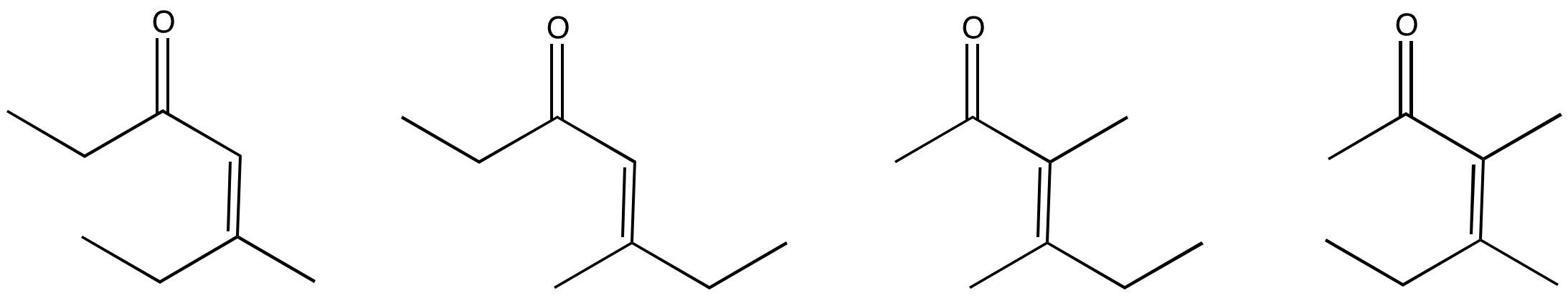
Los siguientes compuestos darían múltiples productos a través de diferentes reacciones de condensación aldólica. Mostrar los productos.
- Responder
-
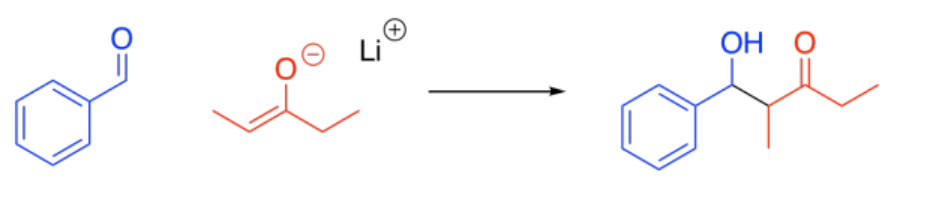
Hay casos en los que se vuelve mucho más obvio qué compuesto sería el electrófilo y cuál sería el nucleófilo. A lo mejor uno de los compuestos tiene un carbonilo que está mucho menos abarrotado que el otro. Por ejemplo, tal vez un compuesto es un aldehído y el otro es una cetona. El carbonilo menos abarrotado es mucho más probable que actúe como un buen electrófilo.
A lo mejor uno de los compuestos ni siquiera tiene protones alfa. En ese caso, no se puede desprotonar y no puede formar un anión enolato. No podrá actuar como el nucleófilo.
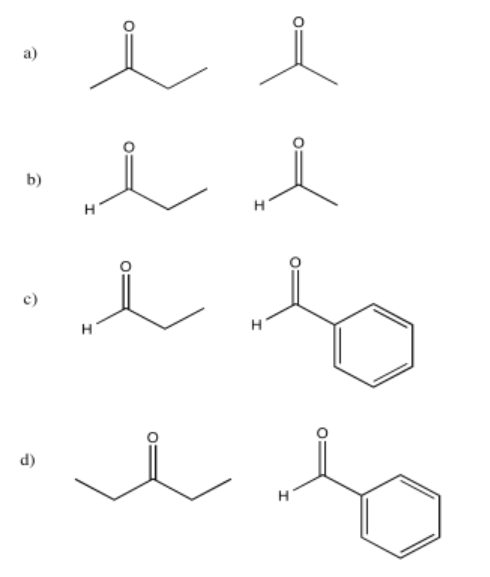
Ejercicio\(\PageIndex{10}\)
Solo algunos de los siguientes compuestos pueden sufrir reacciones aldólicas. Seleccionar cuáles pueden no sufrir la reacción, y explicar qué factor les impide reaccionar.
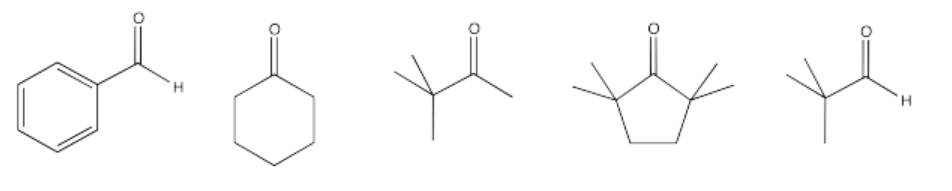
- Responder
-
Algunos de estos compuestos no tienen protones alfa, por lo que no pueden formar iones enolados.
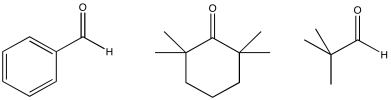
Ejercicio\(\PageIndex{11}\)
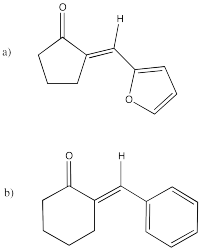
Rellene los productos de las siguientes condensaciones aldólicas.
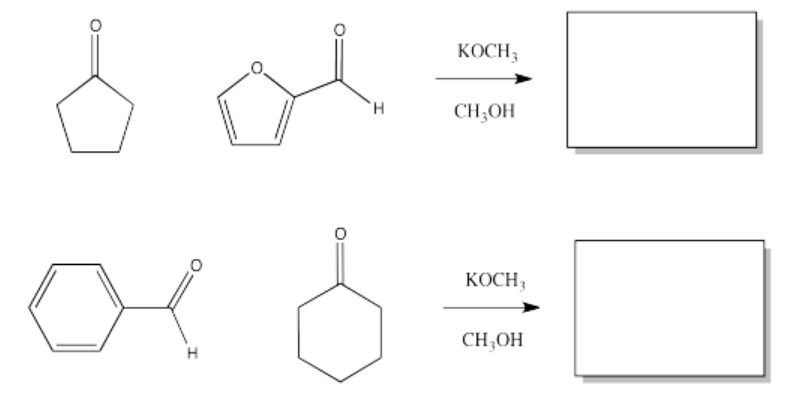
- Responder
-
Sin embargo, las reacciones aldólicas no solo ocurren con aniones enolados. Los enoles son la forma neutra de los enolatos, protonados sobre el oxígeno en lugar del carbono alfa. Los enoles también son buenos nucleófilos. En un nucleófilo enol, el enlace pi actúa como la fuente de electrones, en lugar del par solitario. Sin embargo, el enlace pi recibe un impulso del par solitario en el oxígeno.
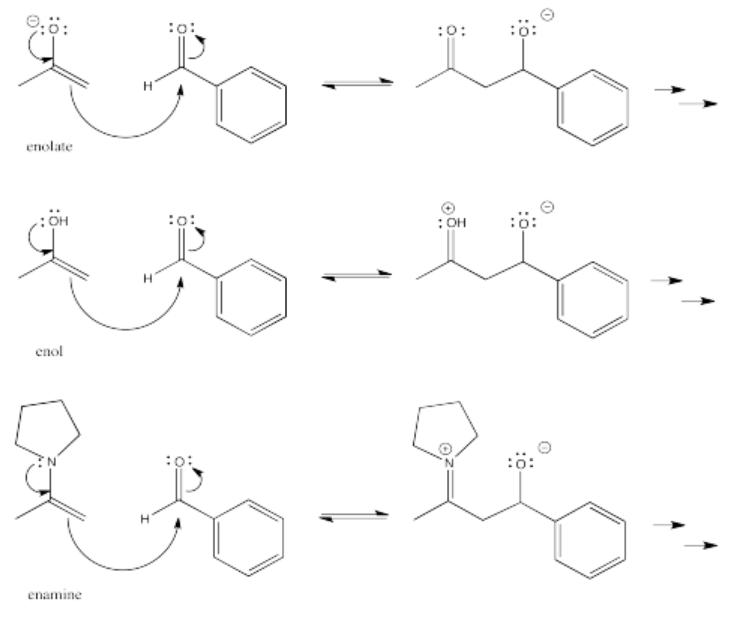
Los enoles siempre están presentes en equilibrio con aldehídos y cetonas. Un enol es un simple tautomero de un compuesto carbonilo. Para llegar de uno a otro, un protón simplemente se transfiere de una posición a otra.
- Las enaminas y enoles también son buenos nucleófilos para las reacciones aldólicas.
- Debido a que el ácido o la base pueden catalizar el tautomerismo ceto-enol, las reacciones aldólicas pueden ser catalizadas por ácido o base.
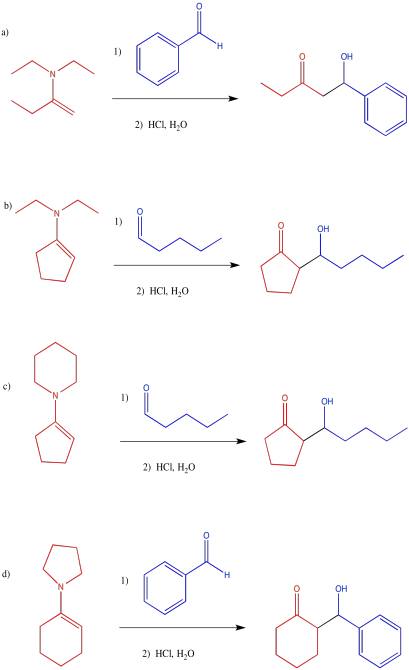
Ejercicio\(\PageIndex{12}\)
Mostrar el paso de protonación posterior en las reacciones que involucran el enol y la enamina anteriores.
- Responder
-
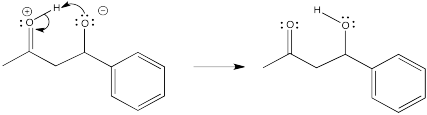
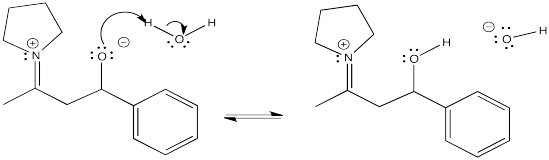
Ejercicio\(\PageIndex{13}\)
Una reacción enamina suele ir seguida de hidrólisis del enlace C=N en el ión iminio. Mostrar el mecanismo de conversión del ión iminio al carbonilo mediante la adición de ácido acuoso.
- Responder
-
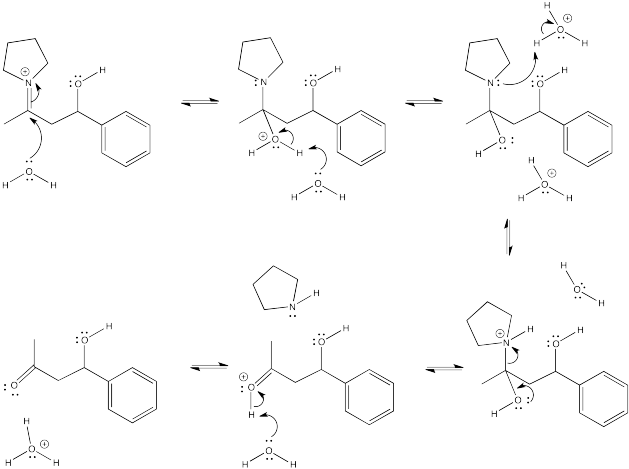
Ejercicio\(\PageIndex{14}\)
¿Qué condiciones serían más probables para formar este producto aldólico (seleccione a, b, c o d a continuación)?
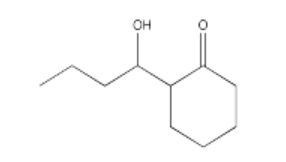
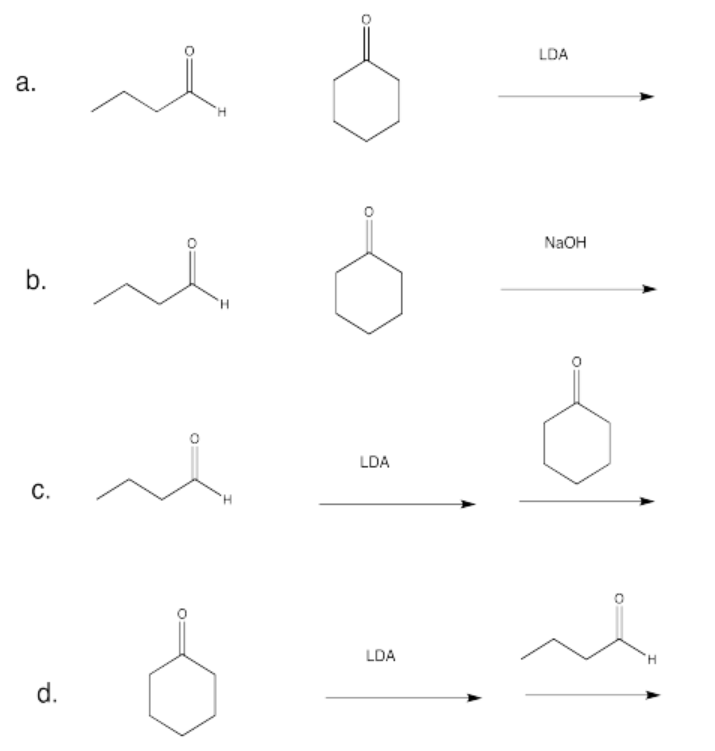
- Responder
-
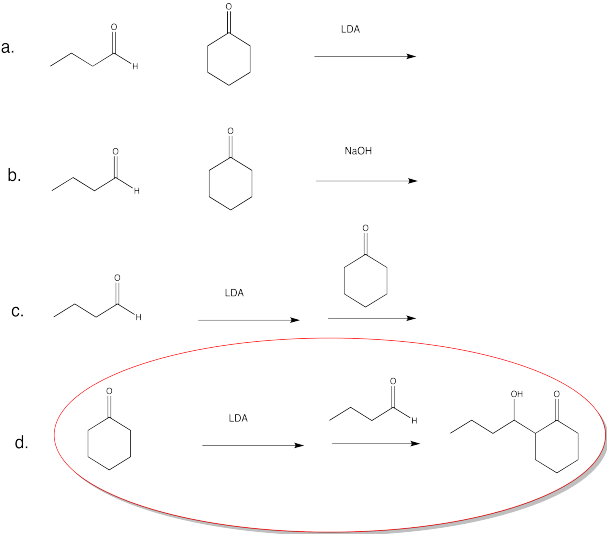
Ejercicio\(\PageIndex{15}\)
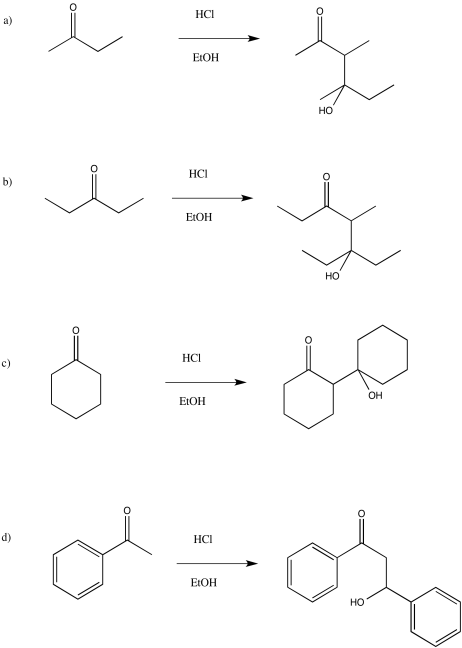
Proporcionar productos de las siguientes reacciones aldólicas catalizadas por ácido.
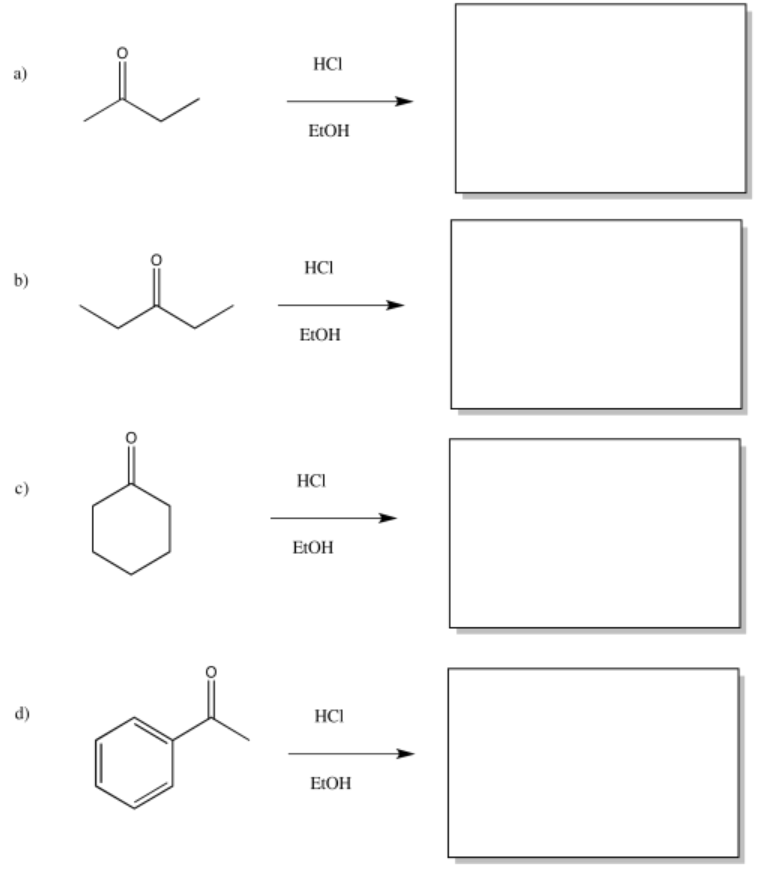
- Responder
-
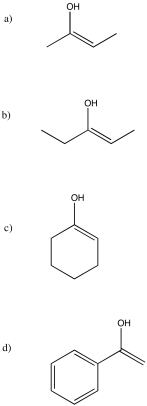
Ejercicio\(\PageIndex{16}\)
Dibuja los nucleófilos enoles para la pregunta anterior.
- Responder
-
Ejercicio\(\PageIndex{17}\)
Proporcionar los productos de las siguientes adiciones de enamina, después de la hidrólisis.
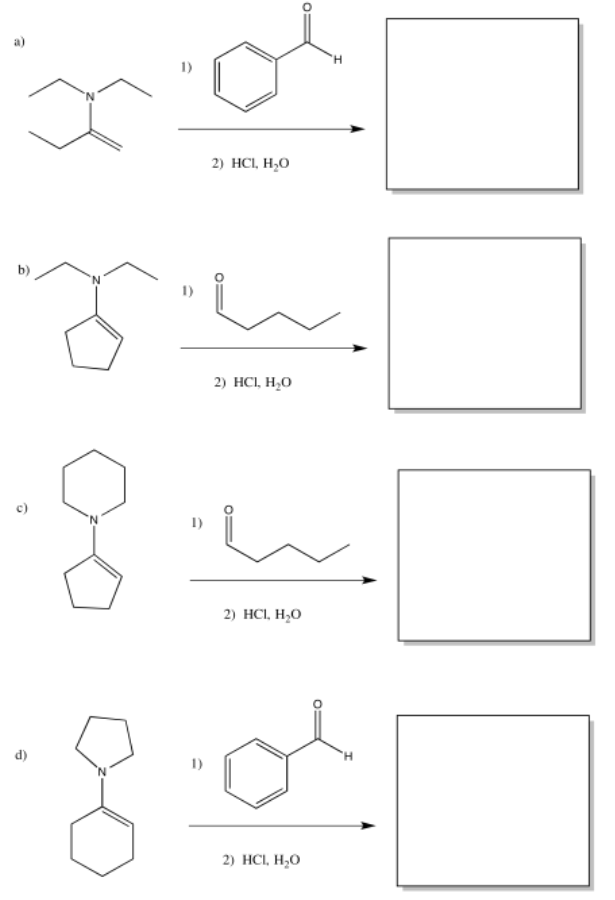
- Responder
-