1.14: Soluciones a problemas seleccionados
- Page ID
- 79192
Ejercicio 1.1.1:
a) Ag + b) Ni 2+ c) Mn 7+ d) Cr 6+ e) Cu 3+ f) Fe 3+ g) Os 8+ h) Re 5+
Ejercicio 1.1.3:
a) Pb 2+ y S 2- b) Sn 4+ y 2 O 2- c) Hg 2+ y S 2- d) Fe 4+ y 2 S 2- e) 2 Fe 3+ y 3 O 2- f) 2 Fe 3+ y 1 Fe 2+ y 4 O 2-
Ejercicio 1.1.4:
Probablemente Fe 2+, para reemplazar iones Zn 2+.
Ejercicio 1.1.5:
a) C 2+ b) C 4+ c) 4- d) C 0 e) C 3+
Ejercicio 1.1.7:
a) Mg 2+ b) Cu 2+ c) Mn 3+ d) Ca 2+ e) Mn 2+ f) Mn 2+
Ejercicio 1.1.8:
a) Cu (II), Fe (II) b) Zn (II), Fe (III) c) Be (II), Al (III) d) Cu (I), Fe (III) e) Cu (II), Al (III)
Ejercicio 1.2.1:
- \(\ce{Cu -> Cu^{+} + e^{-}}\)
- \(\ce{Fe^{3+} + 3e^{-} -> Fe}\)
- \(\ce{Mn -> Mn^{3+} + 3e^{-}}\)
- \(\ce{Zn^{2+} + 2e^{-} -> Zn}\)
- \(\ce{2F^{-} -> F2 + 2e^{-}}\)
- \(\ce{H2 + 2H^{+} + 2e^{-}}\)
Ejercicio 1.2.2:
- \(\ce{ Cu(I) + Fe(III) -> Cu(II) + Fe(II)}\)
- \(\ce{Cu(I) + Ag(0) -> Cu(0) + Ag(I)}\)
- \(\ce{3F2 + 2Fe -> 6F^{-} + 2Fe(III)}\)
- \(\ce{2Mo^{3+} + 3Mn -> 2Mo + 3Mn^{2+}}\)
Ejercicio 1.2.3:
- \(\ce{MnO2 + 2H^{+} + 2e^{-} -> Mn(OH)2}\)
- \(\ce{2NO + 2e^{-} + 2H^{+} -> N2O + H2O}\)
- \(\ce{HPO3^{2-} + 2e^{-} + 3H^{+} -> H2PO2^{-} + H2O}\)
- \(\ce{Sn(OH)6^{2-} + 2e^{-} + 3H^{+} -> HSnO2^{-} + 4H2O}\)
Ejercicio 1.2.4:
a) si b) no c) si d) no e) si f) si g) si h) no
Ejercicio 1.2.5:
- \(E_{rxn} = -0.153V-0.33V=-0.483V\)
- No.
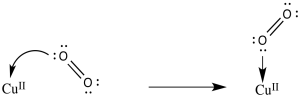
d) El O 2 se activa como electrófilo. La adición de un electrón puede ser más fácil.
e) El potencial de reducción es 0.2 V más positivo cuando el ion superóxido resultante se estabiliza mediante la unión de un protón. Un cambio similar podría ocurrir cuando se coordina al cobre.
f)
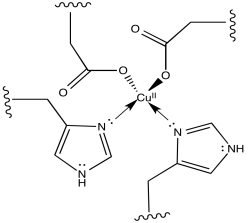
g) Los dos iones aspartato harían que el complejo de cobre fuera menos catiónico. Eso puede facilitar la eliminación de un electrón del complejo de cobre.
Ejercicio 1.2.6:
- \(\ce{Fe^{2+} + ClO2 -> Fe^{3+} + ClO2^{-}}\)
- \(E_{rxn} = 0.95V - 0.77V = 0.18V\)
- Sí.
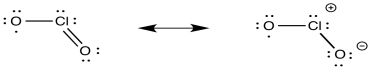
e) ClO 2 tiene un electrón desapareado. ClO 2 - tiene electrones emparejados
f) Podría ser esfera interna: el oxígeno en el ClO 2 podría coordinarse con el hierro.
g) La mezcla forma rápidamente (H 2 O) 5 Fe (ClO 2) 2+ a través de la transferencia de electrones de la esfera interna.
Ejercicio 1.3.1:
MnO 4 -:\(4 \times O^{2-} \: (=8^{-}) + Mn^{7+} = 1^{-}\) general
MnO 2:\(2 \times O^{2-} \: (=4^{-}) + Mn^{4+} =\) neutral en general
diferencia = 3 e -
Ejercicio 1.3.2:
a) SO 4 2-:\(4 \times O^{2-} \: (=8^{-}) + S^{6+} = 2^{-}\) general
S 2 O 8 2-:\(8 \times O^{2-} \: (=16^{-}) + 2 \times S^{7+} \: (=14^{+}) = 2^{-}\) general
diferencia = 1 e - por S, o 2 e - general
\[\ce{S2O8^{2-} + 2e^{-} -> 2SO4^{2-}} \nonumber\]
b) HPO 3 2-:\(3 \times O^{2-} \: (=6^{-}) + H^{+} + P^{3+} = 2^{-}\) general
P: P (0)
diferencia = 3 e -
\[\ce{HPO3^{2-} + 3e^{-} + 5H^{+} -> P + 3H2O} \nonumber\]
c) Ti 2 O 3:\(3 \times O^{2-} \: (=6^{-}) + 2 \times Ti^{3+} \: (= 6^{+})\) = neutral en general
TiO: O 2- + Ti 2+ = neutral general
diferencia = 1 e - por Ti, o 2 e - general
\[\ce{Ti2O3 + 2e^{-} + 2H^{+} -> 2TiO + H2O} \nonumber\]
d) N 2: N (0)
NH 2 OH:\(O^{2-} + 3 \times H^{+} \: (=3^{+}) + N^{-}\) = neutral general
diferencia = 1 e - por N, o 2 e - general
\[\ce{N2 + 2e^{-} + 2H^{+} + 2H2O -> 2NH2OH} \nonumber\]
Ejercicio 1.3.3:
El litio es un metal alcalino, en la primera columna de la tabla periódica. Tiene una energía de ionización relativamente baja debido a que tiene una configuración de gas noble como catión. Esa configuración de gas noble es estable debido al número relativamente grande de protones nucleares y a una distancia relativamente corta entre el núcleo y la capa más externa de electrones. En el metal de litio, el electrón más exterior está relativamente lejos del núcleo y por lo tanto está a una energía relativamente alta, y se pierde fácilmente.
Ejercicio 1.3.4
El flúor es un halógeno, con una afinidad electrónica relativamente alta. Gana fácilmente un electrón para llegar a una configuración de gas noble como anión fluoruro. Esa configuración de gas noble es estable debido al número relativamente grande de protones nucleares y a una distancia relativamente corta entre el núcleo y la capa más externa de electrones.
Ejercicio 1.3.5:
De la oxidación más fácil a la menos fácil de oxidar: Li > Al > Fe > Cu > Au
Ejercicio 1.3.6:
- \(E^{0} = + 0.796 (\frac{Ag^{+}}{Ag}) - 1.83 (\frac{Au}{Au^{+}}) = -1.034V\)(sin reacción hacia adelante)
- \(E^{0} = -0.44 (\frac{Fe^{2+}}{Fe}) + 0.762 (\frac{Zn}{Zn^{2+}}) = +0.0322V\)(reacción hacia adelante)
- \(E^{0} = +0.52 (\frac{Cu^{+}}{Cu}) + 3.04(\frac{Li}{Li^{+}}) = +3.56V\)(reacción hacia adelante)
- \(E^{0} = +0.77 (\frac{Fe^{3+}}{Fe^{3+}}) - 0.796(\frac{Ag}{Ag^{+}}) = -0.026V\)(sin reacción hacia adelante)
Ejercicio 1.3.7:
Cuando se muestra la tabla de potenciales de reducción estándar con el valor más negativo en la parte superior y el valor más positivo en la parte inferior, cualquier media reacción dada irá hacia adelante si se acopla con el reverso de una media reacción que se encuentra por encima de ella en la tabla. No es el caso contrario; ninguna media reacción irá hacia adelante si se acopla con el reverso de una media reacción por debajo de ella en la tabla.
Ejercicio 1.4.1:
a)
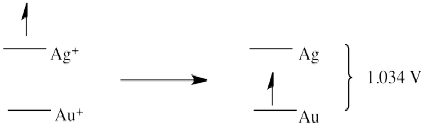
b)
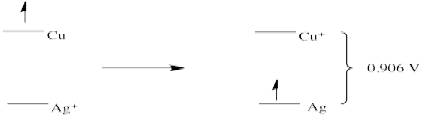
c)
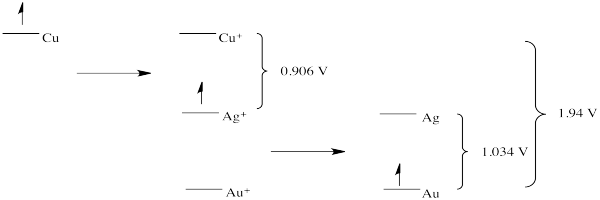
Ejercicio 1.4.2:
- \(\ce{2Li + F2 -> 2Li^{+} + 2F^{-}}\)
- E o = +5.91 V
- Las cosas se ven bastante sombrías.
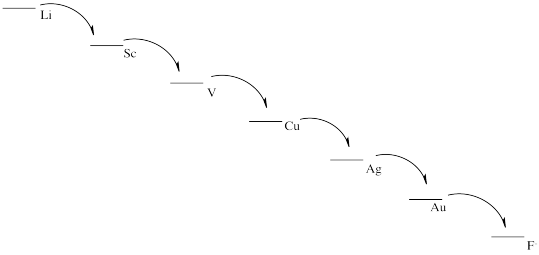
e) Este esquema resultaría en la liberación de una pequeña cantidad de energía en cada etapa. Cada paso podría aprovecharse para realizar una tarea de manera más eficiente, con menos pérdida de calor.
Ejercicio 1.4.3:

Ejercicio 1.4.4:

Ejercicio 1.4.5:
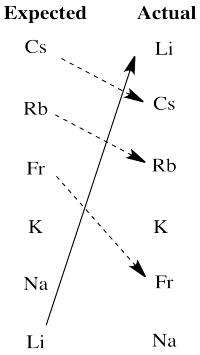
Realmente hay dos salidas significativas de la expectativa aquí. El litio es mucho más activo de lo esperado en base a la electronegatividad. Los metales alcalinos más grandes, el cesio, el rubidio y el francio, son todos menos activos de lo esperado sobre esa base.
Veremos que otro factor que influye en la actividad redox es la estabilidad de los iones en solución acuosa. El catión de litio es un ion pequeño; las moléculas de agua se unen muy fuertemente al ion porque los electrones se acercan relativamente al núcleo del litio. Esa fuerte unión estabiliza este ion especialmente, inclinando la malancia de la reacción más fuertemente hacia la oxidación del litio. Los iones de metales alcalinos más grandes no están tan estabilizados por los ligandos de agua en solución acuosa, por lo que el resto de sus reacciones no se inclina tan fuertemente hacia los iones acuosos.
Ejercicio 1.5.1:
Li + /Li:\(E^{0} = -3.04V\);\(\Delta H_{vap} = 147 \frac{kJ}{mol}\);\(IE = 520 \frac{kJ}{mol}\);\(\Delta H_{h} = -520 \frac{kJ}{mol}\)
Na + /Na:\(E^{0} = -2.71V\);\(\Delta H_{vap} = 97 \frac{kJ}{mol}\);\(IE = 495 \frac{kJ}{mol}\);\(\Delta H_{h} = -406 \frac{kJ}{mol}\)
K + /K:\(E^{0} = -2.931V\);\(\Delta H_{vap} = 77 \frac{kJ}{mol}\);\(IE= 419 \frac{kJ}{mol}\);\(\Delta H_{h} = -320 \frac{kJ}{mol}\)
El potasio debe ser el más fácil de los tres para oxidar. Es más fácil de oxidar que el sodio. Sin embargo, el alto calor de hidratación del litio revierte la tendencia y inclina el equilibrio de la reacción a favor de la formación de iones.
Ejercicio 1.5.2:
Cu 2+ /Cu:\(E^{0} = + 0.340V\);\(\Delta H_{vap} = 300 \frac{kJ}{mol}\);\(IE = 745 \frac{kJ}{mol} \& 1958 \frac{kJ}{mol}\);\(\Delta H_{h} = -2099 \frac{kJ}{mol}\)
Ni 2+ /Ni:\(E^{0} = -0.25V\);\(\Delta H_{vap} = 377 \frac{kJ}{mol}\);\(IE = 737 \frac{kJ}{mol} \& 1753 \frac{kJ}{mol}\);\(\Delta H_{h} = -2096 \frac{kJ}{mol}\)
Zn 2+ /Zn:\(E^{0} = -0.7618V\);\(\Delta H_{vap} = 123 \frac{kJ}{mol}\);\(IE = 906 \frac{kJ}{mol} \& 1733 \frac{kJ}{mol}\);\(\Delta H_{h} = -2047 \frac{kJ}{mol}\)
En este caso, el zinc puede considerarse el valor atípico. El cobre debería ser más fácil de reducir que el níquel basado únicamente en la electronegatividad. Sin embargo, el muy bajo calor de vaporización del zinc sugiere que la formación del metal sólido es menos favorecida en ese caso, ayudando a inclinar la balanza hacia el ion zinc en su lugar.
Ejercicio 1.5.3:
a)
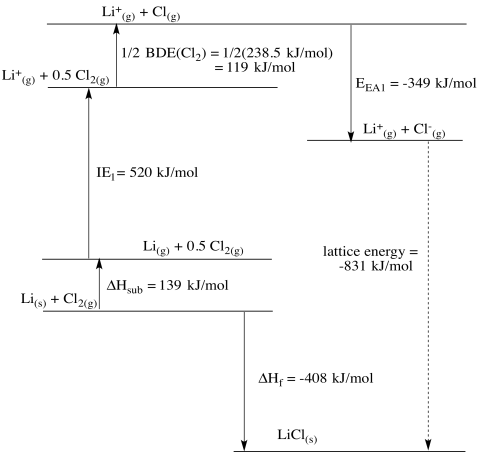
b)
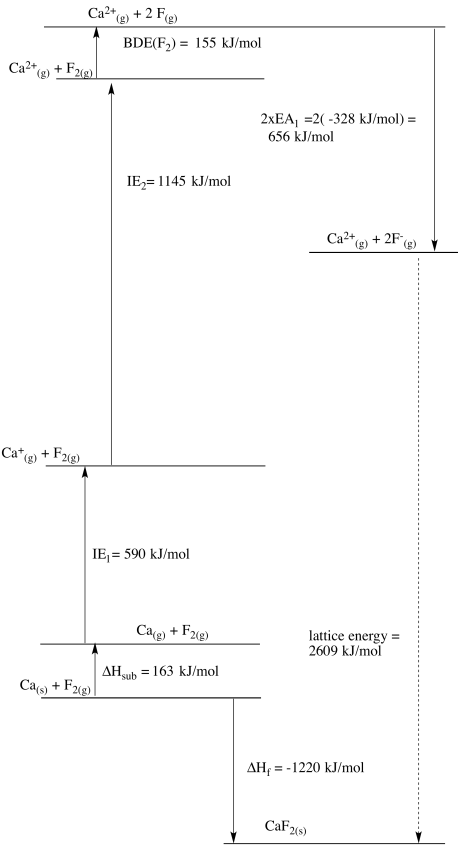
c)
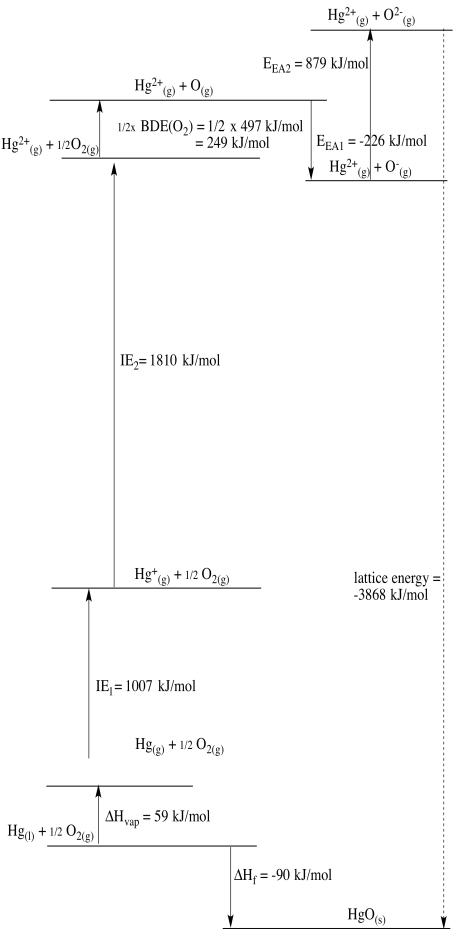
d)

Ejercicio 1.6.1:
Ambos potenciales de reducción son muy positivos.
\[\ce{Ag^{+} + e^{-} -> Ag (s)} \: E^{0} = + 0.796V \nonumber\]
\[\ce{Au^{+} + e^{-} -> Au (s)} \: E^{0} = +1.83V \nonumber\]
Eso significa que es probable que ambos metales se encuentren en el estado reducido.
Ejercicio 1.6.2:
\[\ce{SnO (s) + 2H^{+} + 2e^{-} -> Sn (s) + H2O} \: E^{0} = -0.10V \nonumber\]
\[\ce{CO (g) + H2O -> CO2 (g) + 2H^{+} + 2e^{-}} \: E^{0} = -(-0.11V) \nonumber\]
\[\ce{SnO (s) + CO (g) -> Sn (s) + CO2 (g)} \: \Delta E^{0} = + 0.01V \nonumber\]
Ejercicio 1.6.3:
\[\ce{Fe3O4 (s) + 8H^{+} + 8e^{-} -> 3Fe(s) + 4H2O} \: E^{0} = + 0.085V \nonumber\]
\[\ce{CO(g) + H2O -> CO2(g) + 2H^{+} + 2e^{-}} \: E^{0} = -(-0.11V) \nonumber\]
\[\ce{Fe3O4(s) + 4CO (g) -> 3Fe (s) + 4CO2 (g)} \: \Delta E^{0} = 0.195V \nonumber\]
Ejercicio 1.6.4:
\[\ce{Al^{3+}_{(aq)} + 3e^{-} -> Al(s)} \: E^{0}= -1.662V \nonumber\]
\[\ce{CO(g) + H2O -> CO2(g) + 2H^{+} + 2e^{-}} \: E^{0} = -(-0.11V) \nonumber\]
\[\ce{2Al^{3+} (aq) + 3CO (g) + 3H2O -> 2Al(s) + 3CO2 (g)} \: \Delta E^{0} = -1.772V \nonumber\]
Ejercicio 1.6.5:
\[\ce{Al^{3+} + 3e^{-} -> Al(s)} \: E^{0} = -1.662V \nonumber\]
\[\ce{2O^{2-} -> O2(g) + 4e^{-}} \: E^{0} = -(.40V, \: estimated) \nonumber\]
\[\ce{4Al^{3+}(aq) + 6O^{2-} (aq) -> 4Al (s) + 3O2 (g)} \: \Delta E^{0} = -2.062V \nonumber\]
Incluso si los iones de aluminio de la criolita se reducen a Al 0, se repondrán con nuevos iones de aluminio del mineral de bauxita.
Ejercicio 1.7.1:
\[\Delta G = -nFE^{0}_{cell} \nonumber\]
\[\Delta G = -2 \times 96485 \frac{J}{V \: mol} \times 1.43V \nonumber\]
\[\Delta G = -275947 \frac{J}{mol} = -276 \frac{kJ}{mol} \nonumber\]
Ejercicio 1.7.2:
\[\Delta G = -nFE^{0}_{cell} \nonumber\]
\[\Delta G = -2 \times 96485 \frac {J}{V \: mol} \times 1.3V \nonumber\]
\[\Delta G = -250861 \frac {J}{mol} = -251 \frac {kJ}{mol} \nonumber\]
Ejercicio 1.7.3:
\[\ce{Ag2O (s) + H2O + 2e^{-} -> 2 Ag (s) + 2OH^{-} (aq)} E^{0} = +0.342V \nonumber\]
\[\ce{Zn (s) -> Zn^{2+}(aq) + 2e^{-}} \: E^{0}= -(-0.762V) \nonumber\]
\[\ce{Ag2O (s) + H2O + Zn(s) -> 2Ag (s) + 2OH^{-} (aq) + Zn^{2+} (aq)} \: \Delta E^{0} = +1.104V \nonumber\]
Ejercicio 1.7.4:
a) Carga sobre complejo calculada de la siguiente manera:
carga en metal: 3+
carga en donantes de ligandos (4 N neutros, 2 donadores de N aniónicos): 2-
otras cargas en ligando (brazo carboxilato): 1-
en general: 0
b)\(\Delta GG = RT log K = RT (-pK_{a}) = -8.314 \frac{J} {K \: mol} \times 300K \times (-20.2) = 50382 \frac{J}{mol} = 50.4 \frac{kJ}{mol}\)
c) Es más difícil agregar el electrón al anión más cargado negativamente, por lo que el potencial de reducción es más negativo en ese caso.
d)\(\Delta G = -nFE^{o} = -1 \times 96485 \frac{J}{V \: mol} \times (-0.545V) = 52583 \frac{J}{mol} = 52.6 \frac{kJ}{mol}\)
e)\(\Delta G = -nFE^{o} = -1 \times 96485 \frac{J}{V \: mol} \times (-0.575V) = 55479 \frac{J}{mol} = 55.5 \frac{kJ}{mol}\)
f)
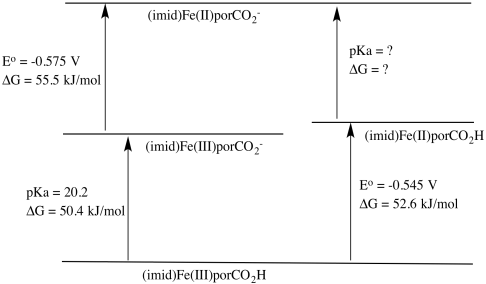
\[\Delta G_{Fe(II)CO_{2}H/CO_{2}^{-}} = 50.4 + 55.5 -52.6 \frac{kJ}{mol} = 53.3 \frac{kJ}{mol} \nonumber\]
\[\Delta G = -RT log K_{a} \nonumber\]
\[K_{a} = e^{(\frac{-\Delta G}{RT})} = e^{(\frac{-53300}{8.314 J/K mol \times 300K})} = e^{-21.4} \nonumber\]
pKa = 21.4
g) El complejo Fe (III) es más fácil de desprotonar porque produce una especie aniónica, mientras que el complejo Fe (II) produce una especie dianiónica. La mayor acumulación de carga en este último costaría más energía.
Ejercicio 1.8.1:
a)\(\ce{Cu -> Cu2O}\)\(\ce{MoO2 -> Mo}\)
\[\ce{2Cu -> Cu2O}\) \(\ce{MoO2 -> Mo} \nonumber\]
\[\ce{2Cu + H2O -> Cu2O}\) \(\ce{MoO2 -> Mo + 2H2O} \nonumber\]
\[\ce{2Cu + H2O -> Cu2O + 2H^{+}}\) \(\ce{4H^{+} + MoO2 -> Mo + 2H2O} \nonumber\]
\[\ce{2Cu + H2O -> Cu2O + 2H^{+} + 2e^{-}}\) \(\ce{4e^{-} + 4H^{+} + MoO2 -> Mo + 2H2O} \nonumber\]
\[2 \times (\ce{2 Cu + H2O -> Cu2O + 2H^{+} + 2e^{-}})\) \(\ce{4e^{-} + 4H^{+} + MoO2 -> Mo + 2H2O} \nonumber\]
agregando:
\[\ce{4Cu + 2H2O -> 2Cu2O + 4H^{+} + 4e^{-}} \nonumber\]
\[\ce{4e^{-} + 4H^{+} + MoO2 -> Mo + 2H2O} \nonumber\]
es igual
\[\ce{4Cu + MoO2 -> 2Cu2O + Mo} \nonumber\]
b)\(\ce{NH2OH -> N2}\)\(\ce{Ag2O -> Ag}\)
\[\ce{2NH2OH -> N2}\) \(\ce{Ag2O -> 2Ag} \nonumber\]
\[\ce{2NH2OH -> N2 + 2H2O}\) \(\ce{Ag2O -> 2Ag + H2O} \nonumber\]
\[\ce{2NH2OH -> N2 + 2H2O + 2H^{+}}\) \(\ce{2H^{+} + Ag2O -> 2Ag + H2O} \nonumber\]
\[\ce{2NH2OH -> N2 + 2H2O + 2H^{+} + 2e^{-}}\) \(\ce{2H^{+} + Ag2O + 2e^{-} -> 2Ag + H2O} \nonumber\]
agregando:
\[\ce{2NH2OH -> N2 + 2H2O + 2H^{+} + 2e^{-}} \nonumber\]
\[\ce{2H^{+} + Ag2O + 2e^{-} -> 2Ag + H2O} \nonumber\]
es igual
\[\ce{2NH2OH + Ag2O -> N2 + 2Ag + 3H2O} \nonumber\]
c)\(\ce{Fe3O4 -> Fe}\)\(\ce{CO -> CO2}\)
\[\ce{Fe3O4 -> 3Fe}\) \(\ce{CO -> CO2} \nonumber\]
\[\ce{Fe3O4 -> 3Fe + 4H2O}\) \(\ce{H2O + CO -> CO2} \nonumber\]
\[\ce{8H^{+} + Fe3O4 -> 3Fe + 4H2O}\) \(\ce{H2O + CO -> CO2 + 2H^{+}} \nonumber\]
\[\ce{8e^{-} + 8H^{+} + Fe3O4 -> 3Fe + 4H2O}\) \(\ce{H2O + CO -> CO2 + 2H^{+} + 2e^{-}} \nonumber\]
\[\ce{8e^{-} + 8H^{+} + Fe3O4 -> 3Fe + 4H2O}\) \(4 \times \ce{(H2O + CO -> CO2 + 2H^{+} + 2e^{-})} \nonumber\]
agregando:
\[\ce{8e^{-} + 8H^{+} + Fe3O4 -> 3Fe + 4H2O} \nonumber\]
\[\ce{4H2O + 4CO -> 4CO2 + 8H^{+} + 8e^{-}} \nonumber\]
es igual
\[\ce{Fe3O4 + 4CO -> 3Fe + 4CO2} \nonumber\]
d)\(\ce{I2 -> IO3^{-}}\)\(\ce{MnO4^{-} -> MnO2}\)
\[\ce{I2 -> 2IO3^{-}}\) \(\ce{MnO4^{-} -> MnO2} \nonumber\]
\[\ce{6H2O + I2 -> 2IO3^{-}}\) \(\ce{MnO4^{-} -> MnO2 + 2H2O} \nonumber\]
\[\ce{6H2O + I2 -> 2IO3^{-} + 12H^{+}}\) \(\ce{4H^{+} + MnO4^{-} -> MnO2 + 2H2O} \nonumber\]
\[\ce{6H2O + I2 -> 2IO3^{-} + 12H^{+} + 10e^{-}}\) \(\ce{3e^{-} + 4H^{+} + MnO4^{-} -> MnO2 + 2H2O} \nonumber\]
\[3 \times (\ce{6H2O + I2 -> 2IO3^{-} + 12H^{+} + 10e^{-}})\) \(10 \times (\ce{3e^{-} + 4H^{+} + MnO4^{-} -> MnO2 + 2H2O}) \nonumber\]
agregando
\[\ce{18H2O + 3I2 -> 6IO3^{-} + 36H^{+} + 30e^{-}} \nonumber\]
\[\ce{30e^{-} + 40H^{+} + 10 MnO4^{-} -> 10MnO2 + 20H2O} \nonumber\]
es igual
\[\ce{3I2 + 4H^{+} + 10MnO4^{-} -> 6IO3^{-} + 10 MnO2 + 2H2O} \nonumber\]
e)\(\ce{H3Mo7O24 -> Mo}\)\(\ce{S2O3^{2-} -> SO3^{2-}}\)
\[\ce{H3Mo7O24 -> 7Mo}\) \(\ce{S2Oe^{2-} -> 2SO3^{2-}} \nonumber\]
\[\ce{H3Mo7O24 -> 7Mo + 24H2O}\) \(\ce{3H2O + S2O3^{2-} -> 2So3^{2-}} \nonumber\]
\[\ce{45H^{+} + H3Mo7O24 -> 7MO + 24 H2O}\) \(\ce{3H2O + S2O3^{2-} -> 2SO3^{2-} + 6H^{+}} \nonumber\]
\[\ce{45e^{-} + 45 H^{+} + H3Mo7O24 -> 7Mo + 24 H2O}\) \(\ce{3H2O + S2O3^{2-} -> 2SO3^{2-} + 6H^{+} + 4e^{-}} \nonumber\]
\[4 \times (\ce{45 e^{-} + 21H^{+} + H3Mo7O24 -> 7Mo + 24 H2O})\) \( 45 \times (\ce{3H2O + S2O3^{2-} -> 2SO3^{2-} + 6H^{+} + 4e^{-}}) \nonumber\]
agregando:
\[\ce{180e^{-} + 180H^{+} + 4H3Mo7O24 -> 28 Mo + 96 H2O} \nonumber\]
\[\ce{135 H2O + 45 S2O3^{2-} -> 90 SO3^{2-} + 270 H^{+} + 180 e^{-}} \nonumber\]
es igual
\[\ce{4H3Mo7O24 + 45 S2O3^{2-} + 39 H2O-> 28 Mo + 90 SO3^{2-} + 90H^{+}} \nonumber\]
comprobando:
\[\ce{28Mo -> 28Mo}; \: \ce{90S -> 90S}; \: \ce{90H -> 90H}; \: \ce{270O -> 270O} \nonumber\]
Ejercicio 1.8.2:
a)\(\ce{Fe(OH)2 -> Fe2O3}\)\(\ce{N2H4 -> NH4^{+}}\)
\[\ce{2Fe(OH)2 -> Fe2O3}\) \(\ce{N2H4 -> 2NH4^{+}} \nonumber\]
\[\ce{2Fe(OH)2 -> Fe2O3 + H2O}\) \(\ce{N2H4 -> 2NH4^{+}} \nonumber\]
\[\ce{2Fe(OH)2 -> Fe2O3 + H2O + 2H^{+}}\) \(\ce{4H^{+} + N2H4 -> 2NH4^{+}} \nonumber\]
\[\ce{2Fe(OH)2 -> Fe2O3 + H2O + 2H^{+} + 2e^{-}}\) \(\ce{2e^{-} + 4H^{+} + N2H4 -> 2NH4^{+}} \nonumber\]
agregando:
\[\ce{2Fe(OH)2 -> Fe2O3 + H2O + 2H^{+} + 2e^{-}} \nonumber\]
\[\ce{2e^{-} + 4H^{+} + N2H4 -> 2NH4^{+}} \nonumber\]
es igual a:
\[\ce{2Fe(OH)2 + 2H^{+} + N2H4 -> Fe2O3 + H2O + 2NH4^{+}} \nonumber\]
en condiciones básicas:
\[\ce{2Fe(OH)2 + 2H^{+} + 2 OH^{-} + N2H4 -> Fe2O3 + H2O + 2NH4^{+} + 2OH^{-}} \nonumber\]
\[\ce{2Fe(OH)2 + 2H2O + N2H4 -> Fe2O3 + H2O + 2NH4^{+} + 2OH^{-}} \nonumber\]
\[\ce{2Fe(OH)2 + H2O + N2H4 -> Fe2O3 + 2NH4^{+} + 2OH^{-}} \nonumber\]
b)\(\ce{MnO4^{-} -> HMnO4^{-}}\)\(\ce{V^{3+} -> VO^{2+}}\)
\[\ce{MnO4^{-} -> HMnO4^{-}}\) \(\ce{V^{3+} + H2O -> VO^{2+}} \nonumber\]
\[\ce{H^{+} + MnO4^{-} -> HMnO4^{-}}\) \(\ce{V^{3+} + H2O -> VO^{2+} + 2H^{+}} \nonumber\]
\[\ce{e^{-} + H^{+} + MnO4^{-} -> HMnO4^{-}}\) \(\ce{V^{3+} + H2O -> VO^{2+} + 2H^{+} + e^{-}} \nonumber\]
agregando:
\[\ce{e^{-} + H^{+} + MnO4^{-} -> HMnO4^{-}} \nonumber\]
\[\ce{V^{3+} + H2O -> VO^{2+} + 2H^{+} + e^{-}} \nonumber\]
es igual a:
\[\ce{MnO4^{-} + V^{3+} + H2O -> HmnO4^{-} + VO^{2+} + H^{+}} \nonumber\]
bajo condiciones básicas:
\[\ce{MnO4^{-} + V^{3+} + H2O + OH^{-} -> HMnO4^{-} + VO^{2+} + H^{+} + OH^{-}} \nonumber\]
\[\ce{MnO4^{-} + V^{3+} + H2O _ OH^{-} -> HMNO4^{-} + VO^{2+} + H2O} \nonumber\]
\[\ce{MnO4^{-} + V^{3+} + OH^{-} -> HMnO4^{-} + VO^{2+}} \nonumber\]
Ejercicio 1.9.1:
Los enlaces al hierro se contraerían porque el aumento de la carga sobre el hierro atraería más fuertemente a los electrones donantes del ligando. Los enlaces al cobre se alargarían debido a la menor carga sobre el cobre.
Ejercicio 1.9.2:
- Lo más probable es que haya fuerzas repulsivas entre los ligandos si los enlaces se vuelven demasiado cortos.
- Un solapamiento insuficiente entre los orbitales de metal y ligando debilitaría el enlace y elevaría la energía.
- El rango de posibles longitudes de enlace se hace más amplio a medida que aumenta la energía. El enlace tiene más latitud, con enlaces tanto más largos como cortos permitidos a mayor energía.
Ejercicio 1.9.6:
Los reactivos y productos son muy similares en este caso. Sin embargo, el complejo Fe (III) tiene enlaces más cortos que el complejo Fe (II) debido a la mayor interacción electrostática entre el ión metálico y los ligandos. Estos cambios en la longitud del enlace necesarios para prepararse para cambiar de Fe (III) a Fe (II) (o al revés) representan una barrera importante para la reacción.
Ejercicio 1.9.7:
- El dibujo es una simplificación excesiva, pero en general las moléculas de agua se muestran reorientándose después de la transferencia de electrones debido a las interacciones ión-dipolo. En este caso, las aguas se muestran orientándose para presentar sus extremos negativos al átomo de hierro más positivo después de la transferencia de electrones. En realidad, en una proteína hay muchas otras cargas (incluidas las cargas en el ligando) que pueden tomar parte en interacciones adicionales ión-dipolo.
- Debido a que la transferencia de electrones es tan rápida, en realidad se piensa que las reorganizaciones atómicas y moleculares ocurren antes de la transferencia de electrones. Las moléculas de agua pasarían a cambiar a una posición que proporcionaría la mayor estabilización posible para los iones y luego se transferiría el electrón. Un disolvente menos polar que el agua sería menos capaz de estabilizar iones y el electrón sería más lento de transferir como resultado.
Ejercicio 1.10.1:
- octaédrico
- En la primera fila, 2 + complejos son casi siempre de alto giro. Sin embargo, los complejos 3 + a veces son de bajo espín.
c)
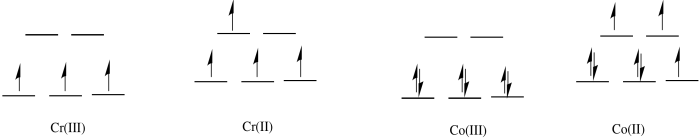
d) El complejo Co (II) es de alto espín y lábil. Los ligandos son fácilmente reemplazados por agua.
e) El complejo Cr (III) es solo d 3; es inerte.
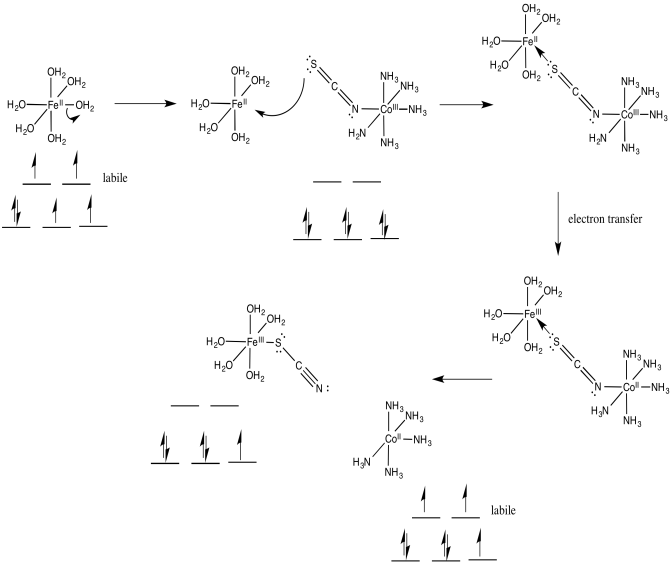
Ejercicio 1.10.3
Ejercicio 1.10.4:
a)
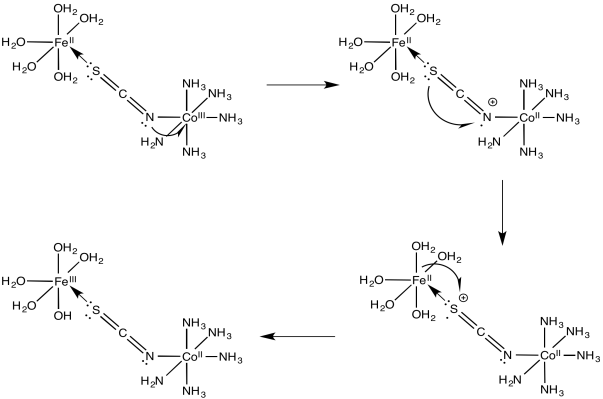
b)
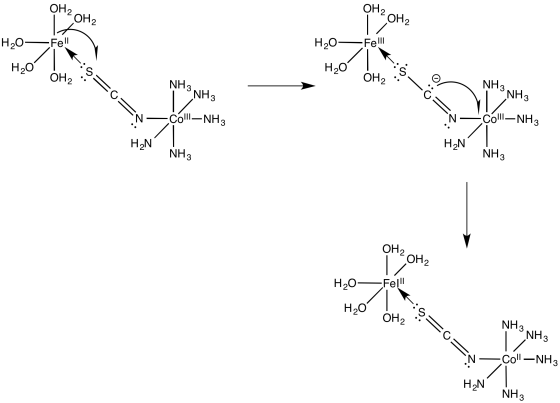
Ejercicio 1.11.1:
El compuesto se somete a una oxidación de dos electrones. La especie oxidada se somete entonces a una reducción de dos electrones.
Ejercicio 1.12.2:
a) CH 2 CHCH 3
| Bonos C-H | 6- |
| Bonos C-X | 0 |
| Nivel de oxidación | 6- |
CH 3 CH 2 CH 3
| Bonos C-H | 8- |
| Bonos C-X | 0 |
| Nivel de oxidación | 8- |
El propano es el resultado de una reducción de dos electrones de propeno.
b) CH 3 CH 2 CHO
| Bonos C-H | 6- |
| Bonos C-X | 2+ |
| Nivel de oxidación | 4- |
CH 3 CH 2 CH 2 OH
| Bonos C-H | 7- |
| Bonos C-X | 1_ |
| Nivel de oxidación | 6- |
El propanol es el resultado de una reducción de dos electrones del propanal.
c) CH 3 CH (OH) CH 2 CH 2 OH
| Bonos C-H | 8- |
| Bonos C-X | 2+ |
| Nivel de oxidación | 6- |
CH 3 COCH 2 CHO
| Bonos C-H | 6- |
| Bonos C-X | 4+ |
| Nivel de oxidación | 2- |
El 3-oxobutanal es el resultado de una oxidación de cuatro electrones de 1,3-butanodiol.
Ejercicio 1.12.3:
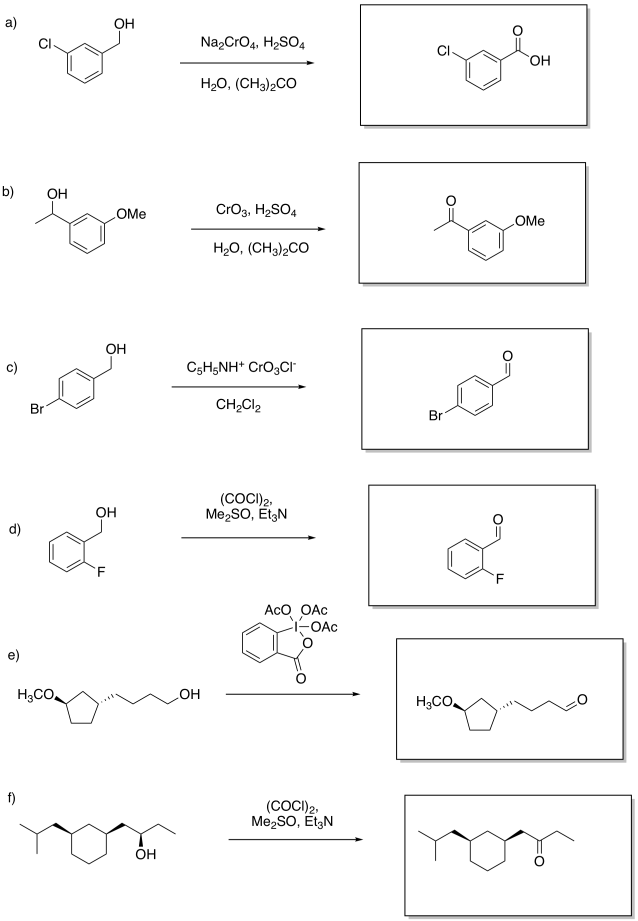
Ejercicio 1.12.4: