3.1: Intermedios
- Page ID
- 79473
A estas alturas ya está familiarizado con una variedad de tipos de reacciones en materia orgánica, inorgánica y bioquímica. El propósito de este capítulo es ayudarte a revisar algunas de las herramientas que utilizamos para comunicar cómo ocurren las reacciones.
Primero y foremeost, un mecanismo es una secuencia de intermedios. ¿Qué pasa con la estructura del compuesto a medida que sufre un cambio químico? ¿Ese cambio ocurre de una vez, o sucede por etapas? Si ocurre por etapas, ¿qué tipo de intermedios están involucrados?
Revisemos algunos tipos diferentes de intermedios reactivos que pueden ocurrir a lo largo de una ruta de reacción. Estos intermedios no son particularmente estables, por lo que pasan a reaccionar más hasta formar productos más estables.
Cationes
Los cationes y aniones pueden ser inestables por la simple razón de que la separación de carga cuesta energía. Hay algunos casos en los que estos iones son realmente bastante estables —vienen a la mente cationes alcalinos como Na + y aniones haluro como Cl — pero aquí nos interesa explorar los ejemplos menos estables y más temporales de iones.
A diferencia de los iones de sodio, los cationes de carbono, nitrógeno u oxígeno son reactivos. Estos átomos relativamente electronegativos no son muy estables con una carga positiva.

Los carbocationes, o iones de carbenio, en los que la carga positiva está en un átomo de carbono, son generalmente inestables. El carbono se encuentra en la parte superior derecha de la tabla periódica, por lo que no es particularmente electropositivo como el sodio. Una carga positiva sobre el carbono frecuentemente hace que una molécula sea reactiva. Sin embargo, este intermedio se encuentra frecuentemente durante las reacciones orgánicas.
¿Todos los carbocationes son igualmente inestables? No. En general, hay dos factores principales que estabilizan los carbocationes. El primero, y lo más importante, es el grado de sustitución. Un carbocatión terciario, en el que el carbono con la carga positiva está unido a otros tres átomos de carbono, es bastante estable. Un carbocatión primario, en el que el carbono que porta la carga positiva está unido solo a otro carbono y a dos átomos de hidrógeno, no es tan estable. Un carbocatión secundario, con el carbono positivo unido a otros dos carbonos y un átomo de hidrógeno, es intermedio en estabilidad. Por supuesto, un catión metilo, en el que un carbono positivo está unido a tres átomos de hidrógeno, no es muy estable en absoluto.
Las razones de estas diferencias a veces se explican en términos de hiperconjugación. Según esta idea, las interacciones débiles entre el orbital p desocupado en el carbono positivo y los enlaces sigma ocupados en los carbonos vecinos pueden estabilizar un poco el catión. Muy vagamente, imagínese que estos enlaces, que están hechos de pares de electrones, pueden permitir que un poco de carga negativa se superponga con el catión, disminuyendo su carga positiva general apenas un poco. Más correctamente, el orbital p vacío puede interactuar con los enlaces sigma para producir dos combinaciones orbitales moleculares; una de ellas es una combinación en fase y es menor en energía que cualquiera de los orbitales originales, mientras que la otra combinación fuera de fase es un poco más alta en energía. Porque solo están involucrados dos electrones, del enlace sigma, ambos pueden llegar a un nivel de energía más bajo de esta manera. Ambos caen en la combinación de energía más baja. En ese sentido, el catión es estable no sólo porque la carga positiva es menor, sino porque los enlaces vecinos pueden caer menos en energía.
El segundo factor que estabiliza la carga positiva es la deslocalización por resonancia. Si un doble enlace es adyacente a un catión, la conjugación entre orbitales p llenos y vacíos permite que la carga positiva se distribuya a través de múltiples átomos de carbono. Este efecto disminuye la cantidad de carga positiva transportada por un átomo de carbono. Este tipo de efecto deslocalizador es muy común en la estabilización de intermedios reactivos. Por esta razón, los cationes alílicos (CH 2 =CH-CH 2 +) y bencílicos (C 6 H 5 CH 2 +) son particularmente estables. Son casi tan estables como un catión secundario a lo largo de una cadena carbonada regular, aunque de otra manera serían solo cationes primarios.
Por supuesto, otros átomos también pueden ser cationes. Como se vio anteriormente, los oxígenos y nitrógenos se encuentran muy comúnmente como cationes. Eso se debe en parte a que son muy buenos para donar electrones a átomos vecinos necesitados.
Identificar el átomo positivo en cada una de las siguientes moléculas.

- Contestar
-

Dentro de cada grupo, clasificar los cationes de más estables a menos estables.

- Contestar
-

A veces, los grupos remotos proporcionan estabilización adicional para un catión. Indicar si cada uno de los siguientes cationes sería más estable o menos estable que un catión bencilo, y explicar por qué.

- Contestar
-

Hay otros factores más sutiles que pueden influir en la estabilidad de los cationes. La estabilidad de la carga se ve afectada por la estructura más alejada del átomo que lleva la carga. Por ejemplo, un catión trietilamonio y un catión trimetilamonio se ven bastante similares. Sin embargo, un catión trietlamonio es un poco menos estable que un catión trimetilamonio.

La diferencia en estos cationes está relacionada con el tamaño de la molécula global. Las reacciones suelen tener lugar en un disolvente. El solvente juega un papel importante; permite que los reactivos se muevan, modera el flujo de calor e incluso puede proporcionar pares solitarios o protones para ayudar en las reacciones ácido/base. Un catión o anión ocurre con mayor frecuencia en solución. Debido a que la estabilidad de la carga es un gran problema, el solvente también ayudará a estabilizar la carga. Para ello, las moléculas de disolvente se organizarán de manera favorable alrededor del catión. Cuanto más grande sea el catión, más moléculas de solvente serán necesarias para disponer los elfos alrededor de él.

Aniones
Los iones cargados negativamente también son intermedios comunes en las reacciones. Al igual que los cationes, los aniones son frecuentemente especies inestables. Estas especies se estabilizan por una serie de factores diferentes, no a diferencia de la estabilidad catiónica.
Carbaniones, iones amida e iones alcóxido son ejemplos de intermedios aniónicos.

Recuerde, solo hay algunos factores clave que explican una gran cantidad de preguntas sobre la estabilidad aniónica.
Dentro de una columna de la tabla periódica, al comparar dos átomos con carga negativa, la estabilidad de los aniones depende principalmente de la polarizabilidad del átomo. La polarizabilidad se refiere a la facilidad con la que se distorsionan los electrones alrededor del átomo. Cuanto más grande es el átomo, y cuanto más alejados están los electrones del núcleo, más polarizable es. Cuanto más polarizable es el átomo, más estable es el anión.
Dentro de una fila de la tabla periódica, cuanto más electronegativo sea un átomo, más estable será el anión.
Dentro de cada grupo, clasificar los aniones de más estables a menos estables.

- Contestar
-

A veces, los grupos remotos proporcionan estabilización adicional para un catión. Indicar si cada uno de los siguientes aniones sería más estable o menos estable que un anión fenóxido, y explicar por qué.

- Contestar
-

Radicales
Los radicales son especies con un electrón desapareado. Son reactivos porque son cortos un octeto, pero la presencia de un electrón desapareado significa que reaccionan de una manera diferente a los electrófilos típicos. Los compuestos de carbono, nitrógeno y oxígeno muestran algunos ejemplos típicos de estructuras radicales.
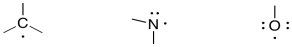
Tenga en cuenta que estos radicales no necesariamente tienen cargos. Eso es porque se están uniendo a un átomo menos de lo normal, pero están reteniendo solo uno de los electrones del enlace faltante. De hecho, los radicales a menudo se forman rompiendo un enlace dentro de un compuesto normal, de “caparazón cerrado”, de tal manera que cada átomo involucrado en el enlace lleva consigo uno de los electrones. Esto se llama “homólisis de enlace” e implica que el enlace se divide uniformemente entre los átomos. En contraste, “heterólisis de enlace” significa que el enlace se rompe de manera desigual, con un átomo que conecta ambos electrones.
Confirmar que no existe ningún cargo formal en cada una de las especies arriba indicadas.
- Contestar a
-
a) cargo formal = # e - en tabla periódica - # e - sin vinculación - (# e - en bonos) /2
cargo formal = 4 - 1 - 6/2 = 0
- Respuesta b
-
b) carga formal = # e - en tabla periódica - # e - sin vinculación - (# e - en bonos) /2
cargo formal = 5 - 3 - 4/2 = 0
- Respuesta c
-
c) cargo formal = # e - en tabla periódica - # e - sin vinculación - (# e - en bonos) /2
cargo formal = 6 - 5 - 2/2 = 0
Los iones radicales también son posibles. Los aniones radicales pueden ser el resultado de la adición de un electrón extra a un compuesto normal de caparazón cerrado. Los cationes radicales pueden resultar a través de la eliminación de un electrón de un compuesto normal de caparazón cerrado.
Debido a que los radicales son especies deficientes en electrones, en el sentido de que carecen de octeto, a menudo son estabilizados por los mismos factores que estabilizarían un catión. En particular, se estabilizan por deslocalización por resonancia, y los radicales de carbono son más estables en los carbonos más sustituidos que en los carbonos menos sustituidos, al igual que los cationes. Sin embargo, generalmente son menos sensibles que los cationes a estos factores, porque en realidad no tienen una carga positiva.
Dentro de cada grupo, clasificar los radicales de más estables a menos estables.

- Contestar
-

Carbenos y Nitrenos
No solemos ver carbenos y los nitrenos relacionados, pero son intermedios importantes en procesos sintéticos que implican adición electrófila a alquenos. Los carbenos y los nitrenos son dos electrones por debajo de un octeto, pero no tienen una carga formal.

Los carbenos son inusuales porque pueden considerarse tanto electrófilos como nucleófilos. Los tienen pares solitarios —el requisito habitual para un nucleófilo. También tienen un orbital vacío, lo que normalmente los haría electrófilos.

Debido a que carecen de octeto, los carbenos y los nitrenos pueden estabilizarse a través de pi-donatina.
Organice los siguientes carbenos en orden de los más estables a los menos estables.

- Contestar
-

Complejos de Coordinación
En las siguientes imágenes, decida si el ligando es un donante aniónico o neutro. Use el símbolo correcto (una línea o una flecha) para representar el enlace ligando-metal. Asigne el estado de oxidación al metal para satisfacer la carga general.

- Contestar
-


