8.8: Soluciones a problemas seleccionados
- Page ID
- 79466
Ejercicio 8.1.1:
- \(A = \varepsilon c l = 6 \frac{L}{mol \: cm} \times 0.01 \frac{mol}{L} \times 1 cm = 0.60 = 60 \%\)
- \(A = \varepsilon c l = 3000 \frac{L}{mol \: cm} \times 3.5 \times 10^{-5} \frac{mol}{L} \times 1 cm = 0.105 = 10.5 \%\)
- \(A = \varepsilon c l = 1.4 \frac{L}{mol \: cm} \times 0.25 \frac{mol}{L} \times 0.5 cm = 0.175 = 17.5 \%\)
- \(A = \varepsilon c l = 23000 \frac{L}{mol \: cm} \times 2.5 \times 10^{-6} \frac{mol}{L} \times 1 cm = 0.0575 = 5.75 \%\)
- \(A = \varepsilon c l = 14000 \frac{L}{mol \: cm} \times 0.015 \frac{mmol}{L} \times 1 cm = 14000 \frac{L}{mol \: cm} 0.015 \times 10^{3-} \frac{mol}{L} \times 1 cm = 0.21 = 21 \% \)
Ejercicio 8.1.2:
- \( \varepsilon= \frac{A}{cl} = \frac{0.30}{(0.01 mol \: L^{1-} \times 1 cm)} = 30 \frac{L}{mol \: cm}\)
- \( \varepsilon = \frac{A}{cl} = \frac{0.25}{(0.025 mol \: L^{-1} \times 1cm)} = 10 \frac{L}{mol \: cm}\)
- \( \varepsilon = \frac{A}{cl} = \frac{0.30}{(0.01 mol \: L^{-1} \times 1cm)} =543 \frac{L}{mol \: cm}\)
- \( \varepsilon = \frac{A}{cl} = \frac{0.66}{(0.025 mmol \: L^{-1} \times 1cm)} = 26400 \frac{L}{mol \:cm}\)
Ejercicio 8.1.3:
- azul
- rojo
- naranja
- violeta
- verde
Ejercicio 8.1.4:
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{1 \times 10^{-5}m} = 1.98 \times 10^{-20} J\)
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{125 \times 10^{-9}m} = 1.59 \times 10^{-18} J\)
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{1025 \times 10^{-9}m} = 1.94 \times 10^{-19}J\)
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{450 \times 10^{-6}m} = 4.42 \times 10^{-22}J\)
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{850 \times 10^{-10}m} = 2.3 \times 10^{-18}J\)
Ejercicio 8.1.5:
- \(\lambda = \frac{hc}{E} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{1.46 \times 10^{-17} J} =1.36 \times 10^{-8} m\)
- \(\lambda = \frac{hc}{E} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{4.72 \times 10^{-24} J} =4.21 \times 10^{-2} m\)
- \(\lambda = \frac{hc}{E} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{-8} m \: s^{-1})}{9.26 \times 10^{-17} J} =2.15 \times 10^{-19} m\)
Ejercicio 8.1.6:
- \(E = h \nu = \frac{hc}{\lambda}\); así\(v = \frac {c}{\lambda}\); o\(\lambda = \frac{c}{v} = \frac{3.0 \times 10^{8} m \: s^{-1}}{6.7 \times 10^{10} s^{-1}}=4.48 \times 10^{-3} m \)
- \( \lambda = \frac{c}{v} = \frac{3.0 \times 10^{8} m \: s^{-1}}{1500 \times 10^{6} s^{-1}} = 0.2m\)
- \(v = \frac{c}{\lambda} = \frac{3.0 \times 10^{8} m \: s^{-1}}{9.8 \times 10^{-10}m} = 3.06 \times 10^{15} s^{-1}\)
- \(v \frac{c}{\lambda} = \frac{3.0 \times 10^{8} m \: s^{-1}}{4.3 \times 10^{-12}m}= 7.0 \times 10^{19} s^{-1}\)
Ejercicio 8.1.7:
a)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js \:mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{(1mm \times 10^{-3}m \: mm^{-1})} = 1.99 \times 10^{-22}J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 1.99 \times 10^{-22} J \times 6.02 \times 10^{23} mol^{-1} = 120 J mol^{-1} = 0.12 kJ \: mol^{-1}\)
b)\(E = \frac{hc}{lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 times 10^{8} m \: s^{-1})}{(1000nm \times 10^{-9} m \: nm^{-1})} = 1.99 \times 10^{-19}J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 1.99 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 120000 J \: mol^{-1} = 120 kJ \: mol^{-1}\)
c)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{(1m)} = 1.99 \times 10^{-25} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 1.99 \times 10^{-25} J \times 6.02 \times 10^{23} mol^{-1} = 0.120 J \: mol^{-1} = 1.2 \times 10^{-4} kJ \: mol^{-1} \)
d)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js mol^{-1} \times 3.0 \times 10^{8} m s^{-1})} = {(500 nm \times 10^{-9} m \: nm^{-1})} = 3.98 \times 10^{-19} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 3.98 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 239000 J mol^{-1} = 239 kJ\: mol^{-1}\)
Ejercicio 8.1.8:
Azul.
Ejercicio 8.1.9:
La luz ultravioleta, con una longitud de onda más corta que la luz visible, es mucho mayor en energía y potencialmente más dañina.
Ejercicio 8.2.3:
- \(d \rightarrow d\)
- \( \pi \rightarrow \pi * \)
- MLCT
Ejercicio 8.2.4:
- El de la izquierda puede relajarse canalizando algo de energía hacia la vibración molecular, especialmente su isomerización cis-trans. El de la derecha no puede hacer eso porque su rotación está restringida por la presencia del anillo.
- ¡Por supuesto! Está rebosante de enlaces pi. Parece probable una fuerte transición pi-pi* en la región visible.
- Probablemente no. No tiene rotación restringida, por lo que la ruta de isomerización cis-trans está disponible para la relajación.
- \(A = \varepsilon bc\); entonces\( \varepsilon = \frac{A}{bc} = \frac{0.77}{1cm \times 10^{-6}M} = 7.7 \times 10^{5} M^{-1} cm^{-1}\)
- Esa es una gran constante de absortividad molar. Está permitido.
- Sin duda esta es esa transición pi-pi* en la que estábamos pensando antes.
- Si el compuesto se une al zinc, probablemente lo haga a través de la coordinación bidentada. El anillo resultante restringe los grados de libertad en el compuesto por lo que no puede someterse a isomerización cis-trans, cerrando una ruta hacia una rápida relajación.
i) Un compuesto como este podría ser utilizado para detectar iones metálicos como Zn 2+. Debido a que la cantidad de fluorescencia depende fuertemente de la concentración de Zn 2+, podría usarse para medir la cantidad del ion presente.
Ejercicio 8.2.5:
a)
b) Un complejo naranja absorbería la luz azul, su color complementario.
c) Un láser azul funcionaría. Tal vez en algún lugar alrededor de 476 nm.
d) Observe los resultados de un sitio Re (II), porque ha transferido un electrón al ligando.
e)
f) Los potenciales de reducción (1.4 V > 0.3 V) sugieren transferencia del cobre (I) al renio (II).
g) i) Los tramos de carbonilo se observarían en algún lugar alrededor de 2000 cm -1.
iii) La transferencia de electrones del sitio Cu (I) al Re (II) resultaría en un sitio Re (I). El tramo de carbonilo se desplazaría a un número de onda más bajo. Esto se debe a que el menor estado de oxidación en el metal da como resultado una mayor unión hacia atrás a los carbonilos aceptores de π.
iii) A esa distancia, parece probable un mecanismo de esfera externa; no está claro cómo algo podría puentear esa distancia, aparte de la propia cadena peptídica, que probablemente carece de conjugación suficiente para conducir electrones.
h) El triptófano actúa como un escalón entre el cobre y el renio. La fenilalanina, con un mayor potencial de reducción que el renio, no lo hace.
i)
Ejercicio 8.3.1:
a)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js mol^{-1} \times 3.0 \times 10^{8} m s^{-1})}{(180 nm \times 10^{-9} m \: nm^{-1})} = 1.10 \times 10^{-18}J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 1.10 \times 10^{-18} J \times 6.02 \times 10^{23} mol^{-1} = 665000 J mol^{-1} = 665 kJ \: mol^{-1}\)
Para comparación, el enlace C-H relativamente fuerte y no reactivo en metano tiene una energía de disociación de enlace de solo 440 kJ mol -1. (Ese es un valor termodinámico; romper realmente el enlace costaría más entrada de energía, superar la barrera de energía cinética para la escisión del enlace).
b)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} J \: s \: mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{(476 nm \times 10^{-9} m \: nm^{-1})} = 4.17 \times 10^{-19} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 4.42 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 251000 J \: mol^{-1} = 251 kJ \: mol^{-1}\)
c)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} J s \: mol^{-1} \times 3.0 \times 10^{8} ms^{-1})}{(645 nm \times 10^{-9} m \: nm^{-1})} = 3.08 \times 10^{-19} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 3.08 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 138000 J mol^{-1} = 138 kJ mol^{-1}\)
Ejercicio 8.3.2:
a)\( \lambda = \frac{1}{wavenumber} = \frac{1}{3105 cm^{-1}} = 3.22 \times 10^{-4} cm \times 0.01 m \: cm^{-1} = 3.22 \times 10^{-6} m \)
\[E = \frac{hc}{\lambda} \nonumber\]
\[E = \frac{(6.625 \times 10^{-34} J s \: mol^{-1} \times 3.0 \times 10^{8} m s^{-1})}{(3.22 \times 10^{-6}m)} = 6.17 \times 10^{-20} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 6.17 \times 10^{-20} J \times 6.02 \times 10^{23} mol^{-1} =37000 J \: mol^{-1} = 37 kJ mol^{-1}\)
b)\(\lambda = \frac{1}{wavenumber} = \frac{1}{1695 cm^{-1}} = 5.90 \times 10^{-4} cm \times 0.01 m cm^{-1} = 5.90 \times 10^{-6} m\)
\[E = \frac{hc}{\lambda} \nonumber\]
\[E = \frac{(6.625 \times 10^{-34} J \: s \: mol^{-1} \times 3.0 \times 10^{8} ms^{-1})} {(3.22 \times 10^{6} m)} = 3.37 \times 10^{-20} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 3.37 \times 10^{-20} J \times 6.02 \times 10^{23} mol^{-1} = 20000 J mol^{-1} = 20 kJ mol^{-1}\)
c)\(\lambda = \frac{1}{wavenumber} = \frac{1}{963 cm^{-1}} = 1.04 \times 10^{-3} cm \times 0.01 m \: cm^{-1} = 1.04 \times 10^{-5}\)
\[E = \frac{hc}{\lambda} \nonumber\]
\[E = \frac{(6.625 \times 10^{-34} J s mol^{-1} \times 3.0 \times 10^{8} m s^{-1})}{(1.04 \times 10^{-5} m )} = 1.91 \times 10^{-20} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 1.91 \times 10^{-20} J \times 6.02 \times 10^{23} mol^{-1} = 11500 J mol^{-1} = 11.5 kJ mol^{-1}\)
Ejercicio 8.3.3:
a)
b) Ru (bpy) 3 2+ sería un terrible agente reductor. El potencial de reducción de Ru (bpy) 3 3+ es muy alto. Eso significa que Ru (bpy) 3 2+ no renunciaría muy fácilmente a un electrón.
c)\(\Delta G = -n F E^{0}\)
\[\Delta G = -1 \times 97485 J V^{-1}mol^{-1} \times 1.26 V = -123 kJ mol^{-1} \nonumber\]
d) Se absorbe en la parte azul del espectro y aparece naranja.
e) Absorbe muy fuertemente, por lo que probablemente no d-d. Probablemente es MLCT, desde el rutenio hasta el π* en el ligando bpy
f)\(E = \frac {hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 3.0 \times 10^{8} m s^{-1})}{(450 nm \times 10^{-9} m \: nm^{-1})} = 4.42 \times 10^{-19} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 4.42 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 266000 J mol^{-1} = 266 kJ mol^{-1}\)
g) Ru 2+ sería de bajo giro d 6, un estado fundamental singlete. El estado excitado también será un estado singlete.
h) 615 nm se encuentra en la región naranja del espectro. Esta es la luz que desprende el complejo ya que se relaja, por lo que es el color que vemos.
i)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.625 \times 10^{-34} Js mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{(615 nm \times 10^{-9} m \: nm^{-1})} = 3.23 \times 10^{-19} J \nonumber\]
Eso es por una molécula. Sobre una base por mol,\(E = 3.23 \times 10^{-19} J \times 6.02 \times 10^{23} mol^{-1} = 195000 J \: mol^{-1} = 195 kJ \: mol^{-1}\)
j) Turno Stokes\( =615 nm - 450 nm = 165nm\)
k)\(\Delta E = E_{1} - E_{2} = 266 - 195 kJ \: mol^{-1} = 71 kJ \: mol^{-1}\)
Sin embargo, no se perdería todo a la vez, sino en pequeños incrementos equivalentes a las diferencias entre estados vibracionales.
l) Si tuviéramos que reducir Ru (bpy) 3 3+ directamente a un estado excitado, llegaríamos a un estado mucho más alto en energía que el estado fundamental. Esa reducción sería más difícil de lograr. En este caso, el estado final sería 195 kJ mol -1 mayor que Ru (bpy) 3 2+.
\[\Delta G = 195 - 123 kJ \: mol^{-1} = 72 kJ \: mol^{-1} \nonumber\]
\[E^{0} = \frac{- \Delta G}{nF} = -\frac{(72 kJ \: mol^{-1} \times 1000 kJ \: J^{-1})}{(1 \times 96485 J: V^{-1} mol^{-1})} = -0.75V \nonumber\]
m) La oxidación de Ru (bpy) 3 2+ * sería muy favorable en comparación con la oxidación de Ru (bpy) 3 2+. El primero es un agente reductor mucho mejor.
Ejercicio 8.5.1:
Cuanto más larga sea la longitud de onda, menor será la energía. Los fotones de longitud de onda superior a 240 nm no tendrían suficiente energía para superar la barrera para la reacción de escisión de dioxígeno.
Ejercicio 8.5.2:
Según la relación Planck-Einstein:
\[E = h \nu \nonumber\]
o, desde\(V = \frac{c}{\lambda}\)
\[E = \frac{hc}{\lambda} \nonumber\]
en el que h = Constante de Planck = 6.625 x 10 -34 Js,
c = velocidad de la luz = 3.0 x 10 8 m/s,
ν = frecuencia,
λ = longitud de onda.
a)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.525 \times 10^{-34} Js)(3.0 \times 10^{8} m/s)}{(200 nm)(10^{-9} m/nm)} \nonumber\]
\[E = 9.03 \times 10^{-19} J \nonumber\]
b)\(E = \frac{hc}{\lambda}\)
\[E = \frac{(6.525 \times 10^{-34} Js)(3.0 \times 10^{8} m/s)}{(325nm)(10^{-9} m/nm)} \nonumber\]
\[E = 6.12 \times 10^{-19}J \nonumber\]
Ejercicio 8.5.3:
Recuerde, el mol es la unidad de conversión de la escala molecular a la escala macroscópica.
a)\(E = (8.28 \times 10^{-19} J/photon)(6.02 \times 10^{23} photons/mol)\)
\[E = 543770 \frac{J}{mol} \nonumber\]
\[E = 544 \frac{kJ}{mol} \nonumber\]
b)
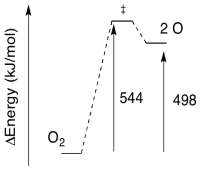
Ejercicio 8.5.4:
a)\(E = (6.12 \times 10^{-19} J/photon)(6.02 \times 10^{23} photons/mol)\)
\[E = 368146 \frac{J}{mol} \nonumber\]
\[E = 368 \frac{kJ}{mol} \nonumber\]
b)

Ejercicio 8.5.5:
Las reacciones deben tomar el mismo camino, y sobrepasar la misma barrera, adelante y atrás.
a) La barrera inversa:\(E = 544-498 \frac{kJ}{mol}\)
\[E = 46 \frac{kJ}{mol} \nonumber\]
b) La barrera inversa:\(E = 368 - 105 \frac{kJ}{mol}\)
\[E = 263 \frac{kJ}{mol} \nonumber\]
Ejercicio 8.6.1:
- El PDI original tiene un máximo de absorción a poco menos de 500 nm. Absorbe azul-verde, por lo que se esperaría que apareciera rojo-anaranjado.
- La longitud de onda más larga absorbida es de aproximadamente 625 nm.
- \(E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{8} m s^{-1})}{625 \times 10^{-9} m} = 3.18 \times 10^{-19} J \)
Esa es la energía de un fotón. Un mol de fotones tendría energía multiplicada por el número de Avogadro, N A.
\[E = 3.18 \times 10^{-19} J \times NA = 3.18 \times 10^{-19} \times 6.02 \times 10^{23} mol^{-1} = 1.91 \times 10^{5} J \: mol^{-1} = 191 kJ mol^{-1} \nonumber\]
d) Si nos aproximamos\(E = \Delta G\), y dado que\(\Delta G = -NFE^{0}\)
Entonces para esta excitación de un solo electrón,\(E^{0} = \frac{- \Delta G}{nF} = \frac{-1.91 \times 10^{5} J \: mol^{-1}}{(1 \times 96485 J \: V^{-1} mol^{-1})} = -1.97 V\)
e)
f) Dada la estructura del PDI, la transición es probablemente π —> π*.
g) La longitud de onda más larga absorbida se desplaza hacia el rojo, a aproximadamente 700 nm, después de sumergirse en ácido. La energía de la transición se reduce a
\[E = \frac{hc}{\lambda} = \frac{(6.625 \times 10^{-34} Js \: mol^{-1} \times 3.0 \times 10^{8} m \: s^{-1})}{300 \times 10^{-9} m} = 2.84 \times 10^{-19} J \nonumber\]
\[E = 2.84 \times 10^{-19} J \times NA = 3.18 \times 10^{-19} \times 6.02 \times 10^{23} mol^{-1} = 1.71 \times 10^{5} J \: mol^{-1} = 171 kJ \: mol^{-1} \nonumber\]
h) Estas moléculas muy planas probablemente puedan apilarse muy firmemente juntas. La distancia entre los electrones π en una molécula y el orbital π* en una molécula vecina es muy pequeña. Es posible una transición intermolecular.
i) ¿Qué sucede cuando la película se sumerge en ácido? Se protonó. Los grupos fosfato aniónicos se neutralizarían. Las moléculas serían capaces de apilarse aún más juntas, disminuyendo la energía requerida para excitar un electrón de una molécula a otra.
j) El inicio de la onda de reducción parece ser de aproximadamente -0.40 V, como lo muestra el pico en el voltamograma cíclico.
k)
l)
m)\(E^{0}_{(_{vs}Ag+/AgCl)} = E^{0}_{(_{vs}NHE)} + 0.20 V\) (es decir, el potencial de reducción positiva de Ag+ vs NHE indica que un electrón es
i)\(E^{0}_{(_{vs} Ag+/AgCl)} = -0.10V + 0.20V = + 0.10 V\)
ii)\(E^{0}_{(_{vs}Ag+/AgCl)} = + 1.23 V + 0.20 V = + 1.43V\)
iii)\(E^{0}_{(_{vs}Ag+/AgCl)} = +0.83V + 0.20V = + 1.03V\)
n) El estado excitado se puede reducir colocando un electrón en el agujero desocupado por el electrón excitado. Este nivel es 1.97 V por debajo de la banda de conductancia en energía, la cual tiene un potencial de reducción de -0.40 V (su potencial es 1.97 V más positivo que la banda de conductancia).
Así,\(-0.40V + 1.97V = + 1.57V\).
o)
p)
q) Los fosfatos probablemente se coordinan con el óxido de cobalto, formando un puente para la transferencia de electrones.
Ejercicio 8.6.2:
- \(\ce{Ag^{+}_{(aq)} + NO_{3}^{-}_{(aq)} + Bu_{4}N^{+}_{(aq)} + Br^{-}_{(aq)} -> AgBr_{(s)} + Bu_{4}N^{+}_{(aq)} + NO_{3}^{-}_{(aq)}}\)
- Absorben en la gama violeta-azul y aparecerían amarillo-naranja.
- Un nanómetro es de 10 a 9 m, mientras que un picómetro es de 10 a 12 m. Una picopartícula es 1,000 veces menor que una nanopartícula.
- Absorben a través del espectro visible y aparecen negros.

